西藏林芝地区间日疟原虫PvMSP-3α基因多态性研究*
李军伟,周水森,黄 芳
疟疾是世界上危害最严重的虫媒传播寄生虫病之一,主要集中于热带、亚热带和温带边远地区,全球约有40%的人处于疟疾的威胁之下。据WHO报告,2009年全球有2.25亿疟疾病例,死亡约78.1万人[1]。在引起疟疾的四种疟原虫中,间日疟原虫是最普遍世界分布最广的。西藏林芝地区是西藏自治区唯一有疟疾发生与流行的地区[2],其所辖的墨脱县和察隅县历来是疟疾流行区,自1986-2008年累计报告疟疾病例2 296例,由于该地区人口少,发病率居全国第一,而且近年来呈逐步增多及向周边蔓延的趋势。根据往年的血检调查,表明该地区以间日疟传播为主。
间日疟原虫裂殖子表面蛋白3(Plasmodium vivaxmerozoite surface protein-3,PvMSP-3)是存在于间日疟原虫裂殖子的重要表面抗原,包括3个不同的种内特异基因:PvMSP-3α、PvMSP-3β和PvMSP-3γ。PvMSP-3α分子量约148~150kD,富含丙氨酸,能诱导产生一种抗体依赖细胞介导的免疫力[3]。PvMSP-3α既是疟疾疫苗开发的重要候选抗原之一,同时也是疟疾分子流行病学重要的分子标志。目前,国内外研究都证实PvMSP-3α有不同的基因型,存在广泛的多态性[4-5]。以往大量研究证明:不同地理株的间日疟对媒介按蚊的感染力和对宿主的免疫原性等均有不同,同时它们对抗疟药物的治疗反应亦有明显的差异[6]。目前,我国已经进入了疟疾消除阶段,对西藏林芝地区间日疟原虫进行相关分子标志研究很有必要。本文利用PCRRFLP技术,以PvMSP-3α为分子标志,对采自西藏林芝的间日疟原虫进行群体遗传多态性进行分析,了解当地间日疟的遗传多态性,为当地制定有效的疟疾消除措施提供科学依据。
1 材料与方法
1.1 样本采集 间日疟原虫采自西藏林芝地区有疟疾症状,且显微镜检查疟原虫为阳性的患者,征得患者同意后采集滤纸血或血涂片,共得到35份样品。
1.2 疟原虫基因组DNA的提取 采用QIAGEN公司的QIAamp DNA Mini Kit(250)试剂盒按照说明书步骤对滤纸血或血片进行处理。
1.3 间日疟原虫PvMSP-3α基因扩增 PvMSP-3α基因扩增参照文献[7],以巢式PCR方法进行,第一轮PCR 反应体系为 20Ul,引物为,Pl:5′-CAG CAG ACA CCA TTT AAG G-3′,P2:5′-CCG TTT GTT GAT TAG TTG C-3′,以1Ul第一轮PCR产物为第二轮PCR反应的模板,第二轮反应的体系为20Ul,引物为,Nl:5′-GAC CAG TGT GAT ACC ATT AAC C-3′,N2:5′-ATA CTG GTT CTT CGT CTT CAG G-3′。反应条件如下,第一轮PCR:94℃预变性2min,94℃30s,56 ℃ 30s,68℃2.5min,共30个循环,72℃延伸10min;第二轮PCR:94℃预变性2min,94℃30s,56℃30s,68℃2.5min,共30个循环,72℃延伸10min。PCR产物于l%琼脂糖凝胶(含5μg/mL溴化乙锭)中2v/cm电泳约60min,紫外灯下观察,凝胶成像仪中拍照记录结果。
1.4 PCR产物酶切分析 取5UlPCR产物,分别用限制性内切酶AluI和HhaI在20Ul反应体系中(5U酶/反应),37℃水浴4h,2.0%琼脂糖凝胶(5μg/mL溴化乙锭)电泳后,紫外灯下观察,凝胶成像仪中拍照记录结果。
2 结 果
2.1 PvMSP-3α分型结果 对 PvMSP-3α进行扩增,产生1 900bp和1 500bp两种不同目的条带,依据目的条带的长度不同将其分为A型(1.9kb)和B型(1.5kb)(图1)。35份疟疾患者血样成功扩出PvMSP-3α基因的为31份(88.6%),未发现混合条带,其中A型占90.3%(28/31),B型占9.7%(3/31)。
2.2 PvMSP-3α的 RFLP 结果 PvMSP-3α的目的条带用HhaⅠ限制性内切酶进行酶切,A型和B型酶切后在1 000bp处均出现了清晰的条带(图2A)。A型酶切后出现6种不同的亚型,其中最常见的是在1 000bp、400bp和200bp处出现条带。B型酶切后产生1种亚型。如果酶切片段总和大于酶切前片段则可以认为是混合感染[8]。将本实验酶切后的结果与酶切前比较发现没有混合感染。PvMSP-3α的目的条带用AluⅠ限制性内切酶进行酶切,A型和B型酶切后在500bp处均出现了清晰的条带(图2B)。A型酶切后出现4种不同的亚型,其中最常见的是在500bp、200bp和150bp处出现条带。B型酶切后产生1种亚型。PvMSP-3α的目的条带用HhaⅠ和AluⅠ限制性内切酶进行酶切结果各基因型频率分布见表1。

图1 PvMSP-3α扩增结果1-28:为 A型,29-31:为B型,M 为 DNA标志物Fig.1 Amplification of PvMSP-3α1-28:Type A;29-31:Type B;M:DNA marker
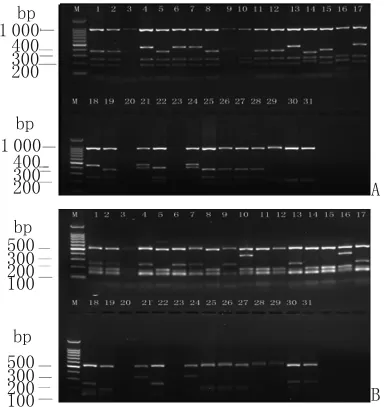
图2 PvMSP-3α扩增片段内切酶图谱A:样本HhaI内切酶产物图谱,B:样本AluI内切酶产物图谱,M为DNA标志物。Fig.2 PCR-restriction fragment length polymorphism for the amplified products of PvMSP-3αgeneA:Amplified product of PvMSP-3αgene digested by HhaI,M:DNA marker;B:Amplified product of PvMSP-3αgene digested by AluI,M:DNA marker

表1 西藏林芝地区间日疟原虫PvMSP-3α基因扩增片段内切酶等位基因频率分布表Tab.1 Frequency of PvMSP-3αalleles of samples in Linzhi Prefecture of Tibet
3 讨 论
了解间日疟原虫的遗传多样性和群体结构对于预测新变异的产生和其在群体内和群体之间传播以及对于评估疟疾消除措施是非常有价值的。
PvMSP-3α是红内期裂殖子侵入红细胞的一个表面蛋白,与抗体依赖细胞介导的免疫反应有关,被认为是间日疟原虫疫苗开发的重要候选抗原之一。PvMSP-3α作为间日疟原虫裂殖子的重要表面抗原,不仅在疫苗开发中被重点研究,对PvMSP-3α、PvMSP-3β和PvMSP-3γ片段的扩增也可检测混合感染。若单一样本的PCR产物存在多于一种条带,或单一样本的PCR产物酶切产物各片段大小总和超过未酶切的PCR产物片段,则可认为该样本为混合感染。同时,该方法也可对样本遗传多态性进行分析。相关研究发现,间日疟原虫虫株抗原相关基因存在高度多态性,提示其宿主免疫逃避功能不断进化。且多个研究证明,即使是在疟疾的低传播地区,如斯里兰卡、巴西等地,间日疟原虫也存在群体遗传多态性较高,且有相当比例的混合感染[9-10]。疟原虫种间及种内特定序列的比较及其遗传变异方式的研究既有利于疟原虫虫种起源的研究,也为寻找有效疫苗提供了有力工具。
目前研究间日疟原虫多态性通常采用测序进行序列比对,这可以给我们更为精确的结果,但在进行大规模的现场调查需要耗费大量的财力和物力,相比较而言PCR-RFLP方法较简便、快速,给我们进行现场研究带来方便。
本研究结果表明,西藏林芝地区间日疟原虫中发现PvMSP-3α基因A型所占比例为绝对优势,超过90%,未发现混合感染病例。与其他地区相比,西藏林芝地区间日疟原虫遗传多态性较低。可能与当地特殊的地理位置有关和气候环境有关。
[1]WHO Global Malaria Programme.World Malaria Report 2010[R].Geneva:WHO,2010:10-11.
[2]Hu YH,Hu SL,Li CC.Analysis of malaria epidemic in Linzhi District,Tibet Autonomous Region,1986-2004[J].Chin J Schisto Control,2006,18(2):124.(in Chinese)胡永红,胡松林,李成才.1986-2004年西藏林芝地区疟疾疫情分析[J].中国血吸虫病防治杂志,2006,18(2):124.
[3]Zakeri S,Barjesteh H,Djadid ND.Merozoite surface protein-3α is a reliable marker for population genetic analysis ofPlasmodium vivax[J].Malar J,2006,5:53.DOI:10.1186/1475-2875-5-53.
[4]Cui L,Mascorro CN,Fan Q,et al.Genetic diversity and multiple infections ofPlasmodium vivaxmalaria in Western Thailand[J].Am J Trop Med Hyg,2003,68(5):613-619.
[5]Xiao FZ,Zhang SY,Xu LS,et al.Allelic polymorphism in the merozoite surface protein-3αofPlasmodium vivax[J].Chin J Zoonoses,2006,22(9):813-816.(in Chinese)肖方震,张山鹰,许龙善.间日疟原虫裂殖子表面蛋白3a基因多态性研究[J].中国人兽共患病学报,2006,22(9):813-816.
[6]Huang TY,Mann VH,Cheng Q,et al.Characteristics of polymorphism of circumsporozoite protein gene ofPlasmodium vivaxof different geographical strains[J].Chin J Parasitol Parasit Dis,1996,14(1):20-25.(in Chinese)黄天谊,Mann VH,程勤,等.不同地理株间日疟原虫环子孢子蛋白基因多态性的特征[J].中国寄生虫学与寄生虫病杂志,1996,14(1):20-25.
[7]Bruce MC,Galinski MR,Barnwell JW,et al.Polymorphism at the merozoite surface protein-3alpha locus ofPlasmodium vivax:global and local diversity[J].Am J Trop Med Hyg,1999,61(4):518-525.
[8]Bruce MC,Galinski MR,Barnwell JW,et al.Genetic diversity and dynamics ofPlasmodium falciparumandP.vivaxpopulations in multiply infected children with asymptomatic malaria infections in Papua New Guinea[J].Parasitology,2000,121(Pt 3):257-272.
[9]Karunaweera ND,Ferreira MU,Hartl DL,et al.Fourteen polymorphic microsatellite DNA markers for the human malaria parasitePlasmodium vivax[J].Mol Ecol Notes,2007,7(1):172-175.DOI:10.1111/j.1471-8286.2006.01534.x
[10]Ferreira MU,Karunaweera ND,da Silva-Nunes M,et al.Population structure and transmission dynamics ofPlasmodium vivaxin rural Amazonia[J].J Infect Dis,2007,195(8):1218-1226.DOI:10.1371/journal.pntd.0001592
——“零疟疾从我开始”

