广州管圆线虫感染小鼠脾脏T淋巴细胞亚群和细胞因子的变化*
罗晓东,沈二霞,陈代雄,丁 雪,李 华
广州管圆线虫作为一种新发传染病的病原,主要侵犯中枢神经系统,引起嗜酸性粒细胞增多性脑膜脑炎或脑膜炎。近年来在我国浙江、辽宁、福建、云南和北京等地先后出现广州管圆线虫病的暴发流行[1-2],其重要性已越来越引起医学界的重视。而宿主感染后产生的针对广州管圆线虫的免疫应答的研究,对于我们了解宿主抗损害作用的特点、虫体的致病机制和免疫学诊断等有重要意义。脾脏是哺乳动物最大的外周免疫器官和血源性抗原最主要的免疫应答场所,也是包括淋巴细胞在内许多免疫细胞定居区域。而感染后脾脏淋巴细胞学的改变能较好地反映宿主对寄生虫免疫应答的特点。因此,本研究以小鼠为动物模型,采用流式细胞术和酶联免疫吸附试验(ELISA)等方法对其感染广州管圆线虫后脾脏T淋巴细胞亚群及其细胞因子分泌水平的变化进行了观察。
1 材 料
1.1 实验动物 雌性4~6周龄的BALB/c小鼠,SPF级,购自广东省医学实验动物中心。
1.2 主要试剂和仪器 RPMI1640培养基、Hank’s液购自英维捷基公司;胎牛血清购自杭州四季清公司;Saponin、离子霉素及Brefeldin A(BFA)均购自Sigma公司;PerCP抗小鼠CD4单克隆抗体、FITC抗小鼠CD8a单克隆抗体、APC抗小鼠IL-4、APC抗小鼠IFN-γ、PE抗小鼠IL-17均购自BD公司;PMA 购自杭州联科公司;IL-4(DY404)、IL-17(DY421)ELISA检测试剂盒购自R&D公司。流式检测采用BD公司Calibur流式细胞仪。ELx800型酶标仪由BioTek仪器公司生产。1267P型CO2培养箱由上海易亮医疗器械有限公司生产。
2 方 法
2.1 感染动物模型的建立 褐云玛瑙螺由本实验室饲养和人工感染。从感染褐云玛瑙螺中分离广州管圆线虫第3期幼虫,主要参照陈代雄等[3]报道的方法进行。将小鼠随机分成3组,包括:对照组、实验1组、实验2组每组各10只鼠。其中对照组为正常小鼠,实验1组和实验2组分别感染广州管圆线虫第3期幼虫20条/鼠和40条/鼠,感染采用腹腔注射法。
2.2 小鼠一般情况 感染后观察各组小鼠活动、饮食及毛色等变化。
2.3 脾脏淋巴细胞分离 分别于感染后的第19d和第25d前后,断颈处死小鼠,75%酒精消毒小鼠腹部,在无菌条件下取出脾脏;脾脏淋巴细胞的收集使用Anukumar B等[4]报告的方法,将收集的脾淋巴细胞用4mL RPMI1640培养液重悬,0.4%台盼蓝染色,镜下计数。
2.4 脾脏淋巴细胞流式检测 参照Anukumar B[4]、杨滨燕等[5]的方法,将收集的脾淋巴细胞悬液细胞数调整为2×106/mL,加入PMA 10ng/mL及离子霉素(Ionomycin)1μg/mL,于37℃的二氧化碳培养箱培养1h;加入BFA 1μL后继续培养4h,培养细胞经PBS洗涤后加4%甲醛固定,加含通透剂Saponin的缓冲液重悬细胞,4℃过夜。将细胞分装入流式管中,每管含细胞数约1×106/mL,加入相应的荧光抗体各1μL。流式细胞仪检测小鼠脾脏T淋巴细胞,按仪器使用规程进行操作。
2.5 细胞因子ELISA检测 将分离的脾淋巴细胞悬液细胞数调整为2×106/mL,加入PMA 10ng/mL及Ionomycin 1μg/mL后,分别加入细胞培养板中,每份细胞悬液同时做3孔培养,每孔200μL;于37℃、5%二氧化碳培养箱培养72h后取出并保存于-80℃。脾淋巴细胞培养上清中细胞因子IL-4和IL-17的双抗夹心ELISA检测,方法按照试剂盒说明书进行。每样本同时进行3孔平行检测,检测值取3孔平均值;ELISA检测OD值按照试剂盒标准品的标准曲线换算成浓度。
2.6 统计学方法 实验数据以均数±标准差表示。实验组和对照组的显著性检验采用SPSS 19.0统计软件分析处理,采用的统计学方法包括方差分析、t检验及秩和检验。
3 结 果
3.1 小鼠一般情况 对照组小鼠一般状况良好,摄食活动正常。实验组于感染第16d后,陆续出现打转、瘫痪等中枢神经受损的表现。
3.2 脾脏T淋巴细胞流式检测结果
3.2.1 CD4+T细胞 检测结果见图1。对照组、实验1组和实验2组检测值分别为(15.79±5.57)%、(21.32±7.31)%和(25.25±10.74)%,3组间脾CD4+T细胞均值存在统计学上的显著差异(F=3.446,P<0.05);其中,对照组与实验2组间存在显著性差异(t=2.474,P<0.05),而对照组与实验1组、两实验组之间均无显著性差异(t=1.906,P>0.05;t=1.013,P>0.05)。
3.2.2 CD8+T细胞 检测结果见图2。对照组、实验1组和实验2组检测值分别为(2.51±0.60)%、(3.25±1.31)%和(3.76±1.58)%。与对照组比较,感染后小鼠脾脏CD8+T细胞水平呈上升趋势,但3组间差异无统计学意义(F=2.582,P>0.05)。
3.2.3 CD4+IL-4+T细胞 如图3所示,对照组、实验1组和实验2组检测值分别为(0.64±0.25)%、(1.94±2.31)%、(2.49±2.38)%。经统计学分析,3组间存在显著性差异(χ2=7.770,P<0.05);其中,对照组与两实验组间均存在显著性差异(Z=2.342,P<0.05;Z=2.440,P<0.05);两实验组间无统计学差异(Z=0.832,P>0.05)。

图1 脾脏CD4+T细胞百分率Fig.1 Percentage of CD4+ T cells in spleen

图2 脾脏CD8+T细胞百分率Fig.2 Percentage of CD8+ T cells in spleen

图3 脾脏CD4+IL-4+T细胞百分率Fig.3 Percentage of CD4+IL-4+T cells in spleen
3.2.4 CD4+IL-17+T细胞 如图4所示,对照组、实验1组和实验2组的检测值分别为(1.18±0.26)%、(0.63±0.16)%和(0.65±0.29)%,3组间差异有统计学意义(F=12.620,P<0.05)。其中,对照组与实验1组、实验2组间均存在显著差异(t=5.416,P<0.05;t=3.783,P<0.05),而两实验组间差异不显著(t=0.223,P>0.05)。

图4 脾脏CD4+IL-17+T细胞百分率Fig.4 Percentage of CD4+IL-17+T cells in spleen
3.2.5 CD4+IFN-γ+T 细胞 如图5所示,对照组、实验1和实验2组检测值分别为(12.47±2.49)%、(5.80±2.39)%和(5.66±3.08)%。这3个组之间存在统计学上的显著差异(F=15.695,P<0.05),其中,对照组与实验1组、实验2组间均存在显著性差异(t=5.386,P<0.05;t=4.716,P<0.05),而两实验组间差异不显著(t=0.114,P>0.05)。

图5 脾脏CD4+IFN-γ+T细胞百分率Fig.5 Percentage of CD4+IFN-γ+T cells in spleen
3.3 脾脏淋巴细胞培养上清中细胞因子的检测
3.3.1 IL-4含量检测 结果见图6,对照组、实验1组和实验2组检测值分别为(215.20±158.13)pg/mL、(453.43±246.07)pg/mL、(469.42±221.37)pg/mL。经统计学分析,3组间有显著性差异(χ2=7.531,P<0.05);其中,对照组与实验1组或实验2组间均存在显著差异(Z=2.146,P<0.05;Z=2.148,P<0.05),而两实验组间无显著差异(t=0.153,P>0.05)。

图6 IL-4含量检测Fig.6 Levels of IL-4in spleen cell supernatants
3.3.2 IL-17含量检测 结果见图7。对照组、实验1组和实验2组检测值分别为(378.47±263.14)pg/mL、(97.85±95.41)pg/mL、(67.36±63.17)pg/mL。经统计学分析,3组间有显著性差异(χ2=12.746,P<0.05);其中,对照组与实验1组或实验2组间均存在显著差异(Z=3.027,P<0.05;Z=3.222,P<0.05);而两实验组间无显著差异(Z=0.529,P>0.05)。

图7 IL-17含量检测Fig.7 Levels of IL-17in spleen cell supernatants
3.4 感染后不同时间免疫学检测结果比较
3.4.1 流式检测结果 见表1。实验1组小鼠CD4+T细胞值感染后第25d稍高于第19d,而实验2组则是第19d高于第25d;但经统计学分析,均无显著性差异(P>0.05)。此外,脾CD4+T细胞中的IL-4+、IL-17+、IFN-γ+细胞,实验1组和实验2组均为感染后第25d高于第19d,但均无统计学意义的显著差异(P>0.05)。
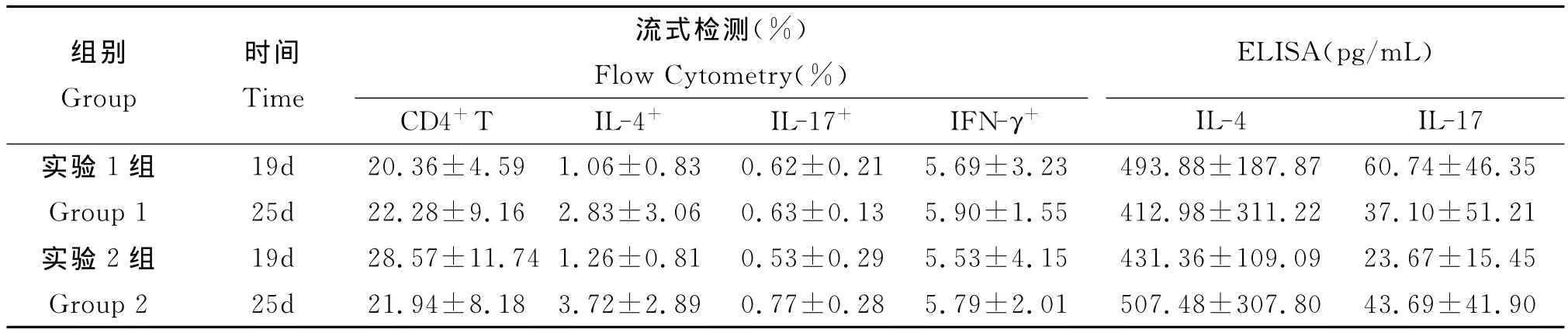
表1 感染后不同时间流式与ELISA检测结果Tab.1 Results of Flow Cytometry and ELISA for different time points after infection
3.4.2 ELISA检测结果 见表1。实验1组和实验2组小鼠感染后不同时间脾淋巴细胞培养上清中的细胞因子IL-4水平均无统计学意义的显著差异(t=0.498,P>0.05;Z=0.104,P>0.05)。而两实验组IL-17水平,在感染第19d和第25d间亦无统计学意义的显著差异(t=0.765,P>0.05;t=1.002,P>0.05)。
4 讨 论
已有的研究[6-7]显示,广州管圆线虫感染后宿主的免疫应答对于自身保护和虫体的致病作用非常重要。T淋巴细胞包括CD4+的辅助性T细胞和CD8+的细胞毒性T细胞等亚群。CD4+T细胞主要生物学功能是激发和调节宿主的免疫应答;CD8+T细胞主要作用是对靶细胞进行特异性杀伤。流式细胞检测结果显示,实验组CD4+T淋巴细胞检测值与对照组比较显著升高,而CD8+T淋巴细胞水平实验组虽高于对照组,但变化不显著,提示在广州管圆线虫感染后早中期的免疫应答中,CD4+T淋巴细胞可能起主要作用。这与Lee JD等[8]报告的结果基本一致。
辅助性T细胞(Th细胞)又可分为Th1细胞和Th2细胞,两者在免疫应答过程中分泌不同的细胞因子;这些细胞因子有不同的功能,且相互拮抗,因此,占主导地位的Th细胞类型及其产生的细胞因子将决定感染的发展与转归[9-12]。IL-4主要是由Th2细胞产生的一种细胞因子,其生物学作用为促进B细胞增殖和分泌抗体以及诱导抗体的类别转换;IL-4还以自分泌方式促进Th2细胞的增殖与功能。流式检测结果显示:实验组CD4+IL-4+T细胞含量明显高于对照组。同时脾淋巴细胞培养上清中的IL-4含量检测结果,实验组也明显高于对照组,两者结果一致。也与Sugaya H等[6]报告的结果基本相符。
IL-17是最近几年受到关注的一类细胞因子,关于其在广州管圆线虫感染中的变化暂未见文献报告。该因子主要由CD4+T细胞中的Th17细胞[13]产生,它通过诱导IL-6、TNF-α,以及趋化因子(如MCP-1、MIP-2)的表达参与炎症反应及血管的生成[14]。在流式检测结果中,CD4+IL-17+T 细胞实验组明显低于对照组,而在淋巴细胞培养上清中的IL-17的含量亦是实验组明显低于对照组。这可能与宿主感染广州管圆线虫后高表达的IL-4对于Th17细胞分化的抑制作用,从而抑制IL-17的分泌[13]有关。
IFN-γ主要由活化的Th1细胞和NK细胞产生。在寄生虫感染中,其主要对胞内寄生原虫感染发挥作用[15-17]。流式检测结果显示,小鼠脾脏CD4+IFN-γ+淋巴细胞亚群检测值实验组明显低于对照组。这可能是由于小鼠感染广州管圆线虫后,CD4+IL-4+T细胞及IL-4的显著升高对其产生的负调节作用。因为有研究[10]表明,IL-4能通过抑制STAT1的表达,从而抑制Th1细胞的分化和增殖。
实验结果显示,感染后上调性免疫因子包括CD4+T、CD8+T、IL-4+T淋巴细胞和细胞因子IL-4水平均随着感染程度的增加而上升,而下调性免疫因子包括IFN-γ+细胞和细胞因子IL-17检测值则随着感染程度的增加而下降,但差异均无统计学上的显著性;提示感染程度对T细胞亚群变化及其细胞因子的产生有一定的影响,但影响程度有限。
为了解感染后不同时间脾CD4+T淋巴细胞亚群和细胞因子产生的变化,我们对实验组感染后第19d和第25d两个时间点的检测结果进行了比较,发现在流式检测中,CD4+T淋巴细胞中的IL-4+、IL-17+、IFN-γ+亚群,感染后随时间延长两实验组均表现为水平升高。在另一方面,细胞因子IL-4和IL-17的ELISA检测结果,实验1组为第19d高于第25d,实验2组则为第19d低于第25d,是否是由于感染程度的差异导致的细胞因子产生的变化,值得进一步探讨。总之,本实验感染后第19d和第25d两个时间点小鼠的检测结果均无统计学上的显著差异(P>0.05);因此,感染后不同时间脾CD4+T淋巴细胞亚群和细胞因子的变化特点,还有待扩大样本做进一步的研究。
综上所述,小鼠感染广州管圆线虫后,表现以脾脏CD4+T淋巴细胞大量增殖和Th2型细胞极化为特点。一般认为,抗体依赖的、嗜酸性粒细胞作为主要效应细胞的ADCC作用是人体主要的杀伤蠕虫机制[18]。而嗜酸性粒细胞升高是广州管圆线虫感染的主要特征,结合本实验观察到的感染后Th2极化现象(Th2细胞的主要功能之一是促进抗体生成和介导体液免疫),我们推测上述ADCC效应也应该是小鼠抗广州管圆线虫感染的主要免疫应答机制。本研究结果使我们对于广州管圆线虫感染后宿主免疫应答的特性有了进一步的了解。
[1]Wang QP,Lai DH,Zhu XQ,et al.Human angiostrongyliasis[J].Lancet Infect Dis,2008,8(10):621-630.DOI:10.1016/S1473-3099(08)70229-9
[2]Qu ZY,Zhan XM,He A.The analysis on epidemic situation of angiostrongyliasis in China[J].Int J Med Parasit Dis,2007,34(5):279-282.(in Chinese)曲振宇,詹希美,何蔼.广州管圆线虫病在我国的流行分析[J].国际医学寄生虫病杂志,2007,34(5):279-282.
[3]Chen DX,Zhang Y,Shen HX,et al.Epidemiological survey ofAngiostrongylus cantonensisin the west-central region of Guangdong Province,China[J].Parasitol Res,2011,109(2):305-314.DOI:10.1007/s00436-011-2255-1
[4]Anukumar B,Shahir P.Immune regulation in Chandipura virus infection:characterization of CD4+T regulatory cells from infected mice[J].Virol J,2011,8:259.DOI:10.1186/1743-422X-8-259
[5]Yang BY,Shen EX,Wu CY.Phenotype of mouse CD4+CD25+regulatory T cells in mouse splenocytes[J].Curr Immunol,2006,26(3):208-212.(in Chinese)杨滨燕,沈二霞,吴长有.小鼠脾细胞CD4+CD25+调节性T细胞的表型特征[J].现代免疫学杂志,2006,26(3):208-212.
[6]Sugaya H,Aoki M,Abe T,et al.Cytokine responses in mice infected withAngiostrongylus cantonensis[J].Parasitol Res,1997,83(1):10-15.DOI:10.1007/s004360050199
[7]Perez O,Capron M,Lastre M,et al.Angiostrongylus cantonensis:role of eosinophils in the neurotoxic syndrome(Gordon-like phenomenon)[J].Exp Parasitol,1989,68(4):403-413.DOI:10.1016/0014-4894(89)90125-2
[8]Lee JD,Wang JJ,Chang JH,et al.Role of T cell subpopulations in mice infected withAngiostrongylus cantonensis[J].J Helminthol,1996,70(3):211-214.DOI:10.1017/S0022149X0001542X
[9]Mosmann TR,Cherwinski H,Bond MW,et al.Two types of murine helper T cell clone.I.Definition according to profiles of lymphokine activities and secreted proteins[J].J Immunol,1986,136(7):2348-2357.
[10]Abbas AK,Murphy KM,Sher A.Functional diversity of helper T lymphocytes[J].Nature,1996,383(6603):787-793.DOI:10.1038/383787a0
[11]Chen ZL.Parasite infection and cytokine[J].Foreign Med Sci Parasit Dis,1998,25(5):223-227.(in Chinese)陈志琳.寄生虫感染与细胞因子[J].国外医学寄生虫病分册,1998,25(5):223-227.
[12]Chen P,Wang WL.Th1/Th2cytokines and helminth infections[J].J Pathog Biol,2009,4(4):318-320.(in Chinese)陈鹏,王文林.Th1/Th2细胞因子与蠕虫感染[J].中国病原生物学杂志,2009,4(4):318-320.
[13]Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1and 2lineages[J].Nat Immunol,2005,6(11):1123-1132.DOI:10.1038/ni1254
[14]Kolls JK,Lindén A.Interleukin-17family members and inflammation[J].Immunity,2004,21(4):467-476.DOI:10.1016/j.immuni.2004.08.018
[15]Kushawaha PK,Gupta R,Sundar S,et al.Elongation factor-2,a Th1stimulatory protein ofLeishmania donovani,generates strong IFN-γand IL-12response in cured Leishmania-infected patients/hamsters and protects hamsters againstLeishmaniachallenge[J].J Immunol,2011,187(12):6417-6427.DOI:10.4049/jimmunol.1102081
[16]Langermans AM,Van der Hulst ME,Nibbering PH,et al.IFN-gamma-induced L-arginine-dependent toxoplasmastatic activity in murine peritoneal macrophages is mediated by endogenous tumor necrosis factor-alpha[J].J Immunol,1992,148(2):568-574.
[17]Su Z,Stevenson MM.Central role of endogenous gamma interferon in protective immunity against blood stagePlasmodium chabaudiAS infection[J].Infect Immun,2000,68(8):4399-4406.DOI:10.1128/IAI.68.8.4399-4406.2000
[18]Fabre V,Beiting DP,Bliss SK,et al.Eosinophil deficiency compromises parasite survival in chronic nematode infection[J].J Immunol,2009,182(3):1577-1583.

