基于TaqMan探针的猪繁殖与呼吸障碍综合症病毒实时荧光定量PCR方法的建立*
祝秀梅,马全英,杜 平,王 凡,吕志慧,牟克斌
猪繁殖与呼吸障碍综合征病毒 (Porcine reproductive and respiratory syndrome,PRRS)于1987年首先出现于美国[1],由猪繁殖与呼吸综合征病毒引起。其症状主要表现为怀孕母猪流产、早产、死胎、木乃伊胎及仔猪感染后的成活率下降。PRRS的一显著特性是具有高度传染性,1987年在北美首次爆发后,迅速在全球蔓延[2-3],给畜牧业的发展带来了严重的危害。十多年来,因它给世界养猪业造成巨大经济损失而引起了科学界的关注。2006年在我国暴发的高热病,给我国的养猪业带来巨大的破坏,由于诊断不及时,未做好应对工作,使许多中小型猪场因此倒闭,养殖户损失惨重[4-5]。因此建立快速有效实用的诊断方法是防制PRRS流行的重要环节。目前的诊断方法存在操作复杂费时、灵敏度或特异性不强等缺点。普通RT-PCR易出现假阳性,且核酸染色剂(溴化乙锭,EB)对人体健康有很大的危害。
实时荧光定量PCR(Real-time PCR)具有敏感性和特异性高、重复性和稳定
性好、耗时短、无污染的特点,已成为核酸定量检测的首选方法而得到广泛应用[6-8]。本研究选用PRRSV中的最保守的ORF7基因,设计引物和探针,建立了检测PRRSV的TaqMan实时荧光定量PCR,并对体系进行了优化。分别进行特异性、敏感性、稳定性试验,并对临床样品进行检测,建立了可准确、快速检测PRRSV的方法。
1 材 料
1.1 毒株 PRRSV SY0608细胞毒均由本实验室分离、鉴定并保存PCV-2、CSFV、HCV、PRV、PPV细胞毒均为本实验室保存;临床样品采自周边地区猪场。
1.2 试剂与仪器 病毒基因组RNA提取试剂盒购自 QIAGEN 公司,Premix ExTaqTM、T4DNA ligase、反转录试剂盒、Ex-Taq聚合酶、pMD-18T、DNA Marker等均购自TaKaRa(大连)公司;DNA胶回收试剂盒购自Promega公司;荧光定量PCR仪为StrataGen公司产品(Mx3000P)。
1.3 引物的设计与合成 根据GenBank上下载的PRRSV基因组全序列进行比对,找出PRRSV ORF7相对保守的区域,设计一对引物和探针,并送至宝生物工程(大连)有限公司合成。引物、探针序列如下。
2 方 法
2.1 标准阳性模板的制备
2.1.1 ORF7基因的扩增 按照QIAGEN RNA提取试剂盒说明书,从PRRSV感染的细胞培养物中提取病毒全基因组RNA,用宝生物反转录试剂盒中的Oligo(dT)进行反转录,合成cDNA。以cDNA为模板,用PRRSV上、下游引物扩增PRRSV ORF7基因,扩增条件为:94℃4min;94℃1min,58℃45s,72℃1min,共35个循环;72℃8min。反应结束后取8μL PCR产物经10g/L的琼脂糖凝胶电泳检测PCR结果。
2.1.2 ORF7基因的克隆与鉴定 将扩增出的ORF7基因按胶回收试剂盒说明回收后与pMD-18T载体连接,转化工程菌DH5α感受态细胞,通过抗性筛选挑取单菌落,接种到含有氨苄青霉素的LB液体培养基中,37℃振荡培养过夜至液体混浊,用小量质粒提取试剂盒提取质粒,并分别进行酶切鉴定。将鉴定正确的重组质粒送至上海生工生物工程有限公司测序。
2.1.3 标准阳性模板的稀释 用紫外分光光度计分别测定阳性重组质粒的OD260和OD280,并计算浓度与拷贝数。将重组质粒进行10倍梯度稀释后作为标准阳性模板,用于荧光定量PCR反应条件的优化和标准曲线的建立。
2.2 不同探针浓度对扩增产物量的影响 本试验采用TaKaRa公司的Premix Ex TaqTM(Perfect Real Time)system,是优化好的含有酶、dNTP、Mg2+等成分的2×预混液,按照试剂盒操作说明书进行操作。采用25μL反应体系,其中Premix Ex TaqTM12.5μL,PRRSV上、下游引物各0.5μL,RoxⅡ0.5μL,108拷贝/μL的重组质粒1μL;探针浓度依次为0.05μmol;0.1μmol;0.2μmol;0.3 μmol;0.4μmol;0.5μmol 0.5μL,补足水至25μL。混匀后进行PCR扩增,反应程序按宝生物Premix Ex TaqTM中推荐的程序进行:95℃30s,95℃5s、60℃20s循环40次。同时设立无模板的阴性对照。
2.3 荧光定量PCR反应标准曲线的建立 利用经优化后的PRRSV探针浓度,应用相同的反应程序,对10倍系列稀释的PRRSV阳性标准模板进行扩增,收集荧光数据,建立标准曲线。
2.4 荧光定量PCR的敏感性试验 取以10倍梯度稀释的标准阳性质粒作为模板并用无RNA酶水设阴性对照分析敏感性,以优化的反应体系和条件进行荧光定量PCR反应。
2.5 荧光定量PCR的特异性试验 以PRRSV 108、107、106、105、104拷贝/μL的阳性质粒以 及PCV-2、CSFV、HCV、PRV、PPV病毒核酸为模板,按照优化的条件进行荧光定量PCR检测,以检测本方法的特异性。
2.6 荧光定量PCR的重复性试验 以109、108、107拷贝/μL的重组质粒作为标准阳性模板,每个浓度重复3次,按照优化的扩增体系进行荧光定量PCR,计算变异系数(CV%),以评价本方法的准确性和稳定性。
2.7 临床样品的检测 采集来自周边猪场的30份组织样品,提取RNA,用建立的该方法及常规PCR法对上述组织样品进行检测,同时用细胞培养来进行病毒分离,分离的病毒用普通RT-PCR进行扩增。
3 结 果
3.1 ORF7基因的扩增、克隆及鉴定结果 扩增出的ORF7基因RT-PCR产物大小为105bp,与预期结果相符。扩增产物连接到pMD-18T载体上,得到的重组质粒命名为pMD-ORF7。经双酶切鉴定,分别切出2690bp和105bp大小的片段结果与预期结果一致(图1)。测序结果表明重组质粒中含有PRRSV ORF7基因的部分核苷酸序列。
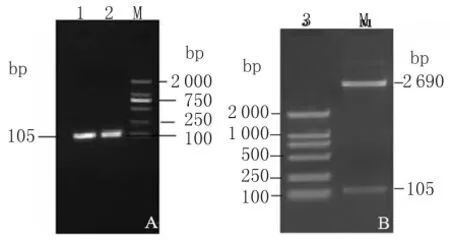
图1 PRRSV ORF7基因PCR及双酶切鉴定图1,2:PRRSV ORF7基因 PCR 产物;3:pMD-ORF7双酶切产物;M:DL2000MarkerFig.1 PRRSV ORF7gene PCR and double enzymatic digestion identification1,2:PRRSV ORF7gene PCR product;3:pMDORF7double enzymatic digestion product;M:DL2000Marker
3.2 重组质粒浓度的测定 提取的质粒DNA经核酸蛋白仪测定,其质粒浓度为0.404mg/mL,OD260nm/OD280nm比值为1.83,符合纯度要求。经计算该阳性重组质粒的拷贝数为3.51×l012个拷贝/μL。
3.3 探针浓度的优化 引物浓度以宝生物Premix Ex TaqTM中推荐的0.2μmol/L为最佳引物浓度,并以相同浓度的核酸为模板的反应体系中,先用不同浓度范围的探针,进行荧光定量PCR。以循环Ct值最小,荧光强度增加值(ΔRn)最大为选定原则。经优选后探针的最佳浓度分别为0.4μmol/L。
3.4 标准曲线的建立 按上述优化的反应条件,取109、108、107、106、105、104拷贝/μL的重组质粒作为标准阳性模板,分别进行扩增,系统自动分析软件显示Ct值与标准阳性模板浓度的对数之间存在良好的线性关系,相关系数(R2)为0.998,PCR扩增效率为97.9%(图2)。
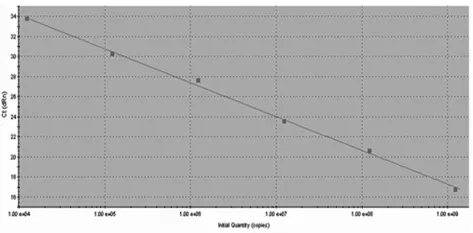
图2 浓度为109-104拷贝/μL的PRRSV质粒标准品的FQPCR扩增标准曲线Fig.2 Concentration 109-104 copies/μL PRRSV plasmids standard amplification plot of real-time FQ-PCR for PRRSV
3.5 荧光定量PCR的敏感性试验 对PRRSV阳性标准质粒进行10倍稀释后用荧光定量PCR方法进行检测,结果表明质粒浓度为3.51拷贝/μL时,仍能出现典型的扩增曲线,显示出良好的敏感性。
3.6 荧光定量PCR的特异性试验 PRRSV 3.51×108、3.51×107、3.51×106、3.51×105、3.51×104拷贝/μL 的阳性质粒以及 PCV-2、CSFV、HCV、PRV、PPV的病毒核酸为模板,用建立的TaqMan荧光定量PCR系统进行检测。结果表明除PRRSV模板检测有扩增曲线外,其余的均为阴性,无任何交叉反应,呈现出良好的特异性。
3.7 荧光定量PCR的重复性试验 以3.51×109、3.51×108、3.51×107拷贝/μL浓度的质粒标准品作3次重复检测,结果不同核酸浓度各自的检测Ct值变异系数分别为0.78%、0.71%、0.78%,表明检测方法具有较好的稳定性(表1)。

表1 FQ-PCR的重复性试验Tab.1 Repeatability test of real-time FQ-PCR for PRRSV
3.8 临床样品的检测 30份临床样品中用本研究中建立的FQ-PCR方法检测出28份样品为阳性,而用常规PCR方法检测仅有25份为阳性。对常规PCR检测为阳性的样品进行荧光定量PCR检测也为阳性。对常规PCR检测为阴性的5份样品进行荧光定量PCR检测,有3份样品为阳性。病毒分离的结果则与FQ-PCR法检测得到的结果完全一致,说明,建立的方法可以很好的用于临床样品的诊断。
4 讨 论
PRRSV ORF7编码核衣壳蛋白,即N蛋白,它是PRRSV最小的结构蛋白,相对的保守,也是免疫原性最强的蛋白,在病毒粒子中含量较高,约占病毒蛋白总量的20%~40%[9]。N蛋白包括对所有毒株保守的共同表位,又有对美、欧洲型分离株特异的表位。国外,有许多研究者制备了多株N蛋白的单克隆抗体对其抗原表位进行研究,结果表明欧洲分离株和美洲分离株的N蛋白具有高度保守的抗原表位[10-12]。由于猪感染PRRSV后,动物机体首先产生的是针对N蛋白的抗体,并且抗体在体内的存留时间较长,可以根据N蛋白抗体的水平的高低,对机体的发病情况和免疫水平做出合理的评价,因此,N蛋白可作为PRRSV抗体检测的诊断抗原[13]。本研究选用相对保守的N蛋白,建立了检测PRRSV的TaqMan实时荧光定量PCR方法。试验结果显示,所建立的检测方法能特异、灵敏地对PRRSV进行快速检测,为PRRSV的快速诊断方法的研究奠定了基础。
试验证实该方法特异性强,不与其他任何病原发生假阳性反应;灵敏度高,检测灵敏度可达3.51拷贝/μL。用该方法初步用于临床疑似病料的检测中,并与常规RT-PCR方法进行比较,结果显示:与常规RT-PCR相比较,本试验所建立的方法不但可以定性检测PRRSV,还可以定量检测PRRSV,而且能够检测出常规RT-PCR无法检测的病料,同时也免去了DNA水平电泳的步骤,更加省时,且操作简单。因此,该方法具有快速、灵敏、特异、定性、定量等优点。
国内将荧光定量PCR应用于PRRSV的检测已有报道。杨宗照等[14]建立了实时荧光定量PCR技术检测高致病性PRRSV,该方法能快速、简便地检测到HP-PRRSV的存在。杨春华等[15]等建立了检测PRRSV的SYBR Green I实时荧光定量PCR方法,该方法检测灵敏度可达10拷贝/μL,并具有良好的特异性和重复性。但这些建立的方法均采用了SYBR Green染料法,该方法虽然在操作中更加简便,但荧光染料能和任何dsDNA结合,因此它也能与非特异的dsDNA(如引物二聚体)结合,使实验容易产生假阳性信号,从而造成特异性低。而本研究中运用了TaqMan技术建立了检测PRRSV的实时荧光PCR,一方面提高了检测的灵敏度和准确性,另一方面又提高了检测的特异性。
[1]Bilodeau R,Dea S,Sauvageau RA,et al.‘Porcine reproductive and respiratory syndrome’in Quebec[J].Vet Rec,1991,129:102-103.DOI:10.1136/vr.129.5.102
[2]Keffaber KK.Reproductive failure of unknown etiology[J].Am Assoc Swine Pract Newsl,1989,1:1-9.
[3]Wensvoort G,Terpstra C,Pol JMA,el al.Mystery swine disease in the Netherlands:the isolation of Lelystad virus[J].Vet Q,1991, 13 (3):121-130. DOI: 10.1080/01652176.1991.9694296
[4]Hao XF,Zhou YJ,Tian ZJ,et al.Development of a RT-PCR method for differentiation of the highly pathogenic PRRSVs and the classical PRRSVs[J].Chin J Prevent Vet Med,2007,29(9):704-709.(in Chinese)郝晓芳,周艳群,田志军,等.高致病性猪繁殖与呼吸综合征病毒RT-PCR鉴别诊断方法的建立[J].中国预防兽医学报,2007,29(9):704-709.
[5]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS ONE,2007,2(6):e526.DOI:10.1371/journal.pone.0000526
[6]Bustin SA.Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays[J].J Mol Endocrinol,2000,25(2):169-193.DOI:10.1677/jme.0.0250169
[7]Niesters HG.Quantitation of viral load using real-time amplification techniques[J].Methods,2001,25(4):419-429.DOI:10.1006/meth.2001.1264
[8]Walker NJ.Real-time and quantitative PCR:applications to mechanism based toxicology[J].J Biochem Mol Toxicol,2001,15(3):121-127.DOI:10.1002/jbt.8
[9]Meuenberg JJM,Petersen-den Besten A,De-Kluyver EP,et al.Characterization of protein encoded by ORF2to 7of Lelystad virus[J].Virology,1995,206(1):155-163.DOI:10.1016/S0042-6822(95)80030-1
[10]Bogdanova VS,Tsibezov VV,GrabovetskiǎǐVV,et al.Enzyme-linked immunosorbent assay for detection of antibodies to porcine reproductive and respiratory syndrome virus,by using recombinant nucleocapsid protein N[J].Vopr Virusol,2007,52(2):45-49.
[11]Zhou YJ,An TQ,Liu JX,et al.Identification of a conserved epitope cluster in the N protein of porcine reproductive and respiratory syndrome virus[J].Viral Immunol,2006,19(3):383-390.DOI:10.1089/vim.2006.19.383
[12]Rompato G,Ling E,Chen Z,et al.Positive inductive effect of IL-2on virus-specific cellular responses elicited by a PRRSVORF7DNA vaccine in swine[J].Vet Immunol Immunopathol,2006,109(1-2):151-160.DOI:10.1016/j.vetimm.2005.08.015
[13]Qiu DX,Chen HC,Wan SG.Cloning and expression inE.coliof nucleocapsid protein gene of porcine reproductive and respiratory syndrome virus[J].Virol Sinica,2003,18(2):146-151.(in Chinese)邱德新,陈焕春,万绍贵.猪繁殖与呼吸综合征病毒核衣壳蛋白基因的克隆与原核表达研究[J].中国病毒学,2003,18(2):146-151.
[14]Yang ZZ,Mu AX,Fang WH.A real-time RT-PCR for detection of high pathogenic PRRSV[J].Chin J Prevent Vet Med,2009,31(4):288-291.(in Chinese)杨宗照,母安雄,方维焕.高致病性猪繁殖与呼吸综合征病毒实时荧光定量PCR方法的建立[J].中国预防兽医学报,2009,31(4):288-291.
[15]Yang CH,Hu H,ZhongY,et al.Establishment and preliminary application of a SYBR Green I real-time PCR method for detection of PRRSV[J].Acta Agriculturae Zhejiangensis,2010,22(6):745-749.(in Chinese)杨春华,胡慧,钟毅,等.检测猪繁殖与呼吸综合征病毒SYBR Green I实时荧光定量PCR方法的建立及初步应用[J].浙江农业学报,2010,22(6):745-749.

