急性冠状动脉综合征患者平均血小板体积的变化及相关因素研究
许文亮 徐莉 王旭 邵一兵
急性冠状动脉综合征(acute coronary syndrome,ACS)的发病过程中,血小板发挥着枢纽性作用,血小板活性影响着疾病的转归。血小板体积是血小板功能的决定性因素,体积大的血小板,含有更多的致密颗粒,活性更高,有更强的致血栓形成作用。因此,平均血小板体积(mean platelet volume,MPV)的升高不仅对急性心肌梗死(acute myocardial infarction,AMI)的发病有预测作用,而且是动脉血栓性疾病预后不良的标志,是冠心病的独立危险因素。MPV与冠心病的关系国外报道较多,但国内系统的研究很少,因此有必要对MPV这一简单、廉价、便利但又有很高性价比的常规检查项目在ACS患者中的作用,做进一步的研究。本研究通过对195例ACS患者MPV等血小板功能参数的观察,探讨MPV检测的作用及与MPV升高相关的因素,为识别高危患者和指导治疗提供依据。
1 对象和方法
1.1 研究对象和分组
连续性选择2010年9~12月接受冠状动脉造影的住院患者316例,其中男193例,女123例,年龄36~87岁,平均(64.3±10.4)岁。所有患者进入研究前均未应用过阿司匹林、氯吡格雷等抗血小板药物、非甾体类抗炎药物及抗凝药物。除外血液系统疾病、感染性疾病和恶性肿瘤等合并症。
冠心病诊断标准:冠状动脉造影显示冠状动脉直径狭窄≥50%。ACS和AMI的诊断标准参照美国心脏病学会和美国心脏协会的相关指南[1-2]。
根据冠状动脉造影结果和临床资料,分为ACS组195例,稳定型心绞痛(SA)组48例,非冠心病对照组73例。ACS组又可分为非ST段抬高型ACS(NSTEACS)亚组114例和ST段抬高型AMI(STEMI)亚组81例。
1.2 检测方法
入院后未开始抗血小板等药物治疗之前或次日清晨空腹采血,检测血小板功能参数,其他实验室检测项目的血标本均于入院次日清晨空腹采集,所有检测均由专人完成。检测方法:(1)MPV、血小板分布宽度(PDW)、血小板压积(PCT)、血小板计数(PLT)和白细胞总数(WBC):抗凝血2 ml,使用日本SYSMEX五分类血球计数仪XS-800I,用激光散射计数技术测定;(2)高敏C反应蛋白(hsCRP):非抗凝血2 ml,使用QUICKREAD分析仪,用免疫比浊法测定,试剂“QuickRead CRP”由芬兰ORION诊断公司提供;(3)TG、TC、LDL-C、HDL-C、空腹血糖、肌酐、尿酸等血生化指标:非抗凝血2 ml,使用日立H7600全自动生化分析仪测定,试剂由北京利德曼生化技术有限公司提供。
1.3 统计学方法
应用SPSS 10.0统计软件对数据进行统计分析。正态分布计量资料用均数±标准差(±s)表示,两组间比较用独立样本t检验,多组间比较用One-way ANOVA,采用SNK-q检验进行两两比较。计数资料用百分构成比表示,采用χ2检验。采用多元线性回归分析影响MPV的因素。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
各组间性别构成比、年龄等差异无统计学意义。ACS组糖尿病比例、WBC计数、空腹血糖和hsCRP水平均显著高于对照组,血清HDL-C水平显著低于对照组;ACS组空腹血糖和hsCRP水平显著高于SA组。NSTEACS亚组糖尿病比例、空腹血糖和hsCRP水平显著高于SA组和对照组,尿酸水平显著高于STEMI亚组;STEMI亚组糖尿病比例、WBC计数、空腹血糖和hsCRP水平显著高于SA组和对照组,WBC计数和hsCRP水平显著高于NSTEACS亚组,血清HDL-C水平显著低于对照组,差异均有统计学意义,见表1。
2.2 血小板功能参数比较
ACS组MPV显著高于对照组和SA组,PCT显著低于对照组和SA组,差异有统计学意义,见表2。
2.3 MPV相关因素分析
根据是否合并糖尿病、高血压和冠状动脉病变血管支数情况,将ACS患者分为相应的亚组,比较各亚组间MPV的差异。仅观察到合并糖尿病亚组MPV显著高于未合并糖尿病亚组(P<0.05),见表3。
2.4 MPV影响因素的回归分析
以MPV为应变量,WBC、空腹血糖、尿酸、肌酐、TG、TC、HDL-C、LDL-C 和 hsCRP 为因变量,多元逐步回归分析MPV的影响因素。hsCRP和HDL-C是MPV显著的独立影响因素,见表4。
表1 一般临床和实验室资料(±s)
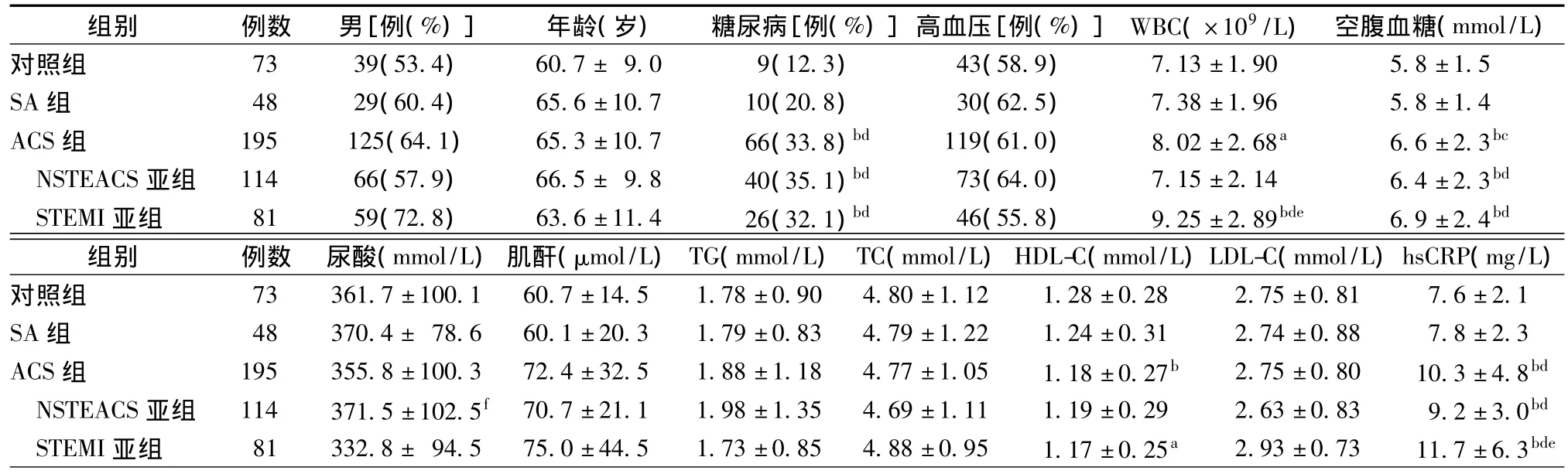
表1 一般临床和实验室资料(±s)
注:与对照组比较,aP<0.05,bP<0.01;与SA组比较,cP<0.05,dP<0.01;与NSTEACS亚组比较,eP<0.01;与STEAMI亚组比较,fP<0.01
组别 例数 男[例(%)]年龄(岁) 糖尿病[例(%)]高血压[例(%)]WBC(×109/L) 空腹血糖(mmol/L)对照组 73 39(53.4) 60.7± 9.0 9(12.3) 43(58.9)7.13±1.90 5.8±1.5 SA组 48 29(60.4) 65.6±10.7 10(20.8) 30(62.5) 7.38±1.96 5.8±1.4 ACS组 195 125(64.1) 65.3±10.7 66(33.8)bd 119(61.0) 8.02±2.68a 6.6±2.3bc NSTEACS亚组 114 66(57.9) 66.5± 9.8 40(35.1)bd 73(64.0) 7.15±2.14 6.4±2.3bd STEMI亚组 81 59(72.8) 63.6±11.4 26(32.1)bd 46(55.8) 9.25±2.89bde 6.9±2.4bd组别 例数 尿酸(mmol/L)肌酐(μmol/L)TG(mmol/L)TC(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)hsCRP(mg/L)对照组 73 361.7±100.1 60.7±14.5 1.78±0.90 4.80±1.12 1.28±0.28 2.75±0.81 7.6±2.1 SA组 48 370.4± 78.6 60.1±20.3 1.79±0.83 4.79±1.22 1.24±0.31 2.74±0.88 7.8±2.3 ACS组 195 355.8±100.3 72.4±32.5 1.88±1.18 4.77±1.05 1.18±0.27b 2.75±0.80 10.3±4.8bd NSTEACS亚组 114 371.5±102.5f 70.7±21.1 1.98±1.35 4.69±1.11 1.19±0.29 2.63±0.83 9.2±3.0bd STEMI亚组 81 332.8± 94.5 75.0±44.5 1.73±0.85 4.88±0.95 1.17±0.25a 2.93±0.73 11.7±6.3bde
表2 ACS组、SA组和对照组间血小板功能参数比较(±s)

表2 ACS组、SA组和对照组间血小板功能参数比较(±s)
注:与对照组比较,aP <0.05,bP <0.01;与 SA 组比较,cP <0.05,dP<0.01
组别 例数 MPV(fl) PDW(fl) PCT(%) PLT(×109/L)对照组 73 9.59±1.40 12.96±2.55 45.2±49.9 201.9±46.6 SA组 48 9.61±1.42 13.43±2.44 49.6±55.4 208.3±54.7 ACS组 195 10.19±1.26bd 12.87±2.35 33.1±35.4ac 203.3±56.4 NSTEACS亚组 114 10.12±1.35bd 13.04±2.46 35.4±38.9 197.1±49.7 STEMI亚组 81 10.29±1.33bd 12.61±2.18 29.9±29.8ac 214.9±63.3
表3 ACS患者各亚组间血小板功能参数的比较(±s)
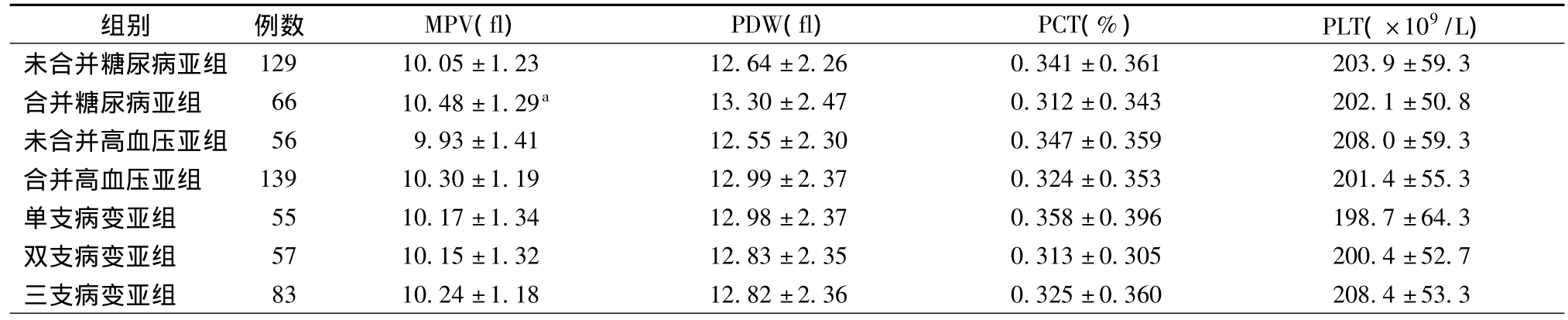
表3 ACS患者各亚组间血小板功能参数的比较(±s)
注:与未合并糖尿病亚组比较,aP<0.05
组别 例数 MPV(fl) PDW(fl) PCT(%) PLT(×109/L)未合并糖尿病亚组 129 10.05±1.23 12.64±2.26 0.341±0.361 203.9±59.3合并糖尿病亚组 66 10.48±1.29a 13.30±2.47 0.312±0.343 202.1±50.8未合并高血压亚组 56 9.93±1.41 12.55±2.30 0.347±0.359 208.0±59.3合并高血压亚组 139 10.30±1.19 12.99±2.37 0.324±0.353 201.4±55.3单支病变亚组 55 10.17±1.34 12.98±2.37 0.358±0.396 198.7±64.3双支病变亚组 57 10.15±1.32 12.83±2.35 0.313±0.305 200.4±52.7三支病变亚组 83 10.24±1.18 12.82±2.36 0.325±0.360 208.4±53.3
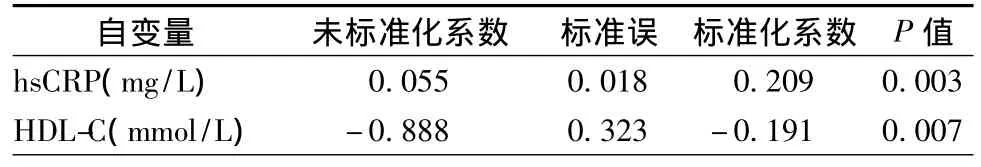
表4 MPV影响因素的多元回归分析
3 讨论
血小板体积的大小是血小板功能的决定因素,MPV是反映血小板活性的常用参数,MPV的升高与出血时间缩短、血栓素A2分泌增加、血小板膜糖蛋白Ⅰb和Ⅱb/Ⅲa受体的表达增加呈显著的正相关关系[3-4]。高MPV是动脉粥样硬化和心肌梗死发生的独立危险因素[5],其危险度与肥胖或吸烟相当[6]。MPV升高预示着AMI等患者冠状动脉血流减慢[7]、冠状动脉介入术后再狭窄[8]和死亡率等并发症的增加,是冠状动脉介入术后远期不良临床结果的强力的独立预测因素,其价值与肌钙蛋白相似[9]。测定MPV有助于判定高危患者和指导治疗。
冠心病患者,病情越严重MPV越高,AMI患者和不稳定型心绞痛患者MPV显著高于SA患者[10]。AMI与不稳定型心绞痛患者MPV的比较,报道结果不一,更高[11]或差异无统计学意义,本研究未观察到SETMI患者与NSTEACS患者MPV的差异。结果的不一致可能与不同研究的分组标准不同有关。
ACS患者的MPV升高的机制尚不清楚。MPV的高低取决于骨髓中血小板的祖细胞——巨核细胞,但ACS患者合并的其他疾病或危险因素对MPV均有影响。本研究显示,合并糖尿病的ACS患者MPV更高,与国外的一些研究结果相似[12]。糖尿病作为冠心病的等危症,是一种血栓前状态,伴有血小板活性的增加[13]。MPV升高可能是糖尿病使ACS患者病情加重的机制之一。
多元回归分析MPV的影响因素时,本研究显示血清HDL-C是MPV的血脂预测因子,即HDL-C越低,MPV越高,血小板活性越强,进一步支持了HDL-C对血小板活性有调节作用的观点[14]。通过增加血小板内一氧化氮合酶的活性和抑制血管内皮细胞中血小板激活因子的合成,HDL-C降低和抑制了血小板活性[15]。HDL-C降低是血小板性血栓形成的独立预测因子。
本研究中还显示血清hsCRP对MPV有独立影响作用,提示在ACS中CRP与血小板功能有密切联系。CRP有可逆性促进血小板聚集和与内皮细胞黏附的作用[16],在动脉血栓事件中的作用部分归因于血小板的激活[17]。升高的CRP是循环血中血小板白细胞聚集体升高的独立预测因素[18]。CRP在炎症反应与血栓形成之间的这种作用,可能是高血清hsCRP伴高发血管事件的机制[19]。同时,活化的血小板介导了具有低致动脉粥样硬化作用的五聚体CRP向具有高致动脉粥样硬化作用的单聚体CRP转化的分解过程[20]。
PCT是血小板在全血中所占的容积百分比,与MPV和PLT密切联系,其结果受其他血小板参数的影响,本组资料中显示PCT的显著降低间接反映了血小板在ACS中存在过度消耗。PDW反映血液中血小板容积大小的离散程度,其增高表示血小板大小悬殊,也提示血小板有明显消耗,虽有报道表明AMI和不稳定型心绞痛患者其PDW显著升高[21],但本研究未观察到ACS患者PDW和PLT的显著变化。
[1]Braunwald E,Antman EM,Beasley JW,et al.ACC/AHA Guidelines for the Management of Patients With Unstable Angina and Non-ST-Segment Elevation Myocardial Infarction:Executive Summary and Recommendations.Circulation,2000,102:1193-1209.
[2]Ryan TJ,Antman EM,Brooks NH,et al.ACC/AHA Practice Guidelines:1999 Update:ACC/AHA Guidelinesforthe Management of Patients WithAcuteMyocardialInfarction:Executive Summary and Recommendations.Circulation,1999,100:1016-1030.
[3]Vizioli L,Muscari S,Muscari A.The relationship of mean platelet volume with the risk and prognosis of cardiovascular diseases.Int J Clin Pract,2009,63:1509-1515.
[4]Huczek Z,Kochman J,Filipiak KJ,et al.Mean platelet volume on admission predicts impaired reperfusion and long-term mortality in acute myocardial infarction treated with primary percutaneous coronary intervention.J Am Coll Cardiol,2005,46:284-290.
[5]Endler G,Klimesch A,Sunder-Plassmann H,et al. Mean platelet volume is an independent risk factor for myocardial infarction but not for coronary artery disease.Br J Haematol,2002,117:399-404.
[6]Slavka G,Perkmann T,Haslacher H,et al.Mean platelet volume may represent a predictive parameter for overall vascular mortality and ischemic heart disease.Arterioscler Thromb Vasc Biol,2011,31:1215-1218.
[7]Sen N,Basar N,Maden O,et al.Increased mean platelet volume in patients with slow coronary flow.Platelets,2009,20:23-28.
[8]Yang A,Pizzulli L,Lüderitz B.Mean platelet volume as marker of restenosis after percutaneous transluminal coronary angioplasty in patients with stable and unstable angina pectoris.Thromb Res,2006,117:371-377.
[9]Goncalves SC,Labinaz M,Le May M,et al.Usefulness of mean platelet volume as a biomarker for long-term outcomes after percutaneous coronary intervention.Am J Cardiol,2011,107:204-209.
[10]Khandekar MM,Khurana AS,Deshmukh SD,et al.Platelet volume indices in patients with coronary artery disease and acute myocardial infarction:an Indian scenario.J Clin Pathol,2006,59:146-149.
[11]Yilmaz MB,Cihan G,Guray Y,et al.Role of mean platelet volume in triagging acute coronary syndromes.JThromb Thrombolysis,2008,26:49-54.
[12]Tavil Y,Sen N,Yazici H,et al.Coronary heart disease is associated with mean platelet volume in type 2 diabetic patients.Platelets,2010,21:368-372.
[13]De Luca G,Santagostino M,Secco GG,et al.Mean platelet volume and the extent of coronary artery disease:results from a large prospective study.Atherosclerosis,2009,206:292-297.
[14]Barlage S,Boettcher D, Boettcher A, et al. High density lipoprotein modulates platelet function.Cytometry A,2006,69:196-199.
[15]Calkin AC,Drew BG,Ono A,et al.Reconstituted high-density lipoprotein attenuates platelet function in individuals with type 2 diabetes mellitus by promoting cholesterol efflux.Circulation,2009,120:2095-2104.
[16]Preston RA,JyW, JimenezJJ, etal. Effectsofsevere hypertension on endothelial and platelet microparticles.Hypertension,2003,41:211-217.
[17]Shantikumar S,Grant PJ,Catto AJ,et al.Elevated C-reactive protein and long-term mortality after ischaemic stroke:relationship with markers ofendothelialcelland platelet activation.Stroke,2009,40:977-979.
[18]Dotsenko O,Chaturvedi N,Thom SA, et al.Platelet and leukocyte activation,atherosclerosis and inflammation in European and South Asian men.J Thromb Haemost,2007,5:2036-2042.
[19]Yaron G,Brill A,Dashevsky O, et al.C-reactive protein promotes platelet adhesion to endothelial cells:a potential pathway in atherothrombosis.Br J Haematol,2006,134:426-431.
[20]Eisenhardt SU,Habersberger J,Murphy A,et al.Dissociation of pentameric to monomeric C-reactive protein on activated platelets localizes inflammation to atherosclerotic plaques. Circ Res,2009,105:128-137.
[21]Khandekar MM,Khurana AS,Deshmukh SD,et al.Platelet volume indices in patients with coronary artery disease and acute myocardial infarction:an Indian scenario.J Clin Pathol,2006,59:146-149.

