心肌声学造影评价胰岛素不同干预时间点对糖尿病大鼠心肌灌注的影响
张 展
张 军2ZHANG Jun
刘 芳1LIU Fang
拓胜军2TA Shengjun
岳瑾琢1YUE Jinzhuo
贺建国2HE Jianguo
心肌声学造影评价胰岛素不同干预时间点对糖尿病大鼠心肌灌注的影响
张 展1ZHANG Zhan
张 军2ZHANG Jun
刘 芳1LIU Fang
拓胜军2TA Shengjun
岳瑾琢1YUE Jinzhuo
贺建国2HE Jianguo
中国医学影像学杂志
2017年 第25卷 第6期:405-408,413
Chinese Journal of Medical Imaging 2017 Volume 25 (6): 405-408, 413
目的应用心肌声学造影(MCE)技术评价胰岛素不同时间点干预糖尿病大鼠心肌微循环灌注的差异,探讨MCE在糖尿病心肌病(DCM)疗效评价中的价值。材料与方法将90只SD大鼠按随机数字表法分为对照组(NC)、糖尿病组(DM)和胰岛素干预组(INS),每组30只。成功制备糖尿病模型后,INS组随机分A、B、C 3个亚组,分别于成模0、4、8周后开始胰岛素干预,均连续给药12周;NC和DM组也随机分为3个亚组,与INS组各亚组同步饲养,不予干预。于成模后12、16、20周末对各亚组大鼠开胸行MCE检查,分析心肌血容量(A)、血流速度(β)和血流量(A×β)的变化,并取心肌组织行病理学检查。结果与DM组比较,INS组A、β和A×β均增加,差异有统计学意义(P<0.05);与NC组比较,INS组A亚组A×β减低,B亚组A、A×β减低,C亚组A、β、A×β均减低,差异有统计学意义(P<0.05);INS组各亚组间比较,A、B亚组间各指标差异无统计学意义(P>0.05);C亚组A、A×β低于A亚组,差异有统计学意义(P<0.05)。病理结果显示,INS组毛细血管基底膜厚度较DM组改善;毛细血管密度INS各亚组均较DM组增加,仅A亚组差异有统计学意义(P<0.05)。结论胰岛素早期干预可改善心肌微血管结构,增加心肌血流量。MCE可敏感、准确地对DCM大鼠的心肌微循环进行评价,可作为DCM早期诊断和动态疗效监测的重要方法,具有重要的临床指导意义。
糖尿病并发症;心肌疾病;胰岛素;超声心动描记术;造影剂;心肌再灌注;微循环;疾病模型,动物;大鼠,Sprague-Dawley
糖尿病(diabetes mellitus,DM)患者存在病程及病情不一,治疗时间、方法及依从性不一等客观条件限制,且难以在各个治疗阶段获取心肌组织进行组织和细胞水平检测验证,无法对糖尿病心肌病(diabetic cardiomyopathy,DCM)疗效进行客观评价。本实验选取成熟的DM大鼠模型,使用心肌保护作用确定的胰岛素在不同时间点进行疗程相同的干预[1-4];并应用心肌声学造影(myocardial contrast echocardio-graphy,MCE)技术对心肌微循环灌注改变作出定量评价,以电镜和免疫组化结果作为印证,为DCM的疗效评估提供实验依据。
1 材料与方法
1.1 实验动物与分组 SD雄性大鼠90只,体重220~300 g,平均(260.1±24.3)g,由第四军医大学动物中心提供[SCXK(军)2012-0007]。按随机数字表法分为对照组(NC)、糖尿病组(DM)和胰岛素干预组(INS),每组30只。单次腹腔注射链脲佐菌素(STZ)溶液65 mg/kg制作DM模型,第5、7天采尾静脉血,血糖浓度>16.7 mmol/L,且具有明显“三多一少”症状为模型制备成功,NC组注射等量缓冲液。模型建成后,INS组再随机分A、B、C 3个亚组,分别在成模0、4、8周后开始皮下注射精蛋白生物合成人胰岛素(诺和灵®N)6 U/kg,1次/d,均连续给药12周。NC、DM组也随机分为A、B、C 3个亚组,并与INS各亚组同步饲养,不给予干预。A、B、C亚组大鼠分别在成模12、16、20周末检测各项指标。
1.2 仪器与方法 使用Acuson Sequoia 512超声诊断仪,15L8-S线阵探头,频率8~14 MHz。 麻醉大鼠,颈静脉插管、接呼吸机和心电图。开胸取左心室乳头肌短轴切面,MCE二维-造影双幅模式,经优化后增益设置在实验中保持不变。以0.9 ml/(kg·min)连续输注SonoVue造影剂(Bracco公司),当充盈稳定后触发瞬时高能脉冲破坏心肌内微泡,获得再灌注实时成像,存储250帧[3]。应用Syngo®US Workplace软件脱机分析,勾画心肌内感兴趣区,得到声学强度-时间曲线y=A×(1-e-βt)。A代表心肌血容量;β代表血流速度;A×β值代表心肌血流量(图1)。分析3次取平均值,拟合度<0.9弃用。

图1 大鼠MCE图像分析。A. MCE二维-造影双幅模式;B. Syngo US Workplace分析界面;C. 声学强度-时间曲线
1.3 病理检查 实验结束处死动物后,左心室心肌固定部位取材,10%甲醛固定,石蜡包埋切片行CD31免疫组化染色。随机选取10个(×400)高倍镜视野计数,取平均值作为毛细血管密度;另取4块1 mm×1 mm×4 mm组织,多聚甲醛-戊二醛固定,透射电镜观察毛细血管超微结构。
1.4 统计学方法 采用SPSS 17.0软件,计量资料以±s表示,检验正态分布和方差齐性后,各组间参数比较用单因素方差分析,两两比较采用LSD法。P<0.05表示差异有统计学意义。
2 结果
2.1 大鼠一般情况 实验中2只造模失败剔除(空腹血糖未升高),DM组B亚组死亡2只、C亚组死亡3只。余均无死亡。
2.2 一般指标比较 与NC组比较,INS组、DM组各亚组血糖增高,体重减低,差异有统计学意义(P<0.05);与DM组比较,INS组各亚组血糖减低,体重增高,差异有统计学意义(P<0.05);INS组各亚组间比较,血糖、体重差异均无统计学意义(P>0.05)。见表1。
2.3 大鼠MCE指标比较 与NC组比较,DM各亚组A、β和A×β均减低,差异有统计学意义(P<0.05);INS组A亚组A×β减低,B亚组A、A×β减低,C亚组各指标均减低,差异有统计学意义(P<0.05)。与DM组比较,INS组各亚组A、β和A×β均增加,差异有统计学意义(P<0.05)。INS各亚组间比较,A、B亚组间各指标差异无统计学意义(P>0.05);C亚组A、A×β低于A亚组,差异有统计学意义(P<0.05)。见表2。2.4 大鼠毛细血管密度比较 与NC组比较,DM组、INS组毛细血管密度均减低,差异有统计学意义(P<0.05)。与DM组比较,INS组A亚组增加,差异有统计学意义(P<0.05);B、C亚组亦有增加,差异无统计学意义(P>0.05)。INS各亚组间比较,B、C亚组均低于A亚组,差异有统计学意义(P<0.05)。见表3。
表1 各组大鼠一般指标比较(±s)

表1 各组大鼠一般指标比较(±s)
分组 血糖(mmol/L) 体重(g)NC组A亚组(n=10) 6.48±0.79 580.62±46.54 B亚组(n=10) 6.01±0.58 606.15±40.62 C亚组(n=10) 5.66±0.46 628.96±41.25 DM组A亚组(n=9) 31.03±4.24* 382.13±34.22*B亚组(n=7) 32.35±1.49* 332.56±38.44*C亚组(n=7) 31.75±2.15* 301.25±33.64*INS组A亚组(n=10) 17.11±5.62*# 495.65±37.75*#B亚组(n=10) 19.18±2.68*# 521.28±48.53*#C亚组(n=10) 20.45±4.46*# 533.52±45.54*#注:与NC组比较,*P<0.05;与DM组比较,#P<0.05
表2 各组大鼠MCE指标比较(±s)
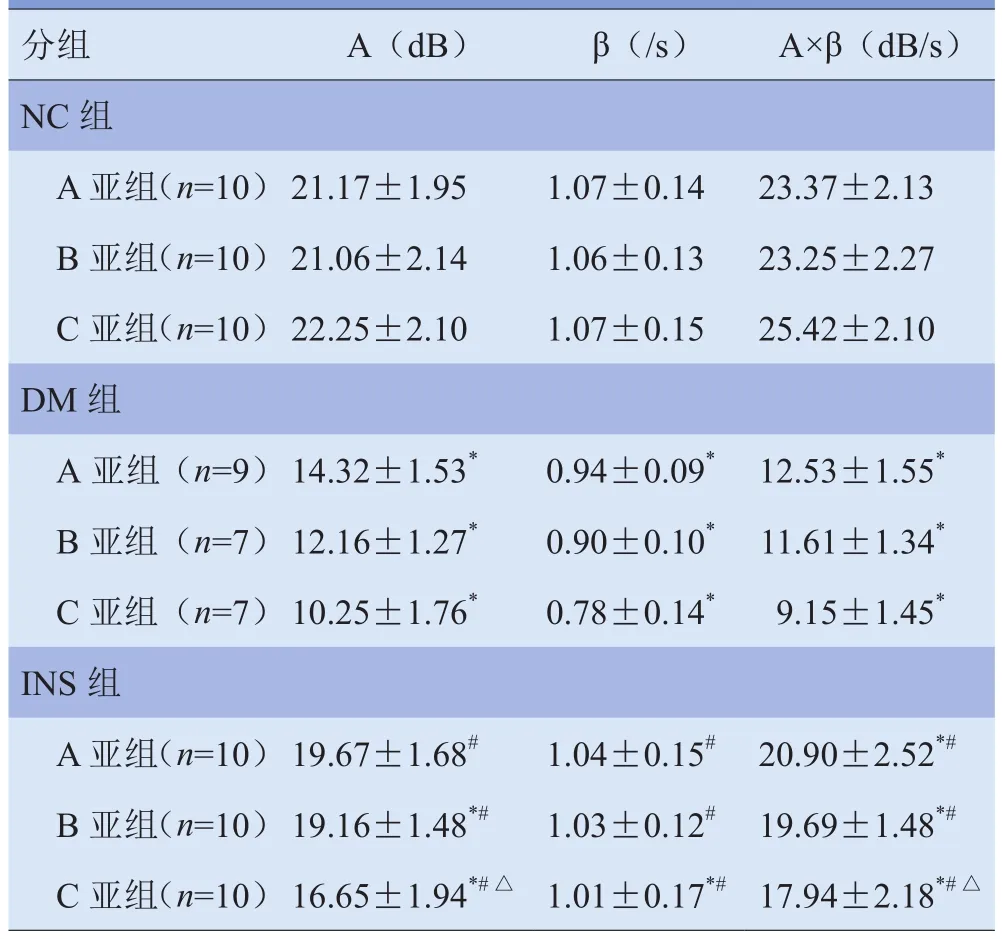
表2 各组大鼠MCE指标比较(±s)
注:与NC组比较,*P<0.05;与DM组比较,#P<0.05;与INS组A亚组比较,△P<0.05
分组 A(dB) β(/s) A×β(dB/s)NC组A亚组(n=10)21.17±1.95 1.07±0.14 23.37±2.13 B 亚组(n=10)21.06±2.14 1.06±0.13 23.25±2.27 C 亚组(n=10)22.25±2.10 1.07±0.15 25.42±2.10 DM组A亚组(n=9)14.32±1.53* 0.94±0.09* 12.53±1.55*B亚组(n=7)12.16±1.27* 0.90±0.10* 11.61±1.34*C亚组(n=7)10.25±1.76* 0.78±0.14* 9.15±1.45*INS组A亚组(n=10)19.67±1.68# 1.04±0.15# 20.90±2.52*#B 亚组(n=10)19.16±1.48*# 1.03±0.12# 19.69±1.48*#C 亚组(n=10)16.65±1.94*#△ 1.01±0.17*#17.94±2.18*#△
表3 各组大鼠毛细血管密度比较(±s)

表3 各组大鼠毛细血管密度比较(±s)
注:与NC组比较,*P<0.05;与DM组比较,#P<0.05;与INS组A亚组比较,△P<0.05
分组 毛细血管密度(个/mm2)NC组A亚组(n=10) 2130.0±260.2 B亚组(n=10) 2259.6±244.0 C亚组(n=10) 2127.6±198.1 DM组A亚组(n=9) 1246.0±155.5*B亚组(n=7) 1114.3±284.7*C亚组(n=7) 991.1±89.0*INS组A亚组(n=10) 1465.6±214.3*#B 亚组(n=10) 1118.5±140.4*△C 亚组(n=10) 1097.2±126.6*△
2.5 大鼠毛细血管超微结构比较 透射电镜下NC组毛细血管基底膜薄而光滑,内皮无肿胀;DM组血管基底膜明显增厚,C亚组为著;INS组A、B亚组基底膜不厚,内皮细胞局部指状突向腔内,C亚组基底膜较DM组明显改善,较NC组稍厚,内皮细胞多发突向管腔。见图2。
3 讨论
DCM是在DM心肌代谢紊乱和微血管病变的基础上出现心肌细胞广泛灶性坏死,进而导致心脏结构和功能发生改变的疾病状态[5]。微血管病变在DCM的发生及发展中起重要作用[6-7];由此提示针对微血管病变的检测和疗效评价可作为DCM诊疗新思路。常规超声仅能反映心肌力学改变,无法评价微循环灌注,心肌核素扫描、心脏MRI可用于评价心肌微循环,但无法动态观察和对心肌血流量做定量分析[8]。因此,探寻一种敏感、准确的心肌灌注评价方法以指导DCM早期干预和疗效评价具有重要的临床意义。
MCE是一种无创的检测心肌血流灌注新技术。通过 fl ash闪烁成像破坏心肌内的超声微泡观察造影剂的再灌注成像,MCE可以对心肌微循环灌注进行定量评价[9]。在检测冠状动脉疾病心肌灌注方面,MCE和单光子发射计算机断层扫描结果显著相关,且MCE敏感性更高[10]。相关研究发现DM大鼠心肌血流量较对照组明显减低,并通过核素扫描及病理结果验证,证明MCE检测的心肌血流量可准确评估体内状态的心肌灌注情况[11-12]。
本研究结果表明,与DM组相比,INS各亚组A、β、A×β均显著增高(P<0.05),提示胰岛素治疗能增加DM大鼠的心肌微循环灌注,延缓DCM病变进展,其原因为胰岛素早期治疗能在一定程度上逆转毛细血管和内皮细胞的结构损伤,进而改善血管内皮功能,增加心肌血容量和血流量,这与von Bibra 等[13]的结果相似。这一结果也通过透射电镜得到验证:INS组毛细血管基底膜厚度较DM组减小,管腔有效面积增大,与Thompson[14]的基础实验结论相符。这表明MCE指标可以准确、客观地反映治疗后心肌灌注较病变组的改善程度。与NC组比较,INS组各亚组MCE评价指标偏低(P<0.0.5),这表明即使成模后即刻进行胰岛素治疗,亦无法完全恢复正常的心肌灌注,推测可能与实验中血糖偏高有关。高血糖可以破坏血管生成相关因子的平衡,降低促血管生成素-1及其受体的表达,导致毛细血管生成减少[15]。另外,长期慢性高血糖作用也会使心肌超微结构出现不可逆性的损害。本研究中免疫组化结果显示,INS组毛细血管计数仅A亚组较DM组稍有改善(P<0.0.5),B亚组、C亚组与DM组间差异无统计学意义(P>0.0.5)。毛细血管密度减低可通过A和A×β反映,因此MCE指标亦能敏感地反映治疗后心肌灌注与对照组的差异。INS不同亚组间比较,C亚组A、A×β低于A亚组(P<0.0.5),B亚组各指标与A亚组差异无统计学意义(P>0.0.5),病理学结果与之相印证:A亚组与B亚组毛细血管超微结构基本正常,而C亚组基底膜稍厚,血管内皮细胞突向管腔,导致血管有效面积缩小。MCE能敏感地检出INS组与DM组、INS组与NC组以及INS组亚组间心肌微血管灌注的差异,其中A、A×β可作为MCE疗效监测的重要参数。

图2 大鼠心肌毛细血管超微结构(醋酸铀-柠檬酸铅双染色,×12 000)。A. NC组C亚组毛细血管基底膜薄而光滑;B. DM组C亚组毛细血管基底膜明显增厚(箭头);C. INS组C亚组毛细血管基底膜稍厚,血管内皮细胞突向管腔内(箭)
本研究将所有大鼠在开胸状态下进行检查,均获得良好的声像图质量,利于准确评价造影结果;但亦存在一定的局限性:由于DM大鼠病程不同,为保证治疗疗程相同,MCE检测存在时间差,因此在对INS组3个亚组进行横向比较时,目前尚无法排除时间因素的干扰,因此有待于进一步深入研究以得到更客观的结论。
总之,胰岛素早期干预能改善微血管结构,增加心肌血流灌注。MCE能敏感、准确地对DCM大鼠的心肌微循环进行评价,且安全无创、易重复检测,可作为DCM早期诊断和动态疗效监测的重要方法,具有明确的临床指导意义。
[1]White MF. Insulin signaling in health and disease. Science,2003, 302(5651): 1710-1711.
[2]Klein LJ, Visser FC. The effect of insulin on the heart: Part 1:effects on metabolism and function. Neth Heart J, 2010, 18(4):197-201.
[3]喻秋珺, 高峰, 马新亮. 重访GIK-谈极化液心脏保护与胰岛素强化治疗. 医学争鸣, 2011, 2(6): 34-37.
[4]刘海涛, 张海锋, 司瑞, 等. 胰岛素保护缺血/再灌注心脏:PI3-K/Akt和JNKs信号通路间的交互作用. 生理学报,2007, 59(5): 651-659.
[5]Boudina S, Abel ED. Diabetic cardiomyopathy, causes and effects. Rev Endocr Metab Disord, 2010, 11(1): 31-39.
[6]Pappachan JM, Varughese GI, Sriraman R, et al. Diabetic cardiomyopathy: pathophysiology, diagnostic evaluation and management. World J Diabetes, 2013, 4(5): 177-189.
[7]Adameova A, Dhalla NS. Role of microangiopathy in diabetic cardiomyopathy. Heart Fail Rev, 2014, 19(1): 25-33.
[8]肖杨杰, 任卫东, 乔伟, 等. 超声实时心肌造影对X综合征心肌微循环的定量评价. 中国医学影像学杂志, 2014, 22(6):401-404.
[9]朱贤胜, 高云华. 心肌声学造影应用进展. 中华超声影像学杂志, 2002, 11(3): 179-180.
[10] Senior R, Moreo A, Gaibazzi N, et al. Comparison of Sulfur hexafluoride microbubble (SonoVue)-enhanced myocardial contrast echocardiography with gated single-photon emission computed tomography for detection of significant coronary artery disease: a large european multicenter study. J Am Coll Cardiol, 2013, 62(15): 1353-1361.
[11] 卫张蕊, 张军, 张海滨, 等. 应用心肌造影超声心动图结合速度向量成像对糖尿病大鼠心肌微循环与收缩功能障碍的相关性研究. 中华超声影像学杂志, 2012, 21(7): 608-612.
[12] 段云燕, 张军, 卫张蕊, 等. 负荷心肌超声造影评价糖尿病大鼠早期心肌灌注演变规律. 中华超声影像学杂志, 2015,24(4): 342-346.
[13] von Bibra H, Hansen A, Dounis V, et al. Augmented metabolic control improves myocardial diastolic function and perfusion in patients with noninsulin dependent diabetes. Heart, 2004,90(12): 1483-1484.
[14] Thompson EW. Structural manifestations of diabetic cardiomyopathy in the rat and its reversal by insulin treatment.Am J Anat, 1988, 182(3): 270-282.
[15] Boodhwani M, Sodha NR, Mieno S, et al. Insulin treatment enhances the myocardial angiogenic response in diabetes. J Thorac Cardiovasc Surg, 2007, 134(6): 1453-1460.
(本文编辑 闻 浩)
Assessment of Myocardial Perfusion in Diabetes Mellitus Rats with Insulin Intervention at Different Times by Using Myocardial Contrast Echocardiography
PurposeTo evaluate the myocardial perfusion in diabetes mellitus (DM) rats with insulin intervention at different times by myocardial contrast echocardiography (MCE)so as to explore the value of MCE in evaluating the treatment of diabetic cardiomyopathy(DCM).Materials and MethodsIn this prospective study, 90 rats were randomly divided into normal control (NC) group, DM group and insulin intervention (INS) group, with 30 rats in each group. After the DM models were established, the INS group was then divided into three subgroups of A, B and C treated with insulin intervention at 0, 4 and 8 weeks respectively and further treated continuously for 12 weeks. The NC and DM groups were also randomly divided into three subgroups and fed synchronously just as the INS group but without insulin intervention. At the end of 12, 16 and 20 weeks after modeling, the rats in each subgroup were examined by MCE. The changes of myocardial blood volume (A),blood velocity (β) and blood fl ow (A×β) were analyzed, and the myocardial tissues were also collected for pathological examination.ResultsA, β and A×β were increased in INS group compared with DM group (P<0.05). Compared with NC group, the values of INS group including A×β in A subgroup, A and A×β in B subgroup, A, β and A×β in C subgroup were decreased (allP<0.05). In INS group, there was no difference in the three values of myocardial blood between A and B subgroup (P>0.05), but A and A×β were lower in C subgroup than those in A subgroup (P<0.05). On pathology, the thickness of capillary basement membrane of INS group improved compared with DM group; the capillary density of INS group increased compared with DM group, but there was signi fi cant difference only in A subgroup (P<0.05).ConclusionEarly insulin intervention can improve myocardial microvascular structure and increase myocardial blood fl ow. MCE can be used to evaluate the myocardial microcirculation of DCM rats sensitively and accurately, which can be used as an important method for early diagnosis and dynamic monitoring of DCM with clinical signi fi cance.
Diabetes complications; Cardiomyopathies; Insulin; Echocardiography;Contrast media; Myocardial reperfusion; Microcirculation; Disease models, animal; Rats,Sprague-Dawley
1. 西安市儿童医院超声科 陕西西安710003
张 军
国家自然科学基金项目(81271580)。
2016-12-08
10.3969/j.issn.1005-5185.2017.06.002
2017-02-27
2. 第四军医大学西京医院超声科 陕西西安710032
Department of Ultrasound, Xijing Hospital,the Fourth Military Medical University, Xi'an 710032, China
Address Correspondence to:ZHANG Jun
E-mail: zhangjun@fmmu.edu.cn
R445.1;R587.1

