有氧运动对颈动脉顺应性与脉压放大的急性影响
孙 朋,李世昌,季 浏,胡 敏
普遍认为,急性抗阻运动(resistance exercise)可以增加动脉的僵硬度(arterial stiffness)[9,15];而急性有氧运动可以降低动脉的僵硬度[3,24]。进一步研究发现,急性有氧运动不但能够降低中央动脉的僵硬度,而且还可以降低外周动脉的僵硬度[15]。研究[8,24]显示,长期有氧训练可以通过改善动脉顺应性(AC,arterial compliance)而降低动脉的僵硬度。相反,长期抗阻训练可以引起AC的降低和动脉僵硬度的增加[9,32]。最近的研究[41]显示,运动的强度和模式是影响AC和动脉僵硬度变化的重要因素。也有研究认为[8,15,24],急性有氧 运 动引 起 的 AC 和 动 脉 僵 硬 度 的 急 性变化与长期有氧训练的累积效应引起的慢性变化关系密切。研究[16,36,43]发现,最大强度的一次有氧运动对血流 动力学指标产生的急性变化与抗阻运动产生的急性变化相似。同时也有大量研究[5,6,37]认为,长期最大强度有氧训练的累积效应对心血管和代谢功能产生的影响是正面的。也有研究[15,21]认为,中低强度的急性有氧运动可以提高全身动脉的AC,并降低中央和外周动脉的僵硬度。研究[9,36]认为,急性有氧运动后恢复期内中央动脉的AC和僵硬度的变化可能与中央脉压(PP,pulse pressure)的改变、交感神经系统(SNS,sympathetic nervous system)对血管平滑肌的调节以及一氧化氮(NO)代谢水平的变化有关。然而,最近的研究[45,48]认为,NO代谢水平的变化并非是运动引起的AC和动脉僵硬度急性变化的原因。SNS对动脉血管平滑肌的调节作用也不能完全解释因急性运动引起的中央动脉僵硬度的急性变化[15,17],因此,运动后PP的变化可能是解释其变化的重要原因。急性有氧运动后可能会引起 运 动 后 低 血 压 (PEH,post exercise hypotension)现象[13,29,31,42]。PEH 在急性运动后30min主要是由 H1(histamine 1)受体介导引起[26];在运动后60min,主要是由 H2(histamine 2)受体介导引起,会持续到运动停止后90 min[30]。
中央PP与肱动PP的生理意义不同,运动后中央动脉和肱动脉的AC和动脉僵硬度的急性变化机制也不尽相同[9,18]。由于血管树的放大作用,中央PP和外周PP产生的差异会引起脉压放大(PPA,pulse pressure amplification)现象。最新的研究[3,38]显示,PPA在预测心血管疾病的发病率和死亡率上存在很大的性别差异[34,38]。目前,有氧运动后中央动脉AC的急性变化机制以及性别间的差异尚不清楚,有氧运动后中央动脉AC的急性变化是否与PPA的急性变化相互影响也未见定论。由于颈动脉被公认为与腹主动脉超微结构相似的弹性中央动脉[35],而且颈动脉相关指标的测取比腹主动脉更方便。因此,本研究以测量颈动脉指标代替中央动脉。本研究的目的是探讨45 min70%心率储备的有氧运动对青年男性和女性颈动脉AC以及血压(BP,blood pressure)的急性影响,另一目的是研究PPA的急性变化是否与颈动脉AC的急性变化相关联。
1 研究对象与方法
1.1 研究对象
62名(男32,女30)受试者,平均年龄为26±5岁,自愿参加本次研究。所有受试者安静状态BP正常[收缩压(SBP)<140mmHg,舒张压(DBP)<90mmHg]。所有受试者均没有吸烟史,没有肥胖以及心血管或代谢疾病,并签署实验知情同意书。
1.2 研究方法
每名受试者需要进行两次测试:第一次测试主要测取受试者的最大心率(HRmax)和峰值摄氧量(˙VO2peak)。第一次测试结束后48h到2周内,受试者可进行第二次测试。第二次测试主要测取受试者在安静状态和运动后30 min以及运动后60min的肱动脉压、颈动脉压、颈动脉内径变化参数等指标。所有指标均从受试者身体右侧部位进行测试。每次测试要求受试者在测试前一周不能服用任何药物(如泰诺、阿司匹林、布洛芬、滴鼻剂、感冒或过敏药物以及避孕药等);在测试前24h不能进行中、高强度的体育运动;测试前12h内,不能饮酒以及服用各种维生素制剂;测试前4h内不能饮用含有咖啡因等刺激性的饮料(如咖啡、苏打水、茶等);测试前3h内除了饮水,不能食用任何食物。
由于人体BP在上午表现不稳定[20],特别是在清晨,BP极易急剧升高[23]。相关研究[22,23]发现:心肌梗死、心源性猝死以及中风等心血管疾病(CVD,cardiovascular disease)的高发时间段为上午6:00至中午12:00。所以,为了排除时间的影响因素,第二次测试全部安排在下午14:30以后进行,此时间段人体的BP相对稳定。测试全程在恒定室温下(68℉)进行。
1.2.1 HRmax的测取
采用K4b2心肺功能测定仪(Cosmed;Rome,Italy)和Bruce跑台模型[4]。受试者进行1~2min的热身运动后开始测试,跑台(FreeMotion;Fitness Blowout,USA)的初始坡度为10°,初始速度为2.7km/h,每3min坡度增加2°,速度根据Bruce跑台模型进行调整。测试的整个过程受试者佩戴心率监控器(Polar Electro,Inc.,Woodbury,NY,USA),通过Cosmed系统实时监控心率的变化。
1.2.2 肱动脉BP的测量
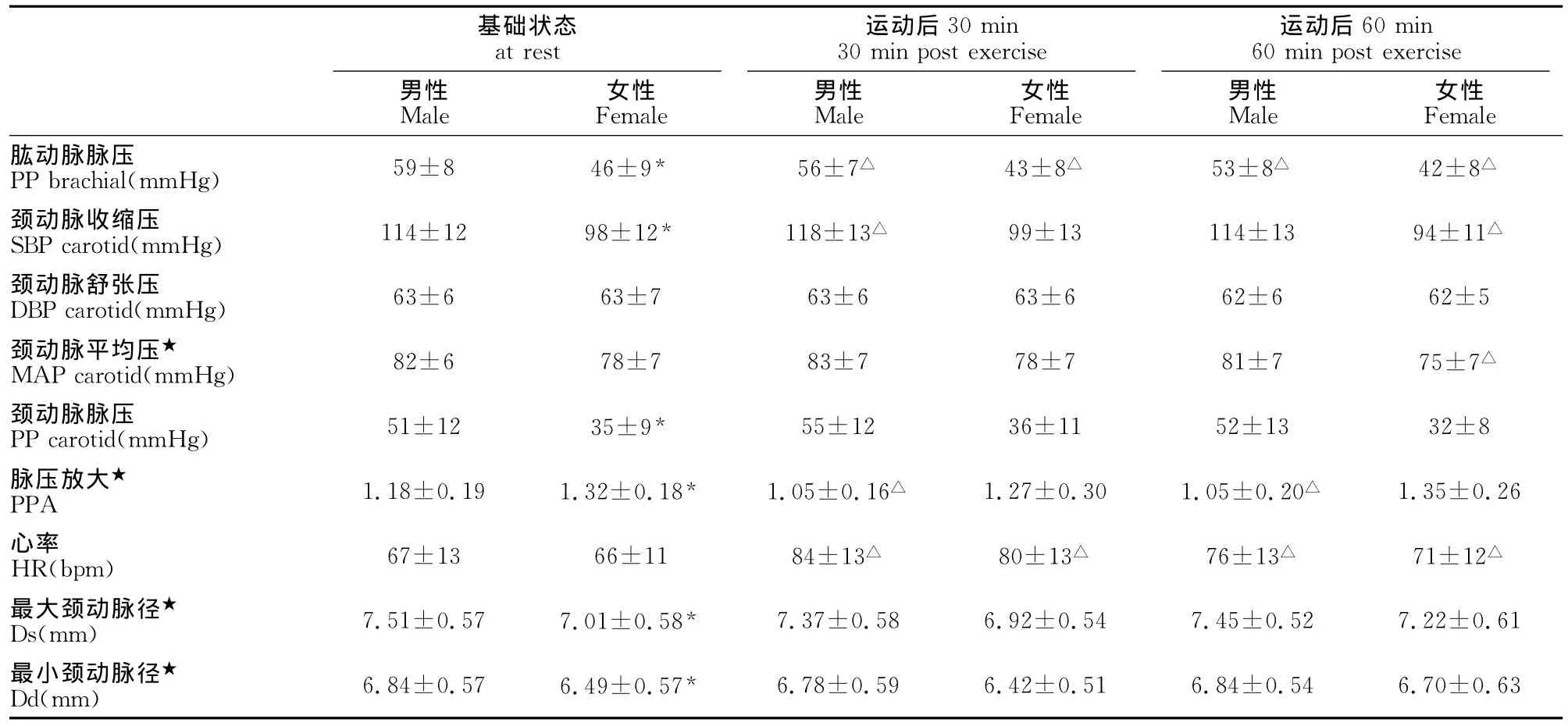
受试者仰卧在测试床上,肱动脉BP的测量使用自动血压测量仪(HEM-907XL;Omron,Japan)。肱动脉 BP安静状态下测取2次,2次测试时间间隔设定为60s。2次测定的结果(SBP、DBP)差值在5mmHg内,则取2次测量数据的平均值作为安静状态下的肱动脉BP。如果2次测量的BP差值大于5mmHg,则进行第3次测试。直至相邻两次测取数据的差值小于5mmHg,然后取其平均值。由于运动后30min和60min的肱动脉BP处在动态恢复过程,所以只需测取一次。PP=SBP-DBP,平均压(MAP)=(SBP+2DBP)/3。
1.2.3 颈动脉脉搏压的测量
受试者仰卧测试床,用脉搏波分析仪(Millar Instruments,Houston,TX,USA)测取受试者右侧颈动脉BP。通过脉搏波分析软件(Sphygmocor Px;Atcor Medical,Australia)用肱动脉MAP和DBP进行颈动脉BP的校准。
1.2.4 内膜中层厚度(IMT,intima-media thickness)和颈动脉内径的测量
运用彩色多普勒超声波(ProSound SSD-α10;Aloka,Japan)在B模式下对颈动脉IMT进行测定。使用高频(7.5 MH)线阵双功探头对受试者右侧颈动脉进行测量,测量部位在颈总动脉分叉处近端后壁1.5cm处;然后,运用彩色多普勒超声波测量受试者在心脏收缩(最大内径)和舒张(最小内径)时期的颈动脉内径的变化参数。测量时运用高频线阵双功探头,在颈总动脉分叉近端1.5cm处纵向追踪成像。颈动脉影像的分析和AC、β的计算运用超声回声(echotracking)跟踪检测软件分析。Echo-tracking软件通过自动跟踪颈动脉内径在收缩和舒张期的变化参数和血压(SBP和DBP)的变化,计算颈动脉血管的AC,公式如下:

僵硬系数(β-stiffness index),是作为评价AC的另外一种手段,它矫正了动脉扩张压力对动脉内径变化的非线性影响因素,公式如下:
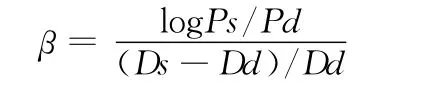
Ds表示颈动脉最大内径(收缩期);Dd表示颈动脉最小内径(舒张期);Ps代表最高血压(收缩期);Pd代表最低血压(舒张期)。
1.2.5 运动方案
有氧运动期间,受试者佩戴polar心率监控仪,运动强度为受试者心率储备(HRR,heart rate reserve)的70%。目标心率=(最大心率-安静心率)×70%+安静心率。受试者先进行1~2min热身运动,然后利用跑台进行45min的有氧运动。当受试者心率达到目标心率-5时开始计时。在45min的有氧运动中,受试者的心率维持在目标心率±5的范围。有氧运动全程有测试人员在场(馆)监护。运动结束后受试者自由休息10min,然后平躺在测试床上,准备进行运动后30min和60min指标的测取。
1.2.6 统计分析
用SPSS 17.0统计软件进行数据处理和分析,数据用平均值±标准差(±SD)表示。用独立样本t检验比较2个组别基础指标的差异;用2×3(2个组别×3个时间点)ANOVA重复测量方差分析法,分析两个性别在运动前、运动后30min和运动后60min的血流动力学、颈动脉内径、AC、β、以及PPA等指标的变化,验后用Turkey法检验组间差异;用person法进行颈动脉AC和PPA的相关性分析(CI=95%)。用P<0.05表示在统计学上有显著性差异。
2 结果
2.1 受试者基础指标的比较
与男性受试者比较,女性受试者在体重、身高、最大心率(HRmax)和峰值摄氧量(˙VO2peak)等指标上低于男性(P<0.05);但是在年龄、身高体重指数(BMI)以及IMT等指标上两个性别不存在显著性差异(表1)。

表1 本研究受试者基础状态指标比较一览表Table 1 Participant Characteristics at Rest
2.2 有氧运动对血流动力学指标的急性影响
2×3(2个组别×3个时间点)ANOVA重复测量方差分析显示,肱动脉 MAP、颈动脉 MAP、PPA以及颈动脉Ds、Dd存在显著性差异(P<0.05);与男性相比,女性在基础状态下肱动脉SBP、肱动脉PP、颈动脉SBP、颈动脉PP以及颈动脉Ds、Dd上存在显著性差异(P<0.05);与基础状态相比,在运动后30min男性肱动脉MAP、肱动脉PP、颈动脉SBP、PPA、HR存在显著性差异(P<0.05),女性肱动脉 MAP、肱动脉PP、HR存在显著性差异(P<0.05);与基础状态相比,在运动后60min男性肱动脉SBP、肱动脉PP、PPA、HR存在显著性差异(P<0.05),女性肱动脉SBP、肱动脉PP、颈动脉SBP、颈动脉 MAP、HR存在显著性差异(P<0.05;表2)。

图1 急性有氧运动引起颈动脉顺应性的变化示意图Figure 1. Carotid Arterial Compliance Following Acute Aerobic Exercise

图2 急性有氧运动引起颈动脉僵硬度变化示意图Figure 2. Carotid Arterialβ-atiffness Following Acute Aerobic Exercise
2.3 有氧运动对颈动脉AC和僵硬度的急性影响
2×3(2组别×3时间)ANOVA重复测量方差分析结果显示,两个组别在运动前、运动后30min和运动后60 min3个时间点的颈动脉AC的变化存在显著性差异(P<0.05);而颈动脉β在2个组别的3个时间点的变化没有显著性差异(图1,图2)。
对存在显著性差异的颈动脉AC进一步分析发现,与运动前水平比较,运动后30min男性颈动脉AC降低的幅度大于女性(P<0.05,图3,图4);与运动前水平比较,运动后60min男性颈动脉AC低于运动前水平;而女性的颈动脉 AC高于运动前水平(P<0.05,图5,图6)。
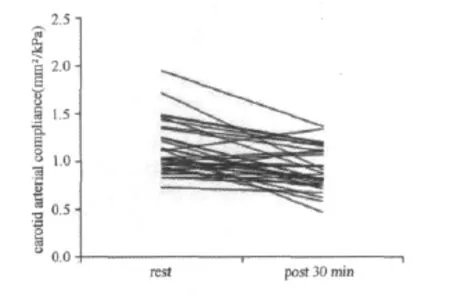
图3 男性颈动脉顺应性运动后30min变化示意图Figure 3. Individual Arterial Compliance Responses to 30min after Exercise in men
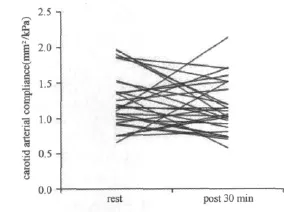
图4 女性颈动脉顺应性运动后30min变化示意图Figure 4. Individual Arterial Compliance Responses to 30min after Exercise in Women
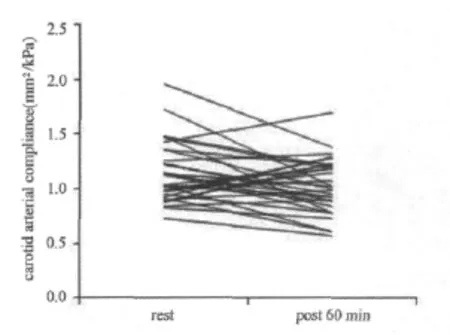
图5 男性颈动脉顺应性运动后60min变化示意图Figure 5. Individual Arterial Compliance Responses to 60min after Exercise in men

图6 女性颈动脉顺应性运动后60min变化示意图Figure 6. Individual Arterial Compliance Responses to 60min after Exercise in Women

表2 本研究运动前、运动后30min和运动后60min肱动脉和颈动脉变化参数一览表Table 2 Brachial and Carotid Hemodynamic before and 30min and 60min after Acute Aerobic Exercise
续表2
2.4 颈动脉AC与PPA的相关性分析
用person方法进行相关性分析(CI=95%)发现:经过急性有氧运动,颈动脉AC与PPA相关性系数r=0.653(P=0.00),两者具有统计学意义上的显著正相关(图7)。
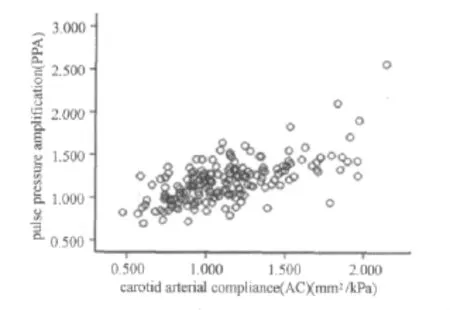
图7 颈动脉顺应性与脉压扩大关系示意图(置信区间=95%)Figure 7. Association between Changes in AC and Change PPA Following Acute Exercise(CI=95%)
3 讨论
3.1 有氧运动对颈动脉AC的急性影响
AC是指在单位压力改变下,动脉血管面积、直径或体积的改变,它依赖于血管的几何和机械特性[7]。β指数是在矫正扩张压力对动脉内径变化的非线性影响因素后,进行评价动脉AC的有效指标[41]。由于颈动脉被公认为与腹主动脉超微结构相似的弹性中央动脉,因此颈动脉的AC和僵硬度的变化能够反映中央动脉的AC和僵硬度的变 化[35]。 以 往 的 研 究 显 示 :高 强 度 的 动 态[46,47]或 者 静态[10,27,28,39]的 运 动 会 引 起 中 央 动 脉 AC 的 降 低 和 僵 硬 度 的增加。同样,急性抗阻运动后,中央动脉也表现AC的降低和僵硬度的增加[11,49]。相反,较低强度的急性有氧运动可能引起中央动脉AC的增加和僵硬度的降低[15]。本研究的结果显示:2×3ANOVA 重复测量方差分析时,颈动脉AC存在显著性差异(P<0.05),而β指数在2个组别的3个时间点的变化不存在显著性差异。相比较运动前水平,在运动后30min男、女两组受试者均表现颈动脉AC降低,这可能与恢复期颈动脉保持较高的PP有关[41]。由于有氧运动的急性影响,可能引起动脉血液中的二氧化碳(CO2)含量的升高和氧(O2)分压的降低,通过动脉压力感受器和化学感受器的感应引起机体SNS兴奋性的增强和去甲肾上腺素(NE)以及5-羟色胺(5-HT)浓度的增高。SNS兴奋性的增强,可以增强心肌的收缩力和提高外周血管阻力(TPR,total peripheral resistance)[25];NE通过α型肾上腺素能受体的激动,可以引起血管平滑肌的强力收缩,引起TPR增加。通过β受体的激动,则可以引起心肌收缩能力的增强[12];5-HT是一种强有力的血管收缩剂,通过血管强有力的收缩可引起TPR的增加。由于,在恢复期前30min急性有氧运动对机体产生的影响尚未完全消除,SNS的兴奋性仍占优势并且NE和5-HT的浓度仍保持较高水平,引起TPR的增加和心肌收缩力的增强,从而使颈动脉SBP也保持在较高水平。由于颈动脉DBP保持不变,因此会引起颈动脉PP的升高(pp=SBP-DBP)。随着颈动脉PP的升高,颈动脉血管内压力负荷由良好顺应性的弹性纤维转向硬度较大的胶原纤维[41],颈动脉血管僵硬度被动的引起增加,导致颈动脉AC降低。
进一步分析运动后60min的数据发现,女性颈动脉AC比运动前增加,而男性颈动脉AC比运动前降低。颈动脉AC的变化与颈动脉收缩压(Ps)、舒张压(Pd)、收缩内径(Ds)和 舒 张 内 径 (Ds)有 关[41]。 也 有 研 究[15,42]认 为,急性运动后恢复期动脉血管AC的变化与血管内压力变化关系不密切,主要是由动脉血管壁自身属性的变化引起。本研究结果显示两个组别的3个时间段Ps和Pd不存在显著性差异,而Ds和Ds则存在显著性的差异(P<0.05)。因此,2个组别在3个时间点颈动脉AC的变化可能是由颈动脉血管自身属性的变化引起,此结果与前人的研究一致。研究[31]认为,动脉AC和僵硬度与血管自身的传导性关系更为密切,而运动后动脉传导性的变化可能是通过血管中 H1(histamine 1)受体和 H2(histamine 2)受体介导的血管舒张引起的。H1受体主要位于血管内皮细胞(ECs,endothelial cells),当H1受体被激动后可以通过释放一氧化氮样内皮舒张因子(EDRF)和前列环素(PGI2)来调节血管的传导性;H2受体主要位于血管平滑肌细胞(VSMCs,vascular smooth muscle cells),当 H2受体被激动后,可以通过降低细胞内的Ca2+的水平来调节血管的传导性[19,30]。H1受体和 H2受体激动的时间存在差异。H1受体介导的运动后血管舒张主要发生在急性运动后的30 min[26],H2受体介导的运动后血管舒张主要发生在运动后60~90min[30]。因此在运动后30min颈动脉AC的降低可能也是由于运动后H1受体介导的血管舒张作用不能完全抵消运动应激引起的心输出量(CO)的增加而引起的[14,44]。在运动后60min女性的颈动脉AC高于运动前水平,而男性的颈动脉AC低于运动前水平,这说明H2受体介导的血管舒张表现为在女性受试者中的调节作用强于男性。其可能机制为,有氧运动后60min,雌性激素在H2受体介导的血管舒张中起到积极作用。前人的相关研究[20,34]也认为,女性荷尔蒙雌性激素能有效保护血管功能,主要表现在女性绝经后和男性人群中心血管疾病和高血压的发病率明显高于绝经前女性,但是具体调控机制尚不清楚。
3.2 颈动脉AC与PPA的关系
PPA能够有效对颈动脉和肱动脉的高风险进行评估[1,40]以及对心血管疾病的死亡率进行有效预测[3]。一项最新研究显示[38],女性较男性而言,动脉硬化导致的PPA衰减对心血管疾病发病具有更大影响。PPA是由沿着血管树进行压力波的传播和波的反射引起[2],中央动脉和外周动脉僵硬度的差异是决定PPA的主要因素。PPA的生理学标志物是肱动脉和颈动脉压力之间的差异,常用肱动脉压与颈动脉压比值(肱动脉PP/颈动脉PP)表示。脉冲通过动脉血管时,由于导管的直径逐渐减小以及僵硬度的增加,引起外周血管壁的阻力增加和脉搏波发生反射,导致外周(肱动脉)PP高于中央PP,产生PPA现象。研究[38]认为,PPA有三个主要决定因素:每搏输出量(SV,stroke volume)、动脉僵硬度和脉搏波的反射,其中在大动脉中后两个因素对PPA的影响尤为显著。有氧运动后,PPA的急性变化是否与颈动脉AC相关,目前尚无定论。本研究结果显示,急性有氧运动后PPA与颈动脉AC呈显著正相关(R=0.635,P=0.00),这提示有氧运动后颈动脉AC的急性变化可能也是引起PPA急性变化的重要因素。其可能机制为:由于运动的急性影响,引起机体SNS、TPR和心肌收缩力以及CO发生变化,进而引起颈动脉顺应性被动变化。颈动脉AC被动增加(或降低)引起颈动脉血管壁舒张功能的增加(或降低)以及僵硬度的降低(或增加),导致颈动脉SBP进一步降低(或升高)。因为在运动后恢复期颈动脉DBP没有明显变化,所以可以引起颈动脉PP的降低(或升高)。由于PPA=肱动脉PP/颈动脉PP,因此在肱动脉PP相对稳定的情况下,会引起PPA的升高(或降低)。但是急性有氧运动后,颈动脉AC和PPA相互影响的具体机制尚不完全清楚,是否同时由SV以及动脉僵硬度和脉搏波的反射等其他因素共同作用引起颈动脉AC和PPA变化的一致性,尚待进一步研究。
4 结论
45min70%心率储备的有氧运动能够引起颈动脉AC的急性变化,表现为与运动前水平比较,运动后30min男性和女性颈动脉AC均降低;运动后60min男性的颈动脉AC降低而女性颈动脉AC增加。运动后60min男、女性别间颈动脉AC变化的差异可能是由于H2受体介导的血管舒张功能受性激素影响而引起。有氧运动也引起PPA的急性变化,其变化趋势与颈动脉AC的急性变化趋势一致,颈动脉AC的增大(或降低)可能是引起PPA增大(或降低)的一个重要因素。
[1]AGABITI-ROSEI E,MANCIA G,O'ROURKE M F,et al.Central blood pressure measurements and antihypertensive therapy:a consensus document[J].Hypertension,2007,50(1):154-160.
[2]AVOLIO A P,VAN BORTEL L M,BOUTOUYRIE P,et al.Role of pulse pressure amplification in arterial hypertension:experts'opinion and review of the data[J].Hypertension,2009,54(2):375-383.
[3]BENETOS A,THOMAS F,JOLY L,et al.Pulse pressure amplification a mechanical biomarker of cardiovascular risk[J].J Am Coll Cardiol,2010,55(10):1032-1037.
[4]BRUCE R A,JR LOVEJOY F W,Et A.Normal respiratory and circulatory pathways of adaptation in exercise[J].J Clin Invest,1949,28(6,Pt.2):1423-1430.
[5]BURGOMASTER K A,HOWARTH K R,PHILLIPS S M,et al.Similar metabolic adaptations during exercise after low volume sprint interval and traditional endurance training in humans[J].J Physiol,2008,586(1):151-160.
[6]BURGOMASTER K A,HUGHES S C,HEIGENHAUSER G J,et al.Six sessions of sprint interval training increases muscle oxidative potential and cycle endurance capacity in humans[J].J Appl Physiol,2005,98(6):1985-1990.
[7]BURR J F,BREDIN S S,PHILLIPS A,et al.Systemic arterial compliance following ultra-marathon[J].Int J Sports Med,2012,33(3):224-229.
[8]CAMERON J D,DART A M.Exercise training increases total systemic arterial compliance in humans[J].Am J Physiol,1994,266(2Pt 2):H693-H701.
[9]DEVAN A E,ANTON M M,COOK J N,et al.Acute effects of resistance exercise on arterial compliance[J].J Appl Physiol,2005,98(6):2287-2291.
[10]EDWARDS D G,MASTIN C R,KENEFICK R W.Wave reflection and central aortic pressure are increased in response to static and dynamic muscle contraction at comparable workloads[J].J Appl Physiol,2008,104(2):439-445.
[11]FAHS C A,HEFFERNAN K S,Fernhall B.Hemodynamic and vascular response to resistance exercise with L-arginine[J].Med Sci Sports Exe,2009,41(4):773-779.
[12]FOSSA A A,WISIALOWSKI T A,CREMERS T,et al.Improved preclinical cardiovascular therapeutic indices with longterm inhibition of norepinephrine reuptake using reboxetine[J].Toxicol Appl Pharmacol,2012,264(3):343-350.
[13]HALLIWILL J R.Mechanisms and clinical implications of postexercise hypotension in humans[J].Exerc Sport Sci Rev,2001,29(2):65-70.
[14]HECKSTEDEN A,GRUTTERS T,MEYER T.Association Between Postexercise Hypotension and Long-term Training-Induced Blood Pressure Reduction:A Pilot Study[J].Clin J Sport Med,2012,51(4):701-707.
[15]HEFFERNAN K S,COLLIER S R,KELLY E E,et al.Arterial stiffness and baroreflex sensitivity following bouts of aerobic and resistance exercise[J].Int J Sports Med,2007,28(3):197-203.
[16]HEFFERNAN K S,JAE S Y,ECHOLS G H,et al.Arterial stiffness and wave reflection following exercise in resistancetrained men[J].Med Sci Sports Exe,2007,39(5):842-848.
[17]HEFFERNAN K S,JAE S Y,LEE M,et al.Arterial wave reflection and vascular autonomic modulation in young and older men[J].Aging Clin Exp Res,2008,20(1):1-7.
[18]HEFFERNAN K S,JAE S Y,WILUND K R,et al.Racial differences in central blood pressure and vascular function in young men[J].Am J Physiol Heart Circ Physiol,2008,295(6):H2380-H2387.
[19]HILL S J.Distribution,properties,and functional characteristics of three classes of histamine receptor[J].Pharmacol Rev,1990,42(1):45-83.
[20]JONES H,PRITCHARD C,GEORGE K,et al.The acute postexercise response of blood pressure varies with time of day[J].Eur J Appl Physiol,2008,104(3):481-489.
[21]JOYNER M J.Effect of exercise on arterial compliance[J].Circulation,2000,102(11):1214-1215.
[22]KARIO K,PICKERING T G,UMEDA Y,et al.Morning surge in blood pressure as a predictor of silent and clinical cerebrovas-cular disease in elderly hypertensives:aprospective study[J].Circulation,2003,107(10):1401-1406.
[23]KHOURY A F,SUNDERAJAN P,KAPLAN N M.The early morning rise in blood pressure is related mainly to ambulation[J].Am J Hypertens,1992,5(6Pt 1):339-344.
[24]KINGWELL B A,BERRY K L,CAMERON J D,et al.Arterial compliance increases after moderate-intensity cycling[J].Am J Physiol,1997,273(5Pt 2):H2186-H2191.
[25]LI J,XING J.Muscle afferent receptors engaged in augmented sympathetic responsiveness in peripheral artery disease[J].Front Physiol,2012,3:247.
[26]LOCKWOOD J M,WILKINS B W,HALLIWILL J R.H1receptor-mediated vasodilatation contributes to postexercise hypotension[J].J Physiol,2005,563(Pt 2):633-642.
[27]LYDAKIS C,MOMEN A,BLAHA C,et al.Changes of central haemodynamic parameters during mental stress and acute bouts of static and dynamic exercise[J].J Hum Hypertens,2008,22(5):320-328.
[28]LYDAKIS C,MOMEN A,BLAHA C,et al.Changes of elastic properties of central arteries during acute static exercise and lower body negative pressure[J].Eur J Appl Physiol,2008,102(6):633-641.
[29]MACDONALD J R.Potential causes,mechanisms,and implications of post exercise hypotension[J].J Hum Hypertens,2002,16(4):225-236.
[30]MCCORD J L,BEASLEY J M,HALLIWILL J R.H2-receptormediated vasodilation contributes to postexercise hypotension[J].J Appl Physiol,2006,100(1):67-75.
[31]MCCORD J L,HALLIWILL J R.H1and H2receptors mediate postexercise hyperemia in sedentary and endurance exercisetrained men and women[J].J Appl Physiol,2006,101(6):1693-1701.
[32]MIYACHI M,KAWANO H,SUGAWARA J,et al.Unfavorable effects of resistance training on central arterial compliance:a randomized intervention study[J].Circulation,2004,110(18):2858-2863.
[33]MULLER J E.Circadian variation in cardiovascular events[J].Am J Hypertens,1999,12(2Pt 2):35S-42S.
[34]NOON J P,TRISCHUK T C,GAUCHER S A,et al.The effect of age and gender on arterial stiffness in healthy Caucasian Canadians[J].J Clin Nurs,2008,17(17):2311-2317.
[35]PAINI A,BOUTOUYRIE P,CALVET D,et al.Carotid and aortic stiffness:determinants of discrepancies[J].Hypertension,2006,47(3):371-376.
[36]RAKOBOWCHUK M,STUCKEY M I,MILLAR P J,et al.Effect of acute sprint interval exercise on central and peripheral artery distensibility in young healthy males[J].Eur J Appl Physiol,2009,105(5):787-795.
[37]RAKOBOWCHUK M,TANGUAY S,BURGOMASTER K A,et al.Sprint interval and traditional endurance training in-duce similar improvements in peripheral arterial stiffness and flow-mediated dilation in healthy humans[J].Am J Physiol Regul Integr Comp Physiol,2008,295(1):R236-R242.
[38]REGNAULT V,THOMAS F,SAFAR M E,et al.Sex difference in cardiovascular risk:role of pulse pressure amplification[J].J Am Coll Cardiol,2012,59(20):1771-1777.
[39]REID K F,CONWAY M A.Haemodynamic determinants of elevated pulse wave velocity during acute isometric handgrip exercise[J].Ir J Med Sci,2006,175(3):13-19.
[40]ROMAN M J,DEVEREUX R B,KIZER J R,et al.Central pressure more strongly relates to vascular disease and outcome than does brachial pressure:the Strong Heart Study[J].Hypertension,2007,50(1):197-203.
[41]ROSSOW L,FAHS C A,GUERRA M,et al.Acute effects of supramaximal exercise on carotid artery compliance and pulse pressure in young men and women[J].Eur J Appl Physiol,2010,110(4):729-737.
[42]ROSSOW L,YAN H,FAHS C A,et al.Postexercise hypotension in an endurance-trained population of men and women following high-intensity interval and steady-state cycling[J].Am J Hypertens,2010,23(4):358-367.
[43]SAGIV M,BEN-SIRA D,GOLDHAMMER E.Direct vs.indirect blood pressure measurement at peak anaerobic exercise[J].Int J Sports Med,1999,20(5):275-278.
[44]SENITKO A N,CHARKOUDIAN N,HALLIWILL J R.Influence of endurance exercise training status and gender on postexercise hypotension[J].J Appl Physiol,2002,92(6):2368-2374.
[45]SHARMAN J E,MCENIERY C M,CAMPBELL R,et al.Nitric oxide does not significantly contribute to changes in pulse pressure amplification during light aerobic exercise[J].Hypertension,2008,51(4):856-861.
[46]SHARMAN J E,MCENJERY C M,CAMPBELLl R I,et al.The effect of exercise on large artery haemodynamics in healthy young men[J].Eur J Clin Invest,2005,35(12):738-744.
[47]STUDINGER P,LENARD Z,KOVATS Z,et al.Static and dynamic changes in carotid artery diameter in humans during and after strenuous exercise[J].J Physiol,2003,550(Pt 2):575-583.
[48]SUGAWARA J,MAEDA S,OTSUKI T,et al.Effects of nitric oxide synthase inhibitor on decrease in peripheral arterial stiffness with acute low-intensity aerobic exercise[J].Am J Physiol Heart Circ Physiol,2004,287(6):H2666-H2669.
[49]YOON E S,JUNG S J,CHEUN S K,et al.Effects of acute resistance exercise on arterial stiffness in young men[J].Korean Circ J,2010,40(1):16-22.

