缺血性脑血管病患者MPO的表达水平与颈动脉粥样硬化斑块类型及HCMV相关性研究
孔伟丽,谷聚贤,何俊瑛*,高玉林
(1.河北省定州市人民医院神经内科,河北定州 071500;2.河北医科大学第二医院神经内科,河北石家庄 050000)
·论 著·
缺血性脑血管病患者MPO的表达水平与颈动脉粥样硬化斑块类型及HCMV相关性研究
孔伟丽1,谷聚贤2,何俊瑛2*,高玉林2
(1.河北省定州市人民医院神经内科,河北定州 071500;2.河北医科大学第二医院神经内科,河北石家庄 050000)
目的探讨髓过氧化物酶(marrow peroxide,MPO)与颈动脉粥样硬化斑块类型及人巨细胞病毒(human cytomegalovirus,HCMV)激活感染的相关性。方法研究对象选择符合入选条件的患者84例,均行外周血白细胞HCMV-PP65、颈动脉超声、血清MPO检查,比较不同斑块类型组HCMV-PP65、血清MPO的差别,并比较PP65阳性组与阴性组中血清MPO的差别。结果不稳定斑块组HCMV-PP65阳性率(56.76%)明显高于稳定斑块组(30.30%);HCMV-PP65阳性组MPO平均含量(132.63±5.44)μg/L高于阴性组(92.55±5.39)μg/L;有斑块组MPO平均含量(112.09±9.13)μg/L高于无斑块组(87.32±8.29)μg/L,不稳定斑块组MPO平均含量(146.91±9.56)μg/L高于稳定斑块组(73.04±9.92)μg/L;PP65阳性病例中,有斑块组MPO平均含量(138.34± 13.55)μg/L高于无斑块组(92.53±1.76)μg/L,不稳定斑块组MPO平均含量(170.50±11.36)μg/L高于稳定斑块组(93.32±2.67)μg/L;以上差异均有统计学意义(P<0.05)。结论不稳定颈动脉粥样硬化斑块者HCMVPP65阳性率显著高于稳定斑块者,HCMV激活感染在动脉粥样硬化形成中起着重要作用,HCMV激活感染可促进MPO的表达,且有促使斑块不稳定的倾向,HCMV、MPO、AS之间存在相关性。
动脉粥样硬化;颈动脉狭窄;过氧化物酶
多数缺血性脑血管病患者伴有动脉粥样硬化,因此积极寻找动脉粥样硬化的病因并开展针对性的防治是临床迫切需要解决的难题。近年来多项研究[1-2]表明微生物感染,尤其人巨细胞病毒(human cytomegalovirus,HCMV)激活感染与动脉粥样硬化(atherosclerosis,AS)紧密相关,HCMV激活感染所引起的炎症和免疫反应可能在AS的发生和发展中起着重要作用。本研究通过测定入选受试者的外周血HCMV晚期抗原PP65以及对受试者进行颈动脉超声检查以确定颈AS斑块类型,并检测血清髓过氧化物酶(marrow peroxide,MPO)含量,探讨HCMV激活感染与不同类型的颈部斑块尤其是易损性斑块的相关性,并进一步研究受试者外周血中HCMVPP65及血清MPO与不同类型斑块的相关性,探讨HCMV激活感染后诱发AS斑块形成及破裂的分子机制。
1 资料与方法
1.1 研究对象:2008年3月—2009年12月河北医科大学第二医院神经内科门诊和住院患者84例,男性61例,女性23例,年龄30~75岁,平均(53.77± 8.63)岁。入选标准如下。①符合1995年全国第4届脑血管病会议制定的脑梗死的诊断标准,并经头颅CT或MRI证实为脑梗死。②起病在6h~7d内,病情仍进行性加重。③病史中有短暂性脑缺血发作史。④颈动脉超声提示颈总动脉和(或)颈内动脉有狭窄或闭塞,多发AS斑块形成。⑤头MRA提示颅内颈内动脉或椎基底动脉等重要动脉狭窄或闭塞。患者符合第1或第3条加上2、4、5条中的1条即可入选。排除标准如下。①脑出血。②糖尿病。③原发性高血压控制不达标、继发性高血压。④心肌病、心功能Ⅱ级或以上。⑤血液系统疾病。⑥肝、肾功能不全。⑦近期感染史。⑧长期服用避孕药、妊娠、哺乳期。⑨酗酒。⑩肿瘤。
1.2 超声检查:应用飞利浦IU-22型彩色多普勒超声诊断仪,选取线阵探头,频率5~12MHz,观察并记录以管腔内膜面到中层与外膜交界处的垂直距离有无粥样硬化斑块及其部位、大小、回声强度和表面特征。
1.3 斑块类型判定:参照改良的Hennerici分类法[2]。本研究根据斑块稳定程度将扁平斑、软斑、混合斑纳入不稳定斑块组(37例),硬斑及内膜增厚纳入稳定斑块组(33例),而溃疡斑和斑块内出血这2种类型则由于技术条件所限暂不考虑在本试验组内。
1.4 外周血白细胞HCMV-PP65抗原的测定:抽取空腹静脉血2mL,2%乙二胺四乙酸二钠抗凝,分离血浆及多形核白细胞,将白细胞悬液滴到APES玻片上,37℃温箱烘干,加入鼠抗人HCMV一抗(丹麦DAKO公司),孵育40min后加入羊抗鼠二抗(上海基因生物科技有限公司),孵育30min后二氨基联苯胺显色10min,苏木素复染,日本 OLYMPUS BX-41光学显微镜下计数阳性细胞数(以每5万个白细胞中的阳性细胞数计算)。阳性细胞胞浆或胞核为棕黄色,阴性细胞为均匀一致的蓝紫色,阳性细胞数>1/50 000判为PP65抗原阳性。
1.5 血清MPO的检测:MPO试剂盒由美国R&D公司生产,严格按照说明书操作步骤进行。
1.6 统计学方法:应用SPSS13.0统计软件进行数据分析,计量资料±s表示,组间比较采用t检验;计数资料以百分率表示,组间比较采用 χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同AS斑块类型HCMV-PP65阳性率比较:84例中颈动脉超声提示无斑块形成14例,其中HCMV-PP65阳性5例(35.71%);稳定性粥样硬化斑块形成33例,其中HCMV-PP65阳性10例(30.30%);不稳定性斑块形成37例,其中HCMVPP65阳性 21例(56.76%)。不稳定性斑块HCMV-PP65阳性率明显高于稳定性斑块(χ2= 4.927,P<0.05),见表1。
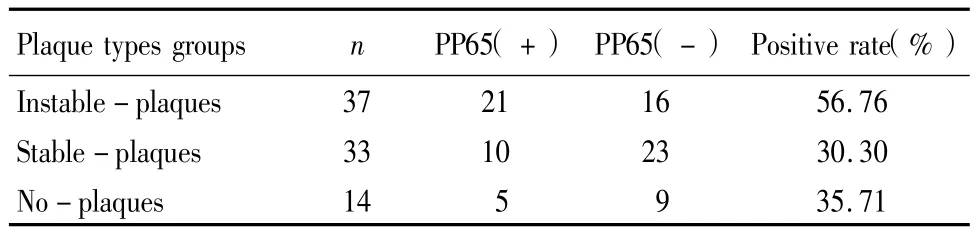
表1 不同动脉粥样硬化斑块类型HCMV-PP65阳性率比较Table 1 Postive rate of HCMV-PP65 in differentty Pes of atherosclerosis Plaques(n)
2.2 HCMV-PP65阳性及阴性组MPO平均含量比较:HCMV-PP65阳性及阴性组中MPO平均含量分别为(132.63±5.44)、(92.55±5.39)μg/L,2组含量差异有统计学意义(t=28.153,P<0.05)。
2.3 不同AS斑块类型组MPO平均含量比较:有斑块组、无斑块组MPO平均含量分别为(112.09± 9.13)、(87.32±8.29)μg/L,有斑块组MPO平均含量高于无斑块组,差异有统计学意义(t=9.897,P<0.05)。不稳定斑块组、稳定斑块组MPO平均含量分别为(146.91±9.56)、(73.04±9.92)μg/L,不稳定斑块组MPO平均含量高于稳定斑块组,差异有统计学意义(t=30.204,P<0.05)。
2.4 HCMV-PP65阳性患者中不同AS斑块类型MPO含量比较:HCMV-PP65阳性患者中,在有斑块组、无斑块组MPO平均含量分别为(138.34± 13.55)、(92.53±1.76)μg/L,HCMV-PP65阳性患者有斑块组MPO平均含量高于无斑块组,差异有统计学意义(t=9.786,P<0.05)。不稳定斑块组、稳定斑块组MPO平均含量分别为(170.50±11.36)、(93.32±2.67)μg/L,HCMV-PP65阳性患者不稳定斑块组MPO平均含量高于稳定斑块组,差异有统计学意义(t=54.874,P<0.05)。
3 讨 论
AS是缺血性脑卒中最重要的病因和危险因素,因此寻找其发病机制,采取措施进行积极防治可从根本上降低缺血性脑卒中的发病率,研究发现炎症反应参与AS的发生、发展,导致斑块形成及不稳定化,多种炎性相关蛋白出现在斑块局部[3-4],推测微生物激活感染及其导致的炎症及免疫反应可能是动脉粥样硬化发生发展及导致斑块不稳定的主要因素,本研究结果显示,不稳定斑块组HCMV-PP65阳性率高于稳定斑块组及无斑块组,有斑块组MPO平均含量高于无斑块组不稳定斑块组MPO平均含量高于稳定斑块组。所得出的结论均与文献报道一致[5-6]。
HCMV感染人体后可于机体多种组织细胞内处于潜伏感染状态,最主要的包括动脉血管内皮及内膜下平滑肌组织,当机体由于各种原因如使用甾体激素、进行免疫抑制治疗及免疫功能降低状态下时,病毒潜伏状态转变为激活感染状态,复制形成大量完整的病毒。HCMV-PP65是一种重要的晚期抗原,HCMV活动性感染时HCMV-PP65表达于外周血单核细胞、中性多形核白细胞和血管内皮细胞中。1995年斯德哥尔摩国际巨细胞病毒感染学术会议上首次肯定PP65的价值,现已成为国际公认的诊断HCMV活动性感染的标准方法之一[7]。
HCMV感染可以导致包括MPO等一系列炎性因子的表达上调,使内皮细胞受损,其过程为单核细胞进入动脉壁的内膜下间隙,激活并分化为巨噬细胞;MPO能够促进一氧化氮作为一种底物而消耗,从而限制其生物利用度,并通过跨细胞作用积蓄于内皮下间隙,干涉一氧化氮对血管壁的扩张作用及抗炎症功能,此外损伤的内膜也有利于单核-巨噬细胞浸润入内皮下,吞噬脂质形成泡沫细胞,MPO可刺激内皮细胞的炎症反应加速 AS的进展[8-9]。本研究中,PP65阳性组MPO平均含量与阴性组差异有统计学意义,而且HCMV-PP65阳性有斑块组MPO平均含量高于无斑块组,不稳定斑块组MPO平均含量高于稳定斑块组。证实了人巨细胞病毒激活感染促进MPO的表达,进而促使AS的进展并使斑块趋向不稳定。
大量的试验研究[10]证明,AS的形成过程是一个稳定和不稳定周期交替的过程,而这种转化则通过斑块的易损性来决定。早有研究证实,对斑块破裂起决定作用的是斑块的稳定性,而非斑块所致的血管腔的狭窄程度,软斑患者较混合斑患者体内炎症水平更高,新生血管网更丰富,且越不稳定,发生脑血管事件的几率更高,AS的稳定程度是通过包括其自身组成形状、炎症细胞浸润、细胞因子和斑块内压等多种因素协同作用的结局,目前已知局部炎症细胞的浸润以及全身急性炎症是导致斑块易损破裂的最主要原因之一[11]。斑块内的炎性细胞浸润及其一系列炎性产物的产生使得动脉硬化的血管中微血管网异常丰富,同时它们甚至可延伸至动脉硬化损伤处的内膜中,对粥样斑块内脂质中心的增大、纤维组织完整性的损伤及细胞外基质的降解均发挥着显著的作用,并由此加重内膜损害,纤维帽变薄,导致斑块内出血,是造成斑块不稳定、斑块破裂的重要促发因素。本研究中,MPO平均含量在有、无斑块组分别为112.09μg/L、87.32μg/L,2组比较差异有统计学意义,提示高水平的MPO可促使粥样硬化斑块的形成;不稳定斑块组MPO平均含量高于稳定斑块组,提示斑块种类不同,MPO的表达程度不同;而在人巨细胞激活感染状态下,MPO在有、无斑块分组及不稳定斑块组、稳定斑块组的比较含量差异有统计学意义,说明了人巨细胞激活感染引起的炎症反应、MPO的表达上调及斑块稳定程度之间存在正相关性。
综上所述,HCMV激活感染在AS形成中起着重要作用,HCMV激活感染可促进MPO的表达,且有促使斑块不稳定的倾向,HCMV、MPO、AS之间存在相关性,且HCMV感染引起的炎症反应在AS的发生和发展中起着重要作用,研究HCMV激活感染及继发的免疫反应和炎症反应将为AS的防治提供新的方法。
[1] NEUS R,MONSERRAT F,MONICA G,et al.Association of atherosclerosis with expression of the LILRB1 receptor by human NK and T-cells supports the infectious burden hypothesis[J]. AHA,2011,11(5):233-238.
[2] HAFID A,ALAIN TAZ,MALLAT J.Immune regulation in atherosclerosis and the hygiene hypothesis[J].Biomed Life Sci,2009,10(4):221-238.
[3] ANA VI,SILVIA LM,SABRINA RG,et al.Detection of human cytomegalovirus and Epstein- Barr virus in coronary atherosclerotic tissue[J].Braz J Microbiol,2010,42(10):1590 -1597.
[4] LASTAS A,GRAZIENE V,BARKAUSKAS E,et al.Carotid artery atherosclerotic plaque:clinicaland morphologicalimmuno-histo chemical correlation[J].Med Sci Monit,2004,56(10):606-614.
[5] OMI H,OKAYAMA N,SHIMIZU M,et al.Statins inhibit high glucose-mediated neutrophil-endothelial cell adhesion through decreasing surface expression of endothelial adhesion molecules by stimulating production of endothelial nitric oxide[J]. Microvasc Res,2003,65(2):118-124.
[6] KLAS S,RAINIER DK,SARA GR,et al.Infection with human cytomegalovirus alters the MMP-9/TIMP-1 balance in human[J].Macrophage J Virology,2009,83(12):830-835.
[7] THE TH,VAN DEN BERG AP,HAVMSEN MC,et al.The cytomegalovirus antigenemia assey:a plea for standardization[J]. Scand J Infect Dis Suppl,1995,99:25-29.
[8] ALTANNAVCH TS,ROUBALOVA K,KUCERA P,et al.Effect of human cytomegalovirus and glucose on adhesion molecules expression in cultured human endothelial cells[J].Acta Virol,2002,46(3):183-186.
[9] MANUEL MR,DAVID G,URSULA M,et al.Proteomics,metabolomics,and immunomics on microparticles derived from human atherosclerotic plaques[J].Cardiovasc Genetics,2009,36(2):379-388.
[10] STOU G,J ANDER S,SITZER M,et al.Unstable carotid stenosis:an inflammatory disease[J].Nervenarzt,2000,71(12):955-962.
[11] CONTI CR.Updated pathophysiologicconceptsin unstable coronary artery disease[J].Am Heart J,2001,141(2):12-14.
(本文编辑:刘斯静)
A STUDY ON THE HCMV AND MPO IN ISCHEMIC CEREBROVASCULAR DISEASE PATIENTS WITH DIFFERENT TYPE OF ATHEROSCLEROTIC PLAQUES
KONG Weili1,GU Juxian2,HE Junying2*,GAO Yulin2
(1.Department of Neurology,the People′s Hospital of Dingzhou City,Hebei Province,Dingzhou 071500,China
2.Department of Neurology,the Second Hospital of Hebei Medical University,Shijiazhuang 050000,China)
Objective Tostudytherelationship between thetypeofcarotid artery artherosclerotic plaque,activated infection of human cytomegalovirus(HCMV)and marrow peroxide(MPO).MethodsThe investigation subjects were 84 selected patients which was complied with the conditions,all of the patients conduct ultrasound of arteria carotid,HCMV-PP65 of peripheral blood leucocyte and MPO were examined in all the patients.The differences of HCMV-PP65,MPO in the patients with different kinds of plaques were compared,furthermore the differences of MPO between PP65 positive and negative paitents were compared.ResultsDifferent plaques had different HCMV-PP65 postive rate,in the instable plaques was 56.76%,it was obviously higher than the stable ones(30. 30%).The average contents of MPO were(132.63±5.44)μg/L in HCMV-PP65 positive group and(92.55±5.39)μg/L in negtive one.The average content of MPO in plaque group was(112.09±9.13)μg/L,with(87.32±8.29)μg/L in no-plaque group.The average content of MPO in instable-plaque group was(146.91±9.56)μg/mL,with(73.04±9.92)μg/L in stable-plaque group.In the positive cases,the average content of MPO in plaque group was(138.34±13.55)μg/L,with(92.53±1.76)μg/L in no-plaque group.The average content of MPO in instable-plaque group was(170.50± 11.36)μg/L,with(93.32±2.67)μg/L in stable-plaque group,all above of the differences were statistically significant(P<0.05).ConclusionThe HCMV-PP65 postive rate in the instable plaques is obviously higher than the stable ones and the HCMV active infection plays an important role in the atherosclerosis(AS),HCMV active infection may promote the expression of MPO,and there is a tendency to promote plaque instability.There are correlations among HCMV,MPO and AS.
atherosclerosis;carotid stenosis;peroxidase
R743
A
1007-3205(2012)09-1004-04
2011-11-10;
2012-04-15
河北省科技厅重点攻关项目(032761990)
孔伟丽(1977-),女,河北博野人,河北省定州市人民医院主治医师,医学硕士,从事脑血管病疾病及中枢神经系统感染性疾病诊治研究。
*通讯作者。E-mail:hejunyingqqq@yahoo.com.cn
10.3969/j.issn.1007-3205.2012.09.005

