GST-π、NQO1在子宫内膜癌组织中的表达及意义
石 莉,高秀泽,李 利
(1.河北省保定恒兴中西医结合医院妇产科,河北保定 071050;,2.河北省保定恒兴中西医结合医院麻醉科,河北保定 071050;3.河北医科大学第四医院妇产科,河北石家庄 050011)
·论 著·
GST-π、NQO1在子宫内膜癌组织中的表达及意义
石 莉1,高秀泽2,李 利3*
(1.河北省保定恒兴中西医结合医院妇产科,河北保定 071050;,2.河北省保定恒兴中西医结合医院麻醉科,河北保定 071050;3.河北医科大学第四医院妇产科,河北石家庄 050011)
目的探讨谷胱甘肽S-转移酶(glutathione-S-transferase,GST-π)、醌氧化还原酶1(quinone oxidoreductase1,NQO1)在子宫内膜癌中的表达和意义。方法采用免疫组织化学方法检测32例子宫内膜腺癌组织和40例正常子宫内膜组织GST-π、NQO1的表达情况。结果GST-π和NQO1在子宫内膜癌组织中的表达明显高于正常子宫内膜组织,差异有统计学意义(P<0.05)。NQO1在Ⅲ期子宫内膜癌中的表达明显高于Ⅰ期,差异有统计学意义(P<0.05)。结论GST-π、NQO1与子宫内膜癌的发生密切相关;检测NQO1可作为判断晚期子宫内膜癌预后的指标。
子宫内膜肿瘤;谷胱甘肽转移酶;氧化还原酶类
子宫内膜癌是女性生殖道三大恶性肿瘤之一,在我国发病率居妇科恶性肿瘤的第2位[1]。雌激素的代谢产物儿茶酚雌激素及苯醌,可以直接导致机体DNA的损伤和突变的发生。谷胱甘肽S-转移酶(glutathione-S-transferase,GST-π)可以阻断醌类化合物导致的DNA损伤和突变[2]。醌氧化还原酶1(quinone oxidoreductase1,NQO1)可催化醌双电子还原反应过程,对醌及其衍生物有解毒功能[3],因此GST-π、NQO1可能与子宫内膜癌发生发展有密切关系。本研究采用免疫组织化学方法检测GST-π、NQO1在子宫内膜腺癌及正常子宫内膜组织中的表达水平,从而探讨二者与子宫内膜癌的关系。
1 资料与方法
1.1 一般资料:选择2009—2010年河北医科大学第四医院妇产科手术的患者标本。病例组,子宫内膜腺癌组织32例。年龄35~73岁,平均(49.97± 9.75)岁。按国际妇产科协会妇科肿瘤分期,其中Ⅰ期14例,Ⅱ期9例,Ⅲ期9例;根据肿瘤的浸润程度分组,侵及浅肌层25例,侵及深肌层7例。对照组,同期收治的子宫肌瘤、子宫腺肌症患者的正常子宫内膜40例,年龄33~55岁,平均(41.96±8.56)岁。所有病例均有明确的组织病理学诊断,临床资料齐全。2组年龄差异无统计学意义(P>0.05)。
1.2 实验方法:采用二步法进行染色。组织蜡块以3μm切片,放置60℃烤箱1h;二甲苯脱蜡,梯度酒精水化,蒸馏水冲洗;3%过氧化氢室温浸泡15min,蒸馏水冲洗。采用EGTA抗原修复液(pH值9.0)、高压锅修复喷气计时2.5min;自然冷却至室温,滴加一抗(GST-π 1∶200,NQO1 1∶200,中杉金桥公司工作液),4℃冰箱过夜。TBS冲洗3次,滴加二抗(通用型)37℃20min,TBS冲洗3次,显微镜控制下DAB显色,适时镜下终止,自来水冲洗。苏木素复染细胞核90s,1%盐酸酒精分化数秒、返蓝、梯度酒精脱水、二甲苯透明、中性树胶封片。
1.3 阳性结果的判断:GST-π、NQO1蛋白的表达形式均以细胞质中出现棕黄色颗粒为阳性细胞,每张切片于镜下(×400)随机观察5个视野。采用定量分析法,用Media Cybernetics软件分析得出每个视野的面积均值,平均光密度,计算出5个高倍视野数值的平均数,即得到该样本的面积均值,平均光密度。因此,免疫组织化学的切片着色强度越高以及着色面积越大,计算出的数值就越高。
1.4 统计学方法:应用SPSS13.0软件包进行数据分析,计量资料以±s表示,分别采用t检验、F检验及q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 GST-π、NQO1表达量的比较:病例组GST-π、NQO1的表达明显强于对照组(P<0.05),见表1。
表1 GST-π、NQO1在正常子宫内膜组织及子宫内膜癌中表达水平的比较Table 1 ComParison of GST-π and NQO1 Protein exPression levels in cases and controls(±s)
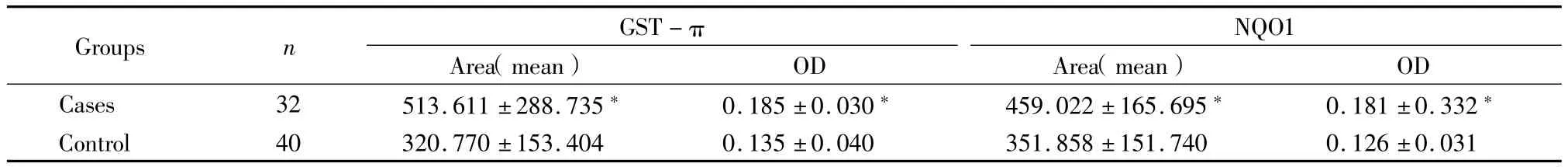
表1 GST-π、NQO1在正常子宫内膜组织及子宫内膜癌中表达水平的比较Table 1 ComParison of GST-π and NQO1 Protein exPression levels in cases and controls(±s)
*P<0.05 vs control by t test
OD Cases 32 513.611±288.735* 0.185±0.030* 459.022±165.695* 0.181±0.332 Groups n GST-π Area(mean)OD NQO1 Area(mean)* 858±151.740 0.126±0.031 Control 40 320.770±153.404 0.135±0.040 351.
2.2 GST-π、NQO1表达量与子宫内膜癌肌层浸润程度及分期的关系:子宫内膜癌组肌层浸润分为深肌层和浅肌层浸润组。2组中GST-π、NQO1表达量差异无统计学意义(P=0.287、0.433)。子宫内膜癌组包括Ⅰ期、Ⅱ期及Ⅲ期患者。Ⅰ~Ⅲ期中GST-π表达量差异无统计学意义(P=0.479)。而Ⅰ~Ⅲ期中NQO1表达量差异有统计学意义(P= 0.011);进一步分析,Ⅰ期、Ⅱ期比较及Ⅰ期、Ⅲ期比较差异均有统计学意义(P=0.011、0.002),Ⅱ期、Ⅲ期比较差异无统计学意义(P=0.539)。见表2。
表2 GST-π、NQO1表达与子宫内膜癌分期的关系Table 2 ComParison of GST-π and NQO1 Protein exPression levels in different clinical stages(±s)
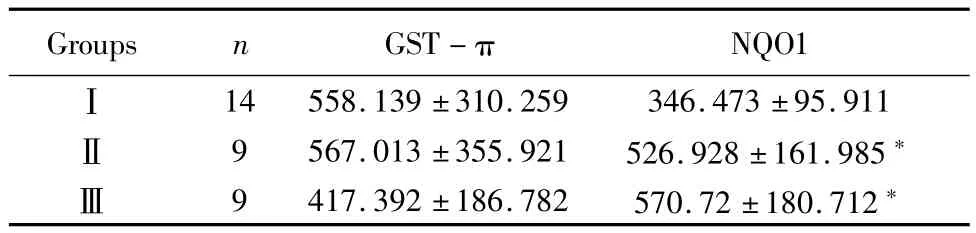
表2 GST-π、NQO1表达与子宫内膜癌分期的关系Table 2 ComParison of GST-π and NQO1 Protein exPression levels in different clinical stages(±s)
*P<0.05 vs groupⅠ by q test
Groups n GST-πNQO1Ⅰ14 558.139±310.259 346.473±95.911Ⅱ 9 567.013±355.921 526.928±161.985*Ⅲ 9 417.392±186.782 570.72±180.712*
3 讨 论
雌激素是致遗传改变和致癌的危险因素,在子宫内膜癌的病因学上起重要作用。长期持续的无孕激素拮抗的雌激素暴露是子宫内膜癌的病因之一。然而随着对雌激素研究的深入,人们逐渐发现雌激素的代谢产物与肿瘤的发生和发展有着更为紧密的关系。雌激素的代谢产物——儿茶酚雌激素可被进一步代谢为半醌及醌类物质,可直接引起机体DNA的损伤和突变,从而诱发癌症的发生。同时,机体内存在着对抗机制,儿茶酚雌激素可通过解毒作用、氧化作用、甲基化作用、硫酸化作用和葡萄糖苷化作用等过程而失活和排泄。在这个过程中,GSTs和NQO1发挥着重要的作用。
GSTs是一组具有多种生理功能的超基因家族酶系,它可以催化机体内谷胱甘肽与有害的极性化合物相结合,还可由非酶结合的方式将机体内各种具有潜在毒性的化学药物、染料等致癌剂以及亲脂性化合物从机体内排出,从而参与体内抗氧化和保护细胞内许多物质合成、储存和转运的过程[4]。目前,GSTs与癌变的关系已经成为肿瘤酶学研究的热点之一。GST-π在人体的许多种肿瘤组织中均有不同程度的表达。
在许多肿瘤细胞和癌变形成过程中GST-π的表达会异常升高,特别是在一些化学致癌剂(如氯乙醚、砷等)诱发肺癌癌前病变中。因此,GST-π是一个典型的肺癌癌前病变标志酶。GST-π的表达不仅仅早于细胞形态的变化,而且还与肿瘤分化程度有关系,这为GST-π作为肿瘤和癌前病变的标志提供了重要的依据。本研究中,病例组GST-π表达强于对照组的表达,但GST-π表达与子宫内膜癌的病理分期及肌层浸润程度无明显相关。说明GST-π的表达增高在病变的早期发挥作用,即外源性诱导剂或者损伤性刺激引起细胞内GST-π的异常表达,从而参与对细胞的保护,维持细胞的正常功能。
苯醌NQO1可催化醌的双电子还原反应,对醌类物质及其衍生物具有解毒的作用,由此可见,NQO1代谢酶的活性成为致癌物在体内解毒过程中的关键物质。NQO1具有催化无单电子还原产物半醌及自由基等氧化产物形成的特性,从而避免了对细胞的损伤。它以还原型辅酶Ⅱ作为受体,参与将还原型辅酶Ⅱ或还原型辅酶Ⅰ的电子传递给醌类及其衍生物,发生双电子还原反应后,再生成低毒的氢醌类化合物,降低了具有致癌性和致畸性的醌类化合物对机体的危害[5]。NQO1与其他Ⅰ、Ⅱ相代谢酶一起构成了人体内对外源性致癌物质的代谢网络,在机体的解毒代谢中发挥着非常重要的作用。
NQO1在人体各组织器官中的分布非常广泛,但以肝脏、肾脏、胃肠道分布最高[6]。NQO1抑制肿瘤发生的内在机制可能为:①NQO1是一种黄素酶,它催化醌还原为亲电子的水溶性醌的过程,避免了亲核性醌损伤DNA。②转染并表达NQO1活性的乳腺癌系MCF-7细胞在肿瘤坏死因子-α作用下凋亡的敏感性明显增加,此过程可能与NQO1增加了呼吸链的电子流量,增加肿瘤坏死因子-α的凋亡效应产物的生成有关。③NQO1对P53蛋白稳定性具有调节的作用,特别是当细胞处于氧化应激状态的时候,这种对P53蛋白的稳定作用就显得更为突出,因此它能使受损的细胞及时的停止生长并进行修复或调节发生凋亡[7]。本研究通过检测NQO1在子宫内膜癌组织中的含量,探讨其与子宫内膜癌的关系。NQO1在子宫内膜癌组织中为高表达,而在正常子宫内膜组织中为低表达,表明NQO1在子宫内膜癌的发生过程中可能起到重要的作用,但是未发现其表达的高低与肌层浸润的程度有明显关系。再进一步将病例组分为Ⅰ期Ⅱ期和Ⅲ期后,Ⅲ期组有高于Ⅱ期组的趋势,但Ⅱ期和Ⅲ期组之间比较差异无统计学意义。NQO1在Ⅲ期子宫内膜癌中的表达明显高于Ⅰ期子宫内膜癌,提示NQO1可能成为判断晚期子宫内膜癌的指标。
目前有文献报道,在许多肿瘤细胞如肺癌、肝癌和乳腺癌细胞中也都发现NQO1的表达比正常组织高[8]。这也提示了该酶在肿瘤的发展和初发时细胞的防御机制中有重要的作用。但NQO1增高的具体原因,尚需进一步研究证实。
总之,子宫内膜癌是一组由环境和遗传因素共同影响的多基因遗传病。它代表了个体的先天性对毒素作用的反应水平及雌激素代谢的暴露水平,这可解释不同个体间发生与环境毒素及雌激素代谢相关肿瘤几率的差异性。本研究发现NQO1、GST-π的高表达与子宫内膜癌发生密切相关,为进一步阐明其发病机制,提供了理论基础。
[1] KELLERT IM,BOTTERWECK AA,HUVENEERS JA,et al. Trends in incidence of and mortality from uterine and ovarian cancer in Mid and South Limburg,The Netherlands,1986-2003[J].Eur J Cancer Prev,2009,18(1):85-89.
[2] CAVALIERI E,CHAKRAVARTI D,GUTTENPLAN J,et al Catechol estrogen quinones as initiators of breast and other human cancers:implications for biomarkers of susceptibility and cancer prevention[J].Biochim Biophys Acta,2006,1766(1):63-78.
[3] WARHOLM M,GUTHENBERGC,MANNERVKB,etal. Purification of anew glutathione s-transferase(transferase)from human liver having high activity with benzo(α)pyrene-4,5-oxide[J].Biochem Biophys Res Commun,1998,98(5):512.
[4] MCGLYNN KA,ROSUOLD EA,LUSTBADER ED,etal. Susceptibility tohepatocellular carcinoma is associated with genetic variation in theenzymatic detoxification of aflatoxin B1[J].Proc Natl Acad Sci USA,2005,92(21):2389.
[5] DINKOVA-KOSTOVA AT,TALALAY P.Persuasive evidence that quinine reductase type 1(DT diaphorase)protects cells against the toxicity ofelectrophiles and reactive forms of oxygen[J].Free Radic Bio Med,2007,29(3/4):231-240.
[6] JAISWAL AK,MCBRIDE OW,ADESNIK M,et al.Human dioxin- induciblecytosolic NAD( P) H: menadione oxidoreductase.cDNA sequence andlocalization ofgene to chromosome 16[J].J Biol Chem,1988,263(27):13572-13578.
[7] KUEHL BL,PATERSON JW,PEACOCK JW.Presence of a heterozygous substitution and its relationship to DT-diaphorase activity[J].Br J Cancer,1995,72(3):555-561.
[8] 代恩勇,卢振霞,史洁坪,等.NQO1基因多态性与大肠癌遗传易感性[J].中国肿瘤临床,2004,31(5):90-91.
(本文编辑:赵丽洁)
EXPRESSION OF GST-π AND NQO1 IN ENDOMETRIAL CANCER AND THEIR CLINICAL SIGNIFICANCE
SHI Li1,GAO Xiuze2,LI Li3*
(1.Department of Obstetrics and Gynecology,Baoding Hengxing Hospital of Traditional Chinese and Western Medicine,Baoding 071051,China;2.Department of Anesthesiology,Baoding Hengxing Hospital of Tradition Chinese and Western Medicine,Baoding 071051,China;3.Department of Obstetrics and Gynecology,the Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China)
ObjectiveTo investigate the expression of glutathione-S-transferase(GST-π)and quinone oxidoreductase1(NQO1)in endometrial cancer tissues and their clinical significance.MethodsThe immunohistochemical method was used to determine the expression of GST-π and NQO1 in 32 endometrial cancer tissues and 40 normal uterine endometrial tissue.ResultsThe expression of GST-π and NQO1 in endometrial cancer tissues were significantly higher than those in normal uterine endometrial tissue.NQO1 expression in stage III endometrial cancer was significantly higher than that of stage I(P=0.002).ConclusionExpression of GST-π and NQO1 is closely related to the endometrial cancer.And the expression of NQO1 could be a good prognostic factor of endometrial cancer.
endometrial neoplasms;glutathione transferase;oxidoreductases
R737.33
A
1007-3205(2012)09-1015-03
2012-02-17;
2012-06-12
河北省自然科学基金资助项目(C2006000857)
石莉(1972-),女,河北衡水人,河北省保定恒兴中西医结合医院主治医师,医学硕士,从事妇科疾病诊治研究。
*通讯作者。E-mail:gaoxiuze@126.com
10.3969/j.issn.1007-3205.2012.09.009

