抑制Cyclin D1基因对K562细胞生长和VP16敏感性的影响
王 一,连小云,张 玎,王歧山
(陕西省人民医院血液科,陕西西安 710068)
·论 著·
抑制Cyclin D1基因对K562细胞生长和VP16敏感性的影响
王 一,连小云,张 玎,王歧山
(陕西省人民医院血液科,陕西西安 710068)
目的应用RNA干扰技术(RNA interference,RNAi),构建针对细胞周期素D1(Cyclin D1)的RNAi,并检测其对K562细胞增殖和对化疗药物敏感性的影响。方法采用针对Cyclin D1的RNAi质粒载体转染K562细胞,用反转录-聚合酶链反应和Western blot法检测Cyclin D1RNAi后mRNA和蛋白水平的表达;用MTT实验测定细胞的增殖;流式细胞术测定细胞周期和凋亡。结果针对Cyclin D1 RNAi转染白血病K562细胞后,可以明显降低白血病K562细胞中Cyclin D1的mRNA和蛋白的表达,明显抑制K562细胞的增殖,提高化疗药物Vp16诱导的细胞凋亡。结论利用RNAi抑制Cyclin D1可抑制白血病K562细胞增殖,提高对化疗药物Vp16的敏感性。
白血病;RNA干扰;细胞凋亡
细胞周期素D1(Cyclin D1)为调节细胞增殖的重要分子,在调节细胞周期的过程中起重要作用,Cyclin D1分子在正常细胞中表达很低,不易被检测。Cyclin D1在多种肿瘤细胞中表达为预后不良的独立因素,提示Cyclin D1的表达可能与肿瘤的发生密切相关,Cyclin D1基因有可能成为肿瘤治疗的靶点[1-4]。而 RNA干扰技术(RNA interference,RNAi)因为其对靶基因的特异性抑制作用而受到关注。本研究采用RNAi技术研究抑制K562白血病细胞中Cyclin D1的表达对其增殖、细胞周期等的影响,探讨Cyclin D1影响白血病细胞增殖的机制。
1 材料与方法
1.1 细胞株及其培养:髓系白血病K562细胞株为本科实验室保存。将细胞从液氮中复苏后,用含10%小牛血清的 RPMI1640培养基,在37℃,5%CO2及饱和湿度条件下进行培养,至细胞处于对数生长期时,进行后续实验。
1.2 试剂与溶液:已经构建成功的对Cyclin D1起抑制作用的含U6启动子的干扰质粒PGE-Cyclin D1载体以及阴性载体,反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂(promega公司),兔抗人-Cyclin D1一抗、兔抗兔-HRP二抗均为santa cruz产品。氨苄青霉素(上海生物工程公司)、G418(Sigma)、Vp16(Sigma)。
1.3 转染和阳性克隆的筛选:按照MERCK公司Genejammer(R)Transferction Reagent DMRIEReagent脂质体产品说明书中转染贴壁细胞方法稍作改动。将转染36h后的K562细胞培养,加入浓度递增的G418进行阳性克隆的筛选。并将阳性克隆进行增殖待用。
1.4 RT-PCR:按Trizol试剂盒(GIBCOBRL)说明,收集细胞,用PBS洗涤后,提取总RNA。取2μg总 RNA,引物 Oligdt(17)(GIBCOBRL)应用 Super ScripⅡ试剂盒(GIBCOBRL)按说明逆转录成cDNA(20μL体系)。根据GeneBank已知序列,设计引物Cyclin D1 上 游 引 物 5′ -CCCTCGGTGTCCTACTTCAA-3’下游引物 5′-GTGTTCAATGAAATCGTGCG-3′(扩增片段长度为726bp); β - actin 上 游 引 物 5′ -CCAGGCACCAGGGCGTGATG-3′,下游引物为5′-CTCCTTAATGTCACGCACGATTC-3′(扩增片段长度为436bp)。PCR反应系统为50μL体系(cDNA 2μL,引物浓度400nmol/L,Taq酶1U),反应条件为,94℃ 5min,94℃变性1min,72℃延伸1min,βactin的退火温度为63℃,而Cyclin D1的退火温度为64.5℃退火45s,共进行35个循环,最后在72℃延伸5min。取5μL PCR产物进行1.5%琼脂糖电泳,紫外照像。
1.5 Western blot:分析Cyclin D1,β-actin蛋白的表达,收集细胞,离心并用PBS洗涤后加入100μL RIPA细胞裂解液和cock-tail蛋白酶抑制剂,离心去除细胞碎片后,用BCA法测定蛋白浓度,加入5× SDS buffer,煮沸5min,在10%SDS-聚丙烯凝胶中每孔加入总蛋白为 50μg样品,电泳后,转移至PVDF膜,5%脱脂奶封闭过夜,分别加入兔抗人-Cyclin D1多抗和鼠抗人-β-actin单抗,印迹产物相对分子质量分别为34 000、43 000,4℃过夜,再分别与相应的二抗室温反应1h后,化学发光底物显色。
1.6 细胞生长曲线和增殖抑制实验:将G418筛选的阳性细胞种于12孔板中,于培养后0、3、6、9、12d收集细胞,用台盼蓝拒染实验计数活细胞,描绘生长曲线,并将G418筛选的阳性细胞种于96孔板中,加入不同浓度的 Vp16培养 48、72h,加入 MTT(5g/L)继续培养4h后,去除上清,加入100μL/孔DMSO充分混匀后在570nm和650nm测吸光度值,再按照 Bliss法计算程序,求出半数抑制浓度(IC50)。
1.7 流式细胞仪测定细胞周期:收集待测细胞,PBS洗涤后,70%预冷乙醇固定过夜。PBS洗涤后,加入PI/RNase(10mg·L-1/0.2g·L-1)避光30min后,在流式细胞仪上用488nm激发光检测DNA含量,并用BD lysis software(Becton-Dickinson)软件分析细胞周期。
1.8 流式细胞仪测定细胞凋亡率:将细胞收集离心,PBS洗涤,孵育液 100μL,重悬细胞;加入Annexin-V-FITC标记的抗体10μL,避光孵育15min;加入5μL(50mg/L)PI,再避光10min后,用孵育液洗去多余抗体和 PI,1h内上机检测,Annexin-V-FITC+/PI-的细胞为凋亡细胞。
1.9 统计学方法:应用SPSS16.0软件包进行分析,计量资料以±s表示,组间比较采用t检验,组内两两比较,采用q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 稳定转染PGE-siRNA CD1对K562细胞Cyclin D1mRNA和蛋白水平的影响:本研究结果显示PGE-siRNACD1稳定转染到K562细胞,可在mRNA和蛋白水平上明显抑制K562细胞中Cyclin D1的表达,见图1,2。
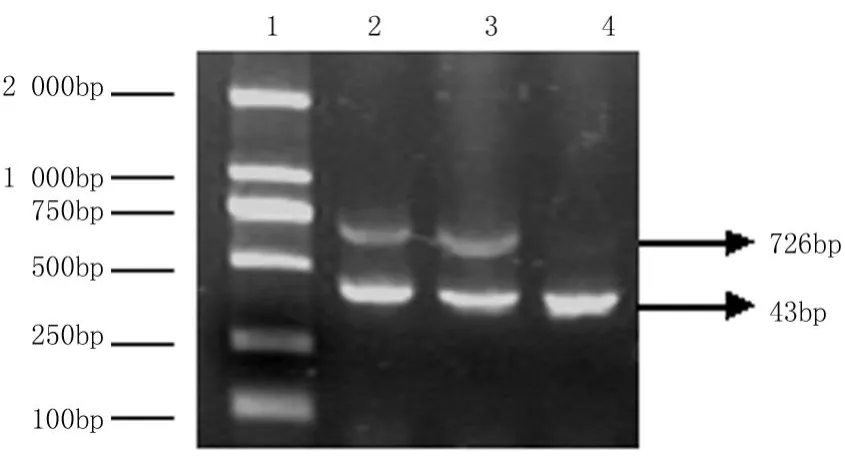
图1 PGE-siRNA Cyclin D1稳定转染对K562细胞Cyclin D1mRNA表达的影响1.DNA marker;2.未转染;3.转染 PGE-siRNA;4.转染 PGE-siRNACyclin D1Figure 1 Expression of Cyclin D1 mRNA in K562 cells stably transfeeted with transfection PGE-siRNA Cyclin D1A.DNA marker;2.Not transfection;3.Transfection by PGE-siRNA;4. Transfection by PGE-siRNA Cyclin D1

图2 PGE-siRNA Cyclin D1稳定转染对K562细胞Cyclin D1蛋白表达的影响1.DNA marker;2.未转染;3.转染PGE-siRNA;4.转染PGE-siRNA Cyclin D1Figure 2 Protein expression of Cyclin D1 in K562 cells stably transfeeted with transfection PGE-siRNA Cyclin D11.Not transfection;2.Transfection by PGE-siRNA;3.Transfection by PGE-siRNA Cyclin D1
2.2 PGE-siRNA Cyclin D1转染对K562细胞周期的影响:与野生型K562细胞和转染PGE-siRNA(PGE中含阴性片段质粒)相比较,PGE-siRNA Cyclin D1转染后明显增加G1期细胞,减少S期细胞。PGE-siRNA Cyclin D1转染后并不能增加K562细胞的凋亡,见表1。
表1 PGE-siRNA Cyclin D1对K562细胞细胞周期的影响作用Table 1 Effect of PEG-siRNA Cyclin D1 on cell cycle of K562 cells(±s)
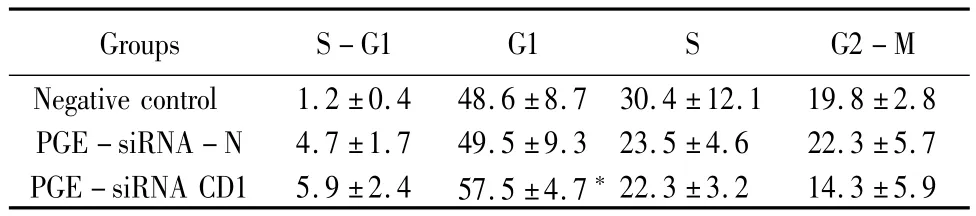
表1 PGE-siRNA Cyclin D1对K562细胞细胞周期的影响作用Table 1 Effect of PEG-siRNA Cyclin D1 on cell cycle of K562 cells(±s)
*P<0.05 vs negative control by q test
Groups S-G1 G1 S G2-M Negative control 1.2±0.4 48.6±8.7 30.4±12. 22.3±3.2 14.3±5.9 1 19.8±2.8 PGE-siRNA-N 4.7±1.7 49.5±9.3 23.5±4.6 22.3±5.7 PGE-siRNA CD1 5.9±2.4 57.5±4.7*
2.3 稳定转染PGE-siRNA Cyclin D1K562细胞生长的影响:600mg/L G418的培养液筛选出来的阳性K562细胞调节为2×105/mL培养于6孔板,分别于3、6、9、12d,用苔盼蓝拒染法计数活细胞数,实验重复2次,取平均值描绘生长曲线。结果提示PGE-siRNA Cyclin D1稳定转染于K562细胞,与转染含阴性片段的细胞相比较,PGE-siRNA Cyclin D1可明显抑制K562细胞的生长。细胞培养12d后,与阴性对照比较,对K562细胞的抑制率为(57.36± 7.67)%,见图3。
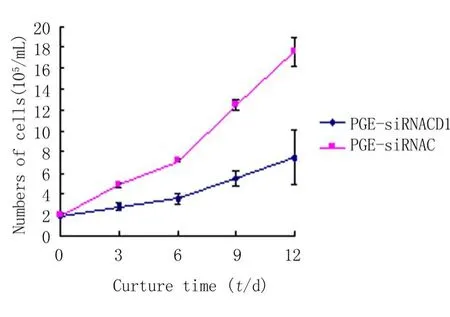
图3 PGE-siRNA Cyclin D1对K562细胞生长的影响Figure 3 Effect of PGE-siRNA Cyclin D1 on the proliferation of K562 cells
2.4 稳定转染PGE-siRNA Cyclin D1K562细胞对化疗药物Vp16敏感性和凋亡率的影响:用MTT法检测Vp16对稳定转染 PGE-1-Cyclin D1和PGE-1-Neo的K562细胞48、72h的IC50值结果显示PGE-siRNACyclin D1稳定转染于K562细胞后,可以明显降低48、72h的IC50值,见表2。
表2 PGE-siRNA Cyclin D1 K562对Vp16的影响Table 2 Sensitivity of K562 cells transfected with PGE-siRNA Cyclin D1 to VP16(±s)

表2 PGE-siRNA Cyclin D1 K562对Vp16的影响Table 2 Sensitivity of K562 cells transfected with PGE-siRNA Cyclin D1 to VP16(±s)
*P<0.05对照组比较by t test
PGE-siRNACD1 PGE-siRNA IC50(48h)g/L 62.3±4.5 46.7±9.4*空白对照49.3±6.2 58.1±3.5 IC50(72h)g/L 54.1±10.5 39.6±7.21*
用 200mg/L Vp16处理 K562细胞 12h后,PGE-siRNA CD1 K562细胞凋亡率为27.4%,明显高于野生型K562和PGE-siRNA,其细胞凋亡率分别为12.5%和18.2%。见图4。

图4 Vp16对K562细胞凋亡的Annexin-V/PI测定A.野生型K562细胞凋亡率;B.PGE-siRNAneoK562细胞凋亡率;C.PGE-siRNA Cyclin D1K562细胞凋亡率Figure 4 Apoptosis of K562 cells treated by Vp16 detected using Annexin-V/PIA.apoptosis rate in wild K562 cells;B.Apoptosis rate in PGE-siRNAneoK562 cells;C.Apoptosis rate in PGE-siRNA Cyclin D1-K562 cells
3 讨 论
Cyclin D1为作用于G1期的细胞周期蛋白,可与CDK4和(或)CDK6结合形成复合物,与Rb蛋白结合使其活化,使细胞由G1期进入S期,细胞周期缩短,细胞增殖,而正常细胞Cyclin D1的合成具有时效周期,因此,平时很难检测到其表达[2-4]。套细胞淋巴瘤由于在bcl-1断裂点发生染色体易位t(11;14)(q13;q32)使免疫球蛋白重链的增强子转移至CCND1位点,促进了Cyclin D1蛋白合成和过度表达,并成为区别于其他B细胞淋巴瘤的分子学特征。而在乳腺癌、肝癌等实体瘤以及白血病细胞中Cyclin D1过表达,已经成为影响疾病预后的独立因素之一[6-9]。
本研究利用对Cyclin D1表达起明显抑制作用的真核RNA干扰质粒转染K562白血病细胞,结果显示干扰质粒转染K562细胞后可在mRNA和蛋白水平上明显抑制Cyclin D1分子的表达,Cyclin D1表达降低同时,G1期的细胞数量增多,S1期细胞减少,以此相对应的结果是,Cyclin D1表达降低后,K562细胞生长、增殖受到明显抑制。我们的研究结果显示,靶向抑制K562细胞Cyclin D1基因的表达后,可增加K562细胞对常规化疗药物Vp16的敏感性,同时观察到抑制K562细胞中Cyclin D1的表达可以增加Vp16诱导白血病细胞的凋亡。有趣的是,Vp16是一种作用于G2期的抗肿瘤药物,我们的研究发现,K562细胞Cyclin D1表达降低后,G1期细胞比例增加,对G2期的细胞影响不大,提示K562细胞Cyclin D1表达降低增加对Vp16敏感性的原因与细胞周期改变无关,其可能的机制为K562细胞中D1表达降低,G1期细胞增多,细胞进入G2期的数量减少,使Vp16作用的靶细胞相对增多,导致Vp16敏感性增加。
本研究初步观察到利用shRNA靶向抑制K562白血病细胞中Cyclin D1的表达可以明显抑制白血病K562细胞的增殖,并增加其对化疗药物的敏感性。为进一步深入研究Cyclin D1在白血病的发生、发展的作用提供了研究基础,同时也反向证明了Cyclin D1在白血病增殖中的促进作用以及Cyclin D1影响白血病预后的可能原因,揭示以Cyclin D1为抗白血病治疗的靶点,联合化疗可能会对Cyclin D1过表达的白血病患者治疗有益。
不少研究表明Cyclin D1在白血病中表达增高与P27、P57、survivin表达密切相关,可能在这些分子的共同作用之下,导致白血症预后不佳[10-12]。这些研究结果提示,通过RNA干扰方法抑制白血病K562细Cyclin D1表达,也直接或者间接调节了包括P53、P27和survivin等分子的表达,在这些信号分子的共同作用下使白血病细胞的增殖和对化疗药物敏感性发生改变。本研究中仅初步观察 Cyclin D1表达了的下调对白血病K562细胞增殖和对常规化疗药物Vp16敏感性的影响,而Cyclin D1表达下调后是否对其他细胞周期蛋白的表达有无影响需要进一步研究。
[1] 王前,邓晶,蒋永新.Cyclin D1的研究进展[J].现代肿瘤医学,2009,17(2):352-352.
[2] 许宁,朱恩新,王莉红,等.Cyclin D1表达异常与肿瘤的发生及预后[J].中国药物与临床,2008,11(8):840-842.
[3] YAN KX,LIU BC,SHI XL,et al.Role of cyclinD1 and CDK4 in the carcinogenesis induced by silica[J].Biomed Environ Sci,2005,18(5):286-296.
[4] SENGUPTA A,BANERJEE D,CHANDRA S,et al.Deregulation and cross talk among sonic hedgehog,wnt,hox and notch signaling in chronic myeloid leukemia progression[J].Leukemia,2007,21(5):949-955.
[5] UMEKITA Y,OHI Y,SAGARA Y,et al.Overexpression of cyclinD1 predicts for poor prognosis in estrogen receptornegative breast cancer patients[J].Int J Cancer,2002,98(3):415-418.
[6] MASUDA M,SUZUI M,YASUMATU R,et al.Constitutive activation of signal transducers and activators of transcription correlates with cyclin D1 overexpression and may provide a novel prognostic marker in head and neck squamous cell carcinoma[J].Cancer Res,2002,15(62):3351-3359.
[7] 刘壮,韦红英,韩蕴丽,等.细胞外信号调节激酶-1、细胞周期蛋白D 1表达与儿童急性白血病关系研究[J].临床儿科杂志,2005,23(5):286-288.
[8] 李红华,汪月增,楼方定,等.急性白血病患者周期蛋白D1 mRNA表达及其临床意义[J].中华血液学杂志,1999,20(7):357-359.
[9] 吴穗晶,杜欣,陈运贤,等.细胞周期蛋白与急性白血病预后的关系研究[J].癌症,2003,22(8):852-854.
[10] HUI AM,LI X,SHI YZ,et al.Cyclin D1 overexpression is a critical event in gallbladder carcinogenesis and independently predicts decreased survival for patients with gallbladder carcinomal[J].Clin Cancer Res,2000,6(11):4272-4277.
[11] 刘壮,韦红英,韩蕴丽,等.细胞外信号调节激酶-1、细胞周期蛋白D1表达与儿童急性白血病关系研究[J].临床儿科杂志,2005,23(5):286-288.
[12] 王凡平,孙志强,李辰蕊,等.P27kip1和P57kip2与CyclinD1在急性白血病的表达其临床意义[J].临床血液学杂志,2008,21(1):22-24.
(本文编辑:刘斯静)
EFFECT OF Cycline D1 GENE SILENCING ON THE GROWTH OF HUMAN K562 LEUKEMIC CELLS AND THE SENSITIVITY AGAINST VP16
WANG Yi,LIAN Xiaoyun,ZHANG Ding,WANG Qishan
(Department of Hematology,the People′s Hospital of Shanxi Province,Xi′an 710068,China)
ObjectiveTo observe the gene silencing mediated by the specific RNAi targeted against Cyclin D1 and its effect on biological activity of human K562 leukemia cells.MethodsRNAi plasmid vectors against Cyclin D1 were transfected into K562 leukemia cells.Cell activation was analysed by trypan blue reject test and cell proliferation inhibitions were determined by MTT assay.Cyclin D1 expressions were detected by reverse transcription-polymerase chain reaction(RT-PCR)and western blot analysis.Cell cycle distribution and apoptosis was examined by flow cytometry.ResultsThe RNAi vector targeted against Cyclin D1 efficiently suppressed Cyclin D1 expression at mRNA and protein levels.The RNAi-mediated gene silencing of Cyclin D1 resulted in significant inhibition of cell. Moreover,the cancer cells showed significant increased ratio of G1 phase,decreased ratio of S phase,and increased apoptosis induced by Vp16.ConclusionThe specific RNAi targeted against Cyclin D1 could inhibit cell growth and increase sensitivity against Vp16 in K562 leukemia cells.
RNA interference;leukemia;apoptosis
R733.71
A
1007-3205(2012)09-1008-04
2011-09-07;
2012-03-07
王一(1971-),女,四川资中人,陕西省人民医院副主任医师,医学博士,从事血液系统疾病诊治研究。
10.3969/j.issn.1007-3205.2012.09.006

