替吉奥与氟尿嘧啶治疗中晚期消化道肿瘤疗效的系统评价
胡学军,王尚前,邵国安,张 虎,刘贵峰
进展期胃癌 (advanced gastric cancer,AGC)和转移性大肠癌 (metastatic colorectal Cancer,MCC)属中晚期消化道肿瘤,难以行根治性手术治疗,只能姑息性切除以缓解临床症状,全身化疗是其主要的治疗方法。目前治疗消化道恶性肿瘤的化疗药物主要分为4大类:氟尿嘧啶、铂类、拓扑异构酶抑制剂及紫杉类。2010版NCCN指南 (美国国家综合癌症网)肯定了上述4类药物为基础的化疗方案在晚期消化道恶性肿瘤的疗效,目前5-氟尿嘧啶 (5-FU)依然是治疗AGC和MCC的基础用药,且NCCN专家共识认为5-FU灌注的毒性较推注者轻。替吉奥 (S-1)是日本1999年研制成功并在当年则被批准用于治疗AGC的一种以氟尿嘧啶为基础的新型口服用药,由替加氟 (Tegafur,FT)、吉美嘧啶 (Gimeracil,CDHP)、奥替拉西钾 (Oteracil,Oxo)按1∶0.4∶1摩尔比组合而成,自上市以来越来越多的专家对此药的效果进行了较为全面的研究,近年来数篇随机对照试验相继发表[1-8],且大多数是国外的研究,涉及国内的研究仅检索到1篇[4]。但相关系统评价或Meta分析较少,本研究通过系统地收集有关S-1与氟尿嘧啶比较的随机对照研究,分析二者治疗中晚期消化道恶性肿瘤的效果及相关并发症,以进一步评价二者临床应用效果,从循证医学角度指导二者的临床应用。
1 材料与方法
1.1 文献纳入标准 研究类型必须是随机对照试验;研究设计必须满足是S-1与氟尿嘧啶 (包括S-1与氟尿嘧啶单独比较或S-1+其他与氟尿嘧啶+同类药物的对比)或同时包括S-1与氟尿嘧啶治疗中晚期消化道恶性肿瘤的疗效的比较;研究失访率≤20%。
1.2 评价结果 主要结果:总生存期 (6个月,12个月,18个月,24个月,36个月),无病生存期 (6个月,12个月,18个月,24个月,36个月)。次要结果:血液系统并发症(骨髓抑制,贫血,中性粒细胞、白细胞、血小板、血红蛋白减少),消化道症状 (厌食,恶心,腹痛,腹泻,脱水),炎性病变 (口腔黏膜炎,发热),肝肾功能的影响,疲劳,低钾、钠、镁血症,体质量变化,手足和神经症状。
1.3 数据检索 分别对Cochrane CENTRAL-Cochrane Library、MEDLINE(Pubmed)、EMbase、Tompson SCI、VIP(维普数据库)等数据库进行系统检索,所有数据库检索时间截止到2011-06-14。检索词为:S-1;fluorouracil;gastrointestinal cancer;randomized control trials;替吉奥;氟尿嘧啶;胃癌;晚期胃癌;进展期胃癌。
1.4 数据收集和文献评价方法 采用Cochrane提供的最新版的RevMan 5.1.2软件包对整个研究的数据进行整合、Meta分析,对所有入选的文献进行风险评估并列出风险评估表;采用GRADE 3.5.1软件包对所有测量指标进行证据等级的评估,证据等级评价标准:从文献研究的自身局限性 (Limitations)、研究的不一致性 (Inconsistency)、结果指标的间接性 (Indirectness)、研究的不精确性 (Imprecision)、发表偏移 (Publication bias)5个方面行证据质量等级的评价,上述5个方面可因具体的情况进行不降级、降低1个等级、降低2个等级来进行具体评级。二分类资料采用相对危险度 (risk ratio,RR)及95%可信区间 (confidence interval,CI)进行计算,连续性资料采用标准化均数差 (standardized mean difference,SMD)及95%CI进行分析。对所有的测量指标进行异质性检验,采用随机效应模型对所有纳入研究的数据进行分析;在不做特殊说明的情况下以α=0.05作为检验水准。
2 结果
2.1 纳入研究的基本情况共检索到48篇文献,通过评价文题和摘要,共16篇文献符合 S-1治疗消化道肿瘤[1-16],其中检索到全文的共8篇[1-8],涉及S-1与氟尿嘧啶比较的研究共4篇[1-4],均为英文文献,总的参与人数为2 066例。对入选的文献进行质量评价,其中低风险文献1篇[2],中等风险文献3篇[1,3-4],无高风险文献。对总有效率、总生存期、无病生存期主要测量指标进行证据等级评价,均为低级别。
2.2 疗效评价
2.2.1 总有效率 S-1组有效人数为145/476,总有效率为30.46%;氟尿嘧啶组有效人数为137/458,总有效率为29.91%,两组间差异无统计学意义〔RR=1.28,95%CI(0.60,2.72),I2=85%,P=0.52,见图1〕。
2.2.2 总生存率 S-1组6个月、12个月、18个月、24个月、36个月总生存率分别为69.08%、40.16%、15.08%、9.28%、6.84%,对照组分别为67.14%、36.55%、13.52%、6.44%、4.27%;两组24个月总生存率比较,差异有统计学意义〔RR=1.45,95%CI(1.05,2.00),I2=0,P=0.02〕,其他时间总生存率比较,差异均无统计学意义 (P>0.05,见图2)。
2.2.3 无病生存率 S-1组的6个月、12个月、18个月、24个月、36个月无病生存率分别为 31.23%、7.01%、1.73%、1.59%、1.28%,对照组分别为28.93%、6.92%、1.18%、1.21%、1.71%,两组各时间无病生存率比较,差异均无统计学意义 (P>0.05,见图3)。
2.3 并发症发生率评价
2.3.1 贫血发生率 S-1组总体贫血发生率为577/731(78.93%),对照组为508/719(70.65%);3~4级贫血发生率S-1组为 132/807(16.36%),对照组为 123/793(15.51%)。两组总体及3~4级贫血发生率比较,差异均无统计学意义 (P>0.05,见图4)。
2.3.2 中性粒细胞减少发生率 S-1组总体中性粒细胞减少发生率为 452/731(61.83%),对照组为 594/719(82.61%);3~4级中性粒细胞减少发生率S-1组为269/1 041(25.84%),对照组为445/1 025(43.41%)。两组总体中性粒细胞减少发生率比较,差异有统计学意义〔RR=0.75,95%CI(0.70,0.80),I2=0,p<0.00001〕;3~4级中性粒细胞减少发生率比较,差异无统计学意义 (P=0.28,见图5)。
2.3.3 白细胞减少发生率 S-1组总体白细胞减少发生率为438/731(59.92%),对照组为553/719(76.91%);3~4级白细胞减少发生率S-1组为119/807(14.75%),对照组为207/793(26.10%)。两组总体及3~4级白细胞减少发生率比较,差异均无统计学意义 (P>0.05,见图6)。
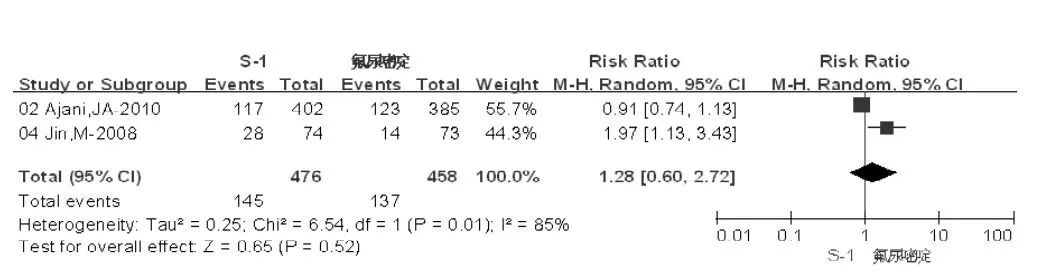
图1 两组总有效率比较Figure 1 Comparison of total effective rates between two groups
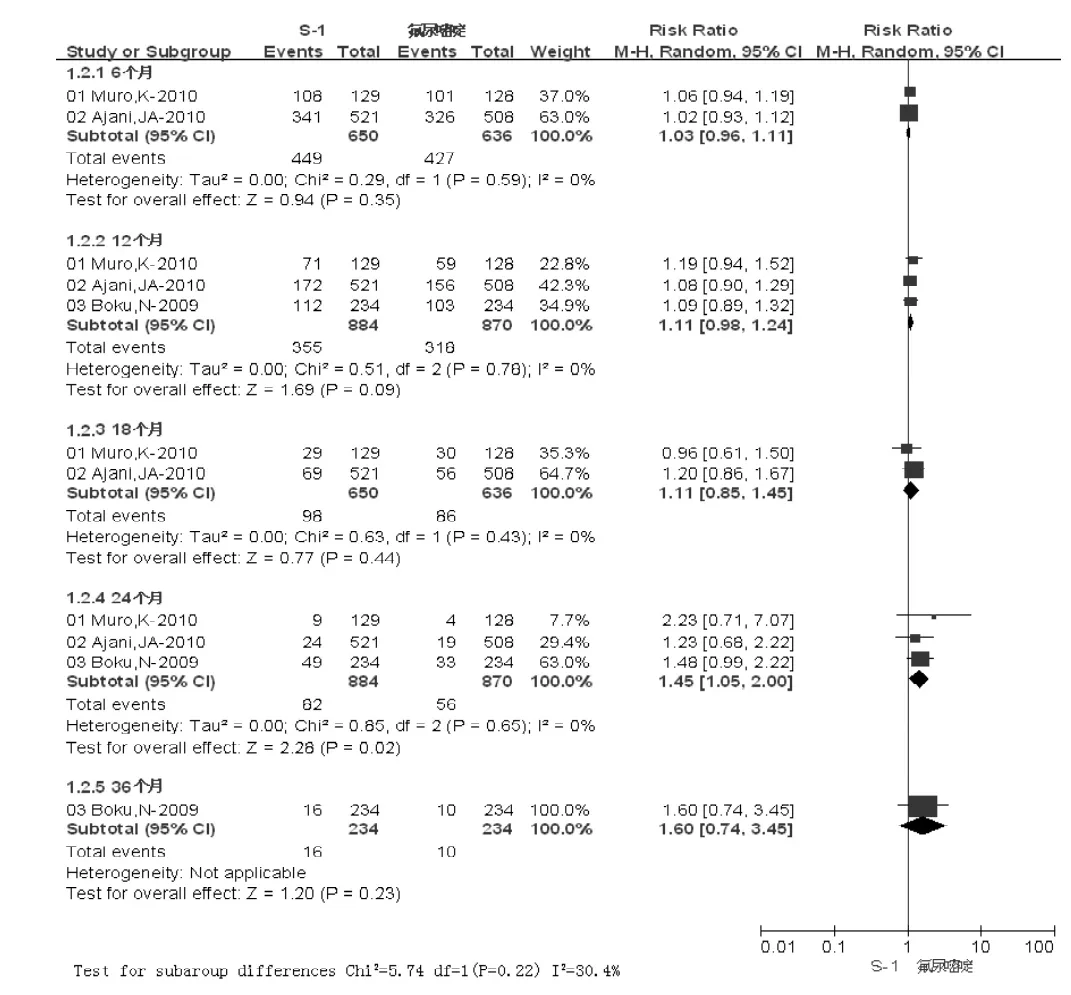
图2 两组总生存率比较Figure 2 Comparison of total survival rates between two groups

图3 两组无病生存率比较Figure 3 Comparison of free survival rates between two groups

图4 两组贫血发生率比较Figure 4 Comparison of anemia rates between two groups

图5 两组中性粒细胞减少发生率比较Figure 5 Comparison of neutropenia rates between two groups
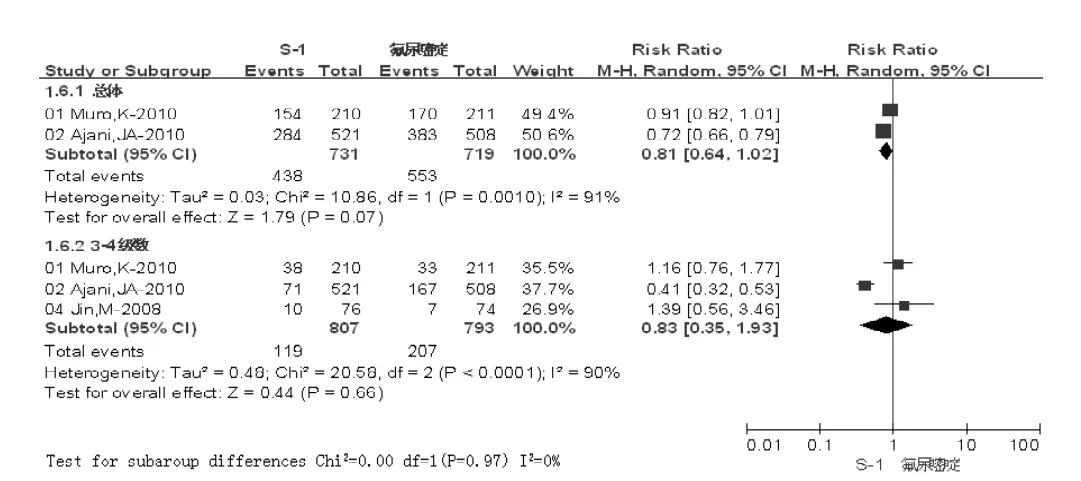
图6 两组白细胞减少发生率比较Figure 6 Comparison of leucopenia rates between two groups
2.3.4 血小板减少发生率 S-1组总体血小板减少发生率为264/731(36.11%),对照组为317/719(44.09%);3~4级血小板减少发生率S-1组为48/807(5.95%),对照组为79/793(9.96%)。两组总体血小板减少发生率比较,差异无统计学意义 (P>0.05);3~4级血小板减少发生率比较,差异有统计学意义〔RR=0.60,95%CI(0.43,0.84),I2=0,P=0.003,见图 7〕。
2.3.5 血红蛋白降低发生率 S-1组血红蛋白降低发生率为38/310(12.26%),对照组为39/306(12.75%),两组血红蛋白降低发生率比较,差异无统计学意义 (P>0.05,见图8)。
2.3.6 口腔黏膜炎发生率 S-1组总体口腔黏膜炎发生率为155/731(21.20%),对照组为398/719(55.35%);3~4级口腔黏膜炎发生率S-1组为21/965(2.18%),对照组为118/951(12.41%)。两组总体及3~4级口腔黏膜炎发生率比较,差异均无统计学意义 (P>0.05,见图9)。
2.3.7 腹泻发生率 S-1组总体腹泻发生率为319/731(43.64%),对照组为320/719(44.51%);3~4级腹泻发生率S-1组为 91/1 041(8.74%),对照组为 34/1 025(3.32%)。两组总体腹泻发生率比较,差异无统计学意义 (P>0.05);3~4级腹泻发生率比较,差异有统计学意义〔RR=3.91,95%CI(1.11,13.85),I2=82%P=0.03,见图10〕。
2.3.8 厌食发生率 S-1组总体厌食发生率为305/731(41.72%),对照组为304/719(42.28%);3~4级厌食发生率S-1组为 83/1 041(7.97%),对照组为 70/1 025(6.83%)。两组总体及3~4级厌食发生率比较,差异均无统计学意义 (P>0.05,见图11)。
2.3.9 恶心发生率 S-1组总体恶心发生率为420/731(57.46%),对照组为453/719(63.00%);3~4级恶心发生率S-1组为 58/1041(5.57%),对照组为 78/1025(7.61%)。两组总体恶心发生率比较,差异有统计学意义〔RR=0.91,95%CI(0.84,0.99),I2=0,P=0.03〕;3~4级恶心发生率比较,差异无统计学意义 (P>0.05,见图12)。
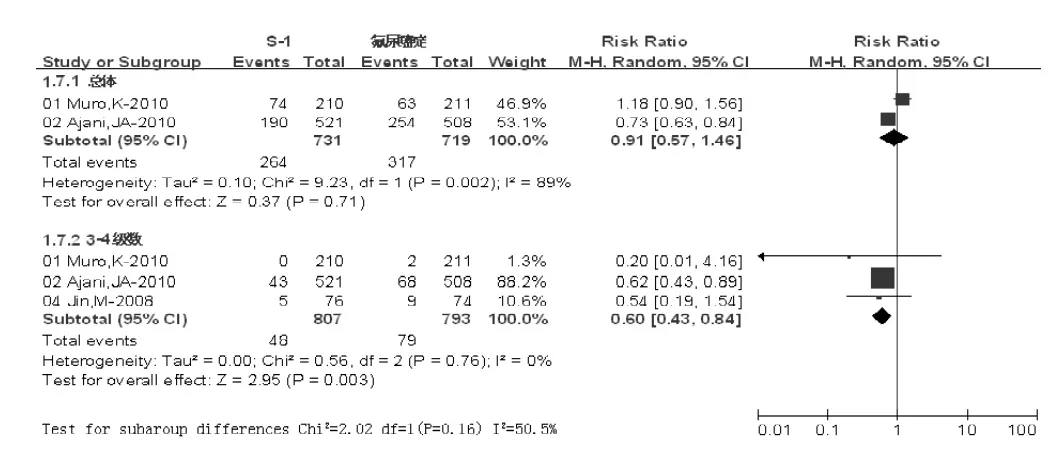
图7 两组血小板减少发生率比较Figure 7 Comparison of thrombocytopenia rates between two groups

图8 两组血红蛋白降低发生率比较Figure 8 Comparison of lower hemoglobin rates between two groups

图9 两组口腔黏膜炎发生率比较Figure 9 Comparison of stomatitis rates between two groups

图10 两组腹泻发生率比较Figure 10 Comparison of diarrhoea rates between two groups

图11 两组厌食发生率比较Figure11 Comparison of anorexia rates between two groups

图12 两组恶心发生率比较Figure 12 Comparison of nausea rates between two groups
2.3.10 疲劳发生率 S-1组总体疲劳发生率为358/731(48.97%),对照组为344/719(47.84%);3~4级疲劳的发生率 S-1组为 94/965(9.74%),对照组为 78/951(8.20%)。两组总体及3~4级疲劳发生率比较,差异均无统计学意义 (P>0.05,见图13)。
2.3.11 肝功能 S-1组胆红素升高发生率为98/755(12.98%),对照组为46/740(6.21%);丙氨酸氨基转移酶(ALT)/天门冬氨酸氨基转移酶 (AST)升高发生率S-1组为30/755(3.97%),对照组为31/740(4.19%)。两组胆红素升高发生率比较,差异有统计学意义〔RR=2.08,95%CI(1.49,2.91),I2=0,p<0.0001〕,ALT/AST升高发生率比较,差异无统计学意义 (P>0.05,见图14)。
2.3.12 肾功能 S-1组肌酐升高发生率为29/755(3.84%),对照组为47/740(6.35%);内生肌酐清除率降低发生率 S-1组为118/521(22.64%),对照组为208/508(40.94%)。两组肌酐升高发生率比较,差异无统计学意义(P>0.05);内生肌酐清除率降低发生率比较,差异有统计学意义 〔RR=0.55,95%CI(0.46,0.67),I2=0,P <0.0001,见图 15〕。
2.3.13 其他 S-1组与对照组在发热、腹痛、脱水、体质量减轻、低钠血症、手足神经症状等方面发生率比较,差异均无统计学意义 (P>0.05);而低钾血症、低磷血症、低镁血症、骨髓抑制等并发症发生率比较,差异均有统计学意义 (p<0.05),提示S-1组出现上述症状较对照组少。
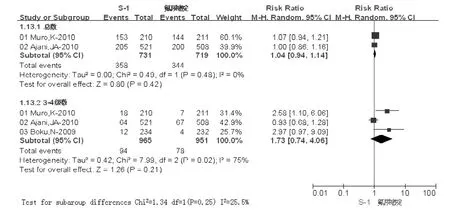
图13 两组疲劳发生率比较Figure 13 Comparison of fatigue rates between two groups

图14 两组肝功能比较Figure 14 Comparison of liver function between two groups

图15 肾功能Figure 15 Comparison of renal function between two groups
3 讨论
胃癌在世界很多国家的发病率均较高,据估计2009年美国上消化道肿瘤的新发病例约3.7万,死亡例数约为2.5万[17];在日本胃癌依旧是高发肿瘤,尤其是在男性;中国每年新发病例数较其他国家更多,中国胃癌的调整死亡率是欧美发达国家的3.8~8.0倍,并且有明显的地域性,农村高于城市[18]。有研究预测2010年美国大肠癌新发病例约为14.2万,同年死亡病例约为5.1万[19]。消化道肿瘤对人类的健康威胁较大,因此,对其诊断和治疗都应当加以重视。目前发现的消化道恶性肿瘤大多是中晚期,原因之一就是恶性肿瘤的早期症状并不明显,日本对于胃癌的诊断和治疗都走在世界的前列,目前除了日本对胃癌进行早期筛查,大多数国家并未对消化道肿瘤进行早期筛查,因此,对于其治疗的要求就更加严格。S-1是日本首先开发并用于治疗消化道肿瘤的口服药,其在临床应用备受同专业专家学者的关注,对其研究的项目日益增多,且大多数研究是多中心的临床随机对照试验,推动了消化道肿瘤的治疗工作。
本研究通过对大量关于S-1的临床研究试验进行检索,发现目前国内外对S-1疗效的系统评价较少,因此,采用Cochrane提供的最新文献评价方法对S-1与氟尿嘧啶治疗中晚期消化道肿瘤临床疗效及其并发症进行评价。本研究发现,在治疗中晚期消化道肿瘤方面,S-1与氟尿嘧啶相比并没有提高患者的总生存期,也没有延长患者的无病生存期,与相关文献报道相符[1-4];S-1组24个月总生存期优于对照组〔RR=1.45,95%CI(1.05,2.00),I2=0,P=0.02〕,与其他文献研究不符[1-3]。对于化疗药物产生的并发症,S-1对中性粒细胞、血小板、腹泻、恶心、内生肌酐清除率、血钾、血磷、血镁、骨髓的影响较氟尿嘧啶轻,而对胆红素的影响较重,但并未检索到针对此研究结果的相关文献。
综上所述,S-1对于中晚期消化道肿瘤并未提高患者的生存期,但可以降低部分化疗并发症,有助于提高患者的生活质量;另外,本品可以直接口服,简化了相关的治疗程序[20]。尽管本研究纳入的文献研究质量均较高,但其一致性并不高,势必会影响到评价的质量,期待有更大样本的多中心随机对照试验的出现,至于本研究部分结果是否会因为新的研究的纳入而逆转则不得而知,并期待关于S-1与氟尿嘧啶比较的相关经济学指标的研究出现,进一步从疗效、并发症、经济学三方面完善对S-1的系统评价。
1 Muro K,Boku N,Shimada Y,et al.Irinotecan plus S -1(IRIS)versus fluorouracil and folinic acid plus irinotecan(FOLFIRI)as second-line chemotherapy for metastatic colorectal cancer:a randomised phase 2/3 non-inferiority study(FIRIS study) [J].Lancet Oncol,2010,11(9):853-860.
2 Ajani JA,Rodriguez W,Bodoky G,et al.Multicenter phaseⅢ comparison of cisplatin/S-1 with cisplatin/infusional fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study:the FLAGS trial[J].JClin Oncol,2010,28(9):1547 -1553.
3 Boku N,Yamamoto S,Fukuda H,et al.Gastrointestinal Oncology Study Group of the Japan Clinical Oncology Group.Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer:a randomised phase 3 study [J].Lancet Oncol,2009,10(11):1063-1069.
4 Jin M,Lu H,Li J,et al.Randomized 3-armed phaseⅢ study of S-1 monotherapy versus S-1/CDDP(SP)versus 5-FU/CDDP(FP)in patients(pts)with advanced gastric cancer(AGC):SC-101 [J].Journal of Clinical Oncology:ASCOannual meeting proceedings,2008,26:15S.
5 Sakuramoto S,Sasako M,Yamaguchi T,et al.ACTS - GC Group.Adjuvant chemotherapy for gastric cancer with S-1,an oral fluoropyrimidine[J].N Engl J Med,2007,357(18):1810-1820.
6 Narahara H,Iishi H,Imamura H,et al.Randomized phaseⅢ study comparing the efficacy and safety of irinotecan plus S-1 with S-1 alone as first-line treatment for advanced gastric cancer(study GC0301/TOP-002)[J].Gastric Cancer,2011,14(1):72 -80.
7 Koizumi W,Narahara H,Hara T,et al.S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer(SPIRITS trial):a phase Ⅲ trial[J].Lancet Oncol,2008,9(3):215 -221.
8 Lee JL,Kang YK,Kang HJ,et al.A randomised multicentre phaseⅡ trial of capecitabine vs S-1 as first-line treatment in elderly patients with metastatic or recurrent unresectable gastric cancer[J].Br JCancer,2008,99(4):584 -590.
9 Yoshikawa T,Tsuburaya A,Morita S,et al.A comparison of multimodality treatment:two or four courses of paclitaxel plus cisplatin or S-1 plus cisplatin followed by surgery for locally advanced gastric cancer,a randomized Phase Ⅱ trial(COMPASS) [J].Jpn J Clin Oncol,2010,40(4):369-372.
10 Hibi S,Ina K,Furuta R,et al.Clinical effects of Hange- shashin-to on combination therapy of S-1/irinotecan against the for patients with metastatic gastric and colorectal cancer[J].Gan To Kagaku Ryoho,2009,36(9):1485-1488.
11 Fujii M;O.Chemotherapy for advanced gastric cancer:ongoing phaseⅢstudy of S-1 alone versus S-1 and docetaxel combination(JACCRO GC03 study) [J].Int J Clin Oncol,2008,13(3):201-205.
12 Oki E,Kakeji Y,Yoshida R,et al.A randomized controlled trial to evaluate the effect of adjuvant oral fluoropyrimidine derivative therapy after curative resection for stageⅡ/Ⅲ rectal cancer-adjuvant chemotherapy trial of S-1 for rectal cancer(ACTS-RC) [J].Gan To Kagaku Ryoho,2006,33(Suppl 1):S138-S143.
13 Ueda Y,Fujimura T,Kinami S,et al.A randomized phase Ⅲ trial of postoperative adjuvant therapy with S-1 alone versus S-1 plus PSK for stageⅡ/ⅢA gastric cancer:Hokuriku-Kinki Immunochemo-Therapy Study Group-Gastric Cancer(HKIT-GC)[J].Jpn JClin Oncol,2006,36(8):519 -522.
14 Takahashi Y,Sakamoto J,Takeuchi T,et al.A randomized phaseⅡclinical trial of tailored CPT-11+S-1 vs S-1 in patients with advanced or recurrent gastric carcinoma as the first line chemotherapy[J].Jpn J Clin Oncol,2004,34(6):342 -345.
15 Jeung H,Im C,Rha S,et al.A randomized phase Ⅱ trial of docetaxel plus S-1 versus docetaxel plus cisplatin in advanced gastric cancer as a first-line treatment[J].Journal of Clinical Oncology:ASCO annual meeting proceedings,2008,26:15S.
16 Yoshino S,Oka M.Randomized phaseⅢ study of S-1 alone versus S-1 plus lentinan in advanced or recurrent gastric cancer[J].Biotherapy,2007,21(5):315-321.
17 Jemal A,Siegel R,Ward E,et al.Cancer staristics,2009 [J].CA Cancer J Clin,2009,59:225-249.
18 孙秀娣,牧人,周有尚,等.中国胃癌死亡率20年变化情况分析及其发展趋势预测 [J].中华肿瘤杂志,2002,24:101-105.
19 Jemal A,Siegel R,Ward E,et al.Cancer staristics,2010 [J].CA Cancer J Clin,2010,60:277-300.
20 邢汉飞,韩超.替吉奥联合手术治疗晚期胃癌的疗效观察[J].实用心脑肺血管病杂志,2011,19(8):1312.

