布地奈德对变应性鼻炎嗅觉障碍干预作用的实验研究
王晓巍,朱莹莹,倪道凤
嗅觉作为人体的重要感觉之一,在人类的社会生活中发挥着重要的作用。嗅觉的主要功能包括辨别气味、识别环境、引起食欲及情绪调节等。人的嗅觉敏感与否对生活、学习和工作影响很大。嗅觉障碍在人群中并不少见,有研究曾对150万人进行嗅觉调查,其中1.2%有永久性嗅觉丧失,62.4%有暂时性嗅觉丧失[1]。
多种因素可引起临床嗅觉障碍。变应性鼻炎 (allergic rhinitis,AR)是常见的耳鼻咽喉科疾病,也是临床上引起嗅觉障碍的主要原因之一。目前各项流行病学研究趋向认为,在人群中,AR的发病率为10% ~30%[2]。嗅觉障碍是AR的常见伴随症状,有较多相关报道提到嗅觉丧失或减退与鼻部变态反应相关[3]。Cowart等[4]调查显示23.1%的AR患者存在嗅觉减退。Rombaux等[5]报道AR引起嗅觉减退的发病率为15% ~20%。AR引起嗅觉障碍的机制尚未完全明了。既往的观点认为由于鼻腔的炎症导致气味分子到达鼻腔顶部嗅觉感受器的通道受阻是导致嗅觉障碍的主要原因,即传导性嗅觉障碍。而近来的研究表明,嗅上皮因变态反应引起嗅上皮组织病理学变化,即感觉性嗅觉障碍,可能是AR患者产生嗅觉障碍的直接原因之一[6]。
无论是AR,还是其他原因导致的嗅觉障碍,目前尚无理想的治疗药物。临床上常应用糖皮质激素 (glucocorticoid,GC)来治疗嗅觉障碍。Faulcon等[7]用GC治疗41例病毒感染后嗅觉障碍的患者,发现治疗后效果良好。Heilmann等[8]对55例患者的临床研究发现,口服泼尼松龙可以改善上呼吸道感染、鼻窦炎、特发性嗅觉障碍等各种原因引起的嗅觉障碍。Stevens[9]指出对鼻息肉鼻内镜术后已解除阻塞但仍有嗅觉障碍的患者,每天口服40 mg泼尼松 (逐渐减量)有助于嗅觉的改善。北京协和医院耳鼻喉科在临床应用局部气动喷射雾化吸入GC治疗嗅觉障碍也取得了较好的疗效[10-11]。目前尚缺乏应用GC专门针对AR引发的嗅觉障碍进行治疗的临床研究,但GC作为AR的一线选择用药,已经在临床工作中得到广泛应用。本实验研究是采用卵清蛋白致敏小鼠,建立AR的小鼠模型,观察小鼠鼻腔嗅上皮的组织病理学变化。进而通过鼻内滴用布地奈德,对小鼠嗅黏膜的嗅觉标记蛋白 (olfactory marker protein,OMP)的表达水平进行定量分析,探讨GC治疗AR嗅觉障碍的作用。
1 资料与方法
1.1 造模
1.1.1 实验动物 清洁级BALB/C小鼠70只,雄性,8周龄,体质量 (25±1)g。应用随机数字表以简单随机化分组法将全部动物分为模型组 (60只)及对照组 (10只)。
1.1.2 致敏阶段 模型组小鼠腹腔注射卵清蛋白Al(OH)3溶液,浓度40μg/ml。配制方法以20 mg卵清蛋白加2 mg Al(OH)3佐剂,0.9%氯化钠溶液定容500 ml,溶液于临用前配制。腹腔注射200μl(约300μg/kg),隔天1次,连续7次。对照组以等量0.9%氯化钠溶液代替卵清蛋白溶液。
1.1.3 激发阶段 模型组小鼠鼻腔滴入卵清蛋白溶液,浓度为50μg/ml。于致敏阶段结束间隔7 d后,以戊巴比妥腹腔内注射麻醉,以移液器吸取卵清蛋白溶液40μl(约80μg/kg),缓慢均匀滴入小鼠双侧前鼻孔,随呼吸进入鼻腔。每天激发1次,连续激发7 d。对照组以等量0.9%氯化钠溶液代替卵清蛋白溶液。
1.1.4 造模评估 采用症状行为学叠加量化计分法对模型组进行评估[12]。于末次鼻腔激发致敏后立即观察30 min,记录小鼠鼻分泌量、喷嚏次数及搔鼻情况,采用叠加量化计分法,总积分>5分者为造模成功 (见表1)。

表1 症状记分标准表Table 1 Symptom scoring standard
1.2 嗅觉功能评估 嗅觉障碍检查采用埋藏小球实验 (buried food test,BFT):将食物小球埋藏在垫料中,位置随机选择,深度为1~2 cm。将模型组小鼠放入实验场所中,以300 s(5次测试的平均值)内未找到食物小球的小鼠即定为存在嗅觉功能障碍,列入AR伴嗅觉障碍组 (42只),其余小鼠列入AR不伴嗅觉障碍组 (13只)。同时对对照组小鼠进行BFT测试,并与模型组结果进行对照。
1.3 组织取材 于建模成功后第3天,选取全部对照组小鼠及AR不伴嗅觉障碍组小鼠、AR伴嗅觉障碍组小鼠各9只。断髓处死动物,去除头部的毛皮,暴露头颅标本。进一步修剪头颅标本,保留鼻腔上部,包括鼻中隔、鼻腔外侧壁及筛板。将标本浸于4%多聚甲醛溶液中约48 h,取出后浸入10%EDTA溶液中脱钙14 d,每日更换脱钙液。14 d后,标本以自来水冲洗24 h,之后重新浸入4%多聚甲醛溶液中固定约24 h。1.4 药物干预 将剩余的AR伴嗅觉障碍组小鼠简单随机化分为不用药组10只、布地奈德干预1组及布地奈德干预2组各11只。布地奈德干预1、2组小鼠双侧鼻腔内各滴入30μl布地奈德 (雷诺考特,鼻内喷雾用细微颗粒混悬液,规格为7.68 mg,6 ml,阿斯丽康公司)药物原液,1次/d,连续5 d。不用药组不给予药物干预。于开始给药后第7天处死布地奈德干预1组及不用药组动物并取材,于开始给药后第14天处死布地奈德干预2组动物,同法取材。
1.5 HE染色 在对照组、AR不伴嗅觉障碍组、AR伴嗅觉障碍组中,每组随机选取3个标本,每个标本随机选取切片做HE染色。
1.6 免疫组化 各组中每组简单随机化选取3个标本,每个标本随机选取切片。光镜下观察,每个标本各5张切片,在统一放大倍数 (×400)下,随机检测并计数5个高倍视野 (×400)下的全部OMP阳性细胞。
1.7 统计学方法 采用SPSS 11.0统计分析软件进行处理,所得到的数值以表示,各组数据的比较应用t检验,以p<0.05为差异有统计学意义。
2 实验结果
2.1 一般指标观察 在鼻内滴液激发阶段过后,模型组小鼠死亡5只,对照组小鼠死亡2只。存活的两组小鼠均毛色光泽,摄食饮水正常,反应灵敏,活动正常、活跃。
2.2 造模评估 采用症状行为学叠加量化计分法对模型进行评估。经观察对比,模型组小鼠在致敏前计分均值为 (0.51±0.49),经致敏激发后模型组小鼠频频用前爪抓搔鼻端两侧,并伴有发作性的喷嚏动作,鼻分泌物流出量从鼻端两道湿痕至鼻口周围大量清亮液体不等 (见表2)。模型组小鼠在致敏激发后计分均值为 (6.17±1.67)分,计分明显增高,且差异有统计学意义 (t=3.964,p<0.01)。对照组小鼠给药前计分均值 (0.47±0.38)分,给药后未出现明显症状,计分均值为 (0.63±0.47)分,计分增高无明显变化,且差异无统计学意义 (t=1.593,P>0.05)。因而可以认定本实验采用卵清蛋白致敏激发小鼠建立AR小鼠模型的方法是成功的。
2.3 嗅觉功能评估 应用BFT,分别对模型组及对照组小鼠进行嗅觉功能评估。其中对照组8只小鼠均可于300 s内找到埋藏的食物小球,平均时间 (122±4)s。而模型组小鼠中有13只于300 s内找到食物小球,平均时间 (159±3)s。其余42只均无法在300 s内寻找到埋藏的食物小球。伴有嗅觉障碍的模型小鼠占全部模型组小鼠数量的76.36%。
2.4 HE染色 对照组:嗅区黏膜由上皮层和固有层构成(见图1)。嗅上皮可见 ORNs、支持细胞 (supporting cells,SCs)和基底细胞 (basal cells,BCs)。嗅感受神经元 (olfactory receptor neurons,ORNs)的细胞核为类圆形,深蓝色,位于嗅上皮的中部,呈多层排列,7~8层;SCs的细胞核为椭圆形,淡蓝色,位于嗅上皮近表层;BCs的细胞核较小,扁圆形,位于嗅上皮的底层,靠近基底膜;固有层中可见嗅神经和血管 (见图2)。嗅黏膜上皮层中各层细胞排列整齐,极性明显 (见图3A)。模型组嗅黏膜上皮层变薄,ORNs层数减少,排列紊乱,与对照组有明显区别 (见图3B、3C)。
2.5 免疫组化 对照组:光镜下OMP免疫阳性细胞为棕褐色染色,分布于嗅黏膜的上皮层和固有层,在嗅黏膜表面的纤毛也可见OMP反应 (见图4、5A)。模型组:镜下见嗅黏膜上皮层变薄,染色变淡,OMP表达较对照组减少 (见图5B、5C)。经图像分析仪对5个高倍视野 (×400)下的上皮层染色阳性细胞进行计数,AR不伴嗅觉障碍组与对照组比较差异无统计学意义 (t=1.237,P>0.05);AR伴嗅觉障碍组与对照组比较差异有统计学意义 (t=6.921,p<0.05)。经过药物干预阶段,进一步对AR伴嗅觉障碍小鼠进行观察,其中不用药组:嗅黏膜上皮层厚度有所增加,细胞排列仍较紊乱。上皮层OMP表达稍有增多 (见图5D)。OMP染色阳性细胞数与AR伴嗅觉障碍组比较差异无统计学意义 (t=2.003,P>0.05)。布地奈德干预1组:嗅黏膜上皮层厚度有所增加,上皮层OMP表达增多 (见图5E)。OMP染色阳性细胞数与AR伴嗅觉障碍组比较差异有统计学意义 (t=3.360,p<0.05),与对照组比较差异无统计学意义 (t=1.676,P>0.05)。布地奈德干预2组:与布地奈德干预1组表现相似 (见图5F),OMP染色阳性细胞数与布地奈德干预1组比较差异无统计学意义(t=1.197,P >0.05,见表3)。

表2 模型组小鼠症状观察情况 (只)Table 2 Symptom observation of rats in model group

表3 各组嗅上皮OMP染色阳性细胞数比较Table 3 Comparsion of olfactory epithelium OMPpositive cells in each group

图1 小鼠嗅黏膜HE染色 (×100)示:小鼠嗅黏膜由上皮层和固有层构成。嗅黏膜上皮层 (⇨);嗅黏膜固有层 (☆)Figure 1 HE staining of rat olfactory mucosa:olfactory mucosa of rat is composed by epithelium and lamina propria.Epithelium propria(⇨),lamina propria(☆)
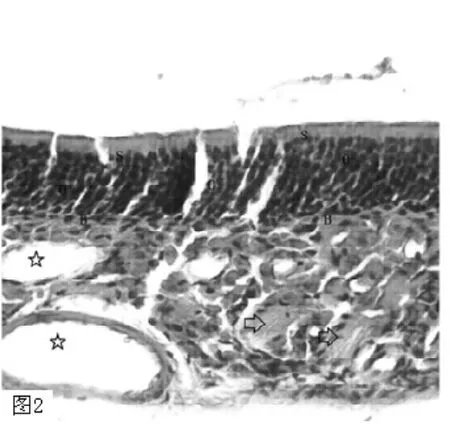
图2 小鼠嗅黏膜HE染色 (×200)示:嗅感受神经元 (O);支持细胞 (S);基底细胞 (B);血管 (⇨);固有层嗅神经纤维(☆)Figure 2 HE staining of rat olfactory mucosa:olfactory receptor neurons(O),supporting cells(S),basal cells(B),blood vessel(⇨),olfactory nerve fiber in lamina propria(☆)
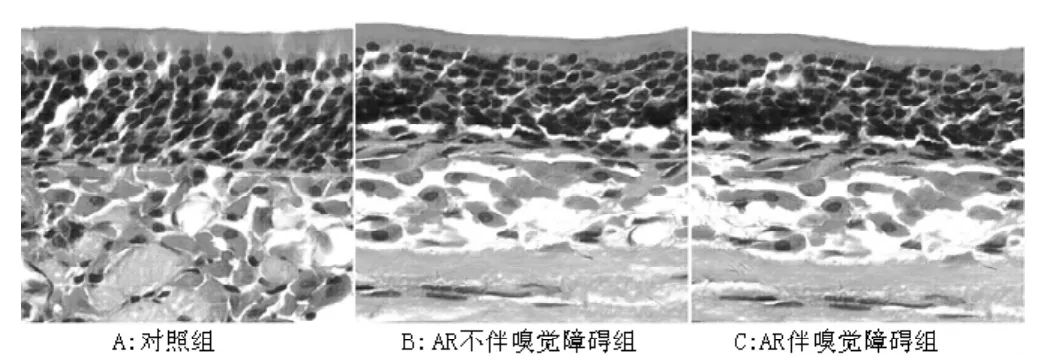
图3 各组小鼠嗅黏膜HE染色 (×400)Figure 3 HE staining of rat olfactory mucosa in each group

图4 小鼠嗅黏膜免疫组化OMP表达 (×200):OMP免疫阳性细胞为棕黄色染色。嗅黏膜上皮层 (⇨);嗅黏膜固有层 (☆)Figure 4 Immunohistochemical expression of OMP in rat olfactory mucosa(×200):OMP immunoreactive cells are brownish yellow staining.Epithelium propria(⇨),lamina propria(☆)
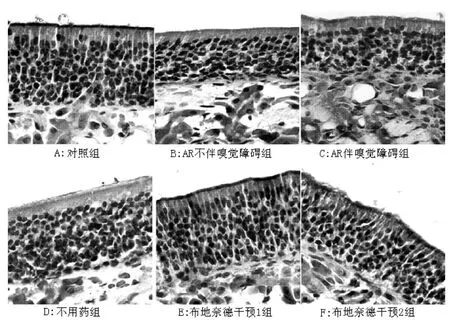
图5 各组小鼠嗅黏膜免疫组化OMP表达 (×400)Figure 5 Immunohistochemical expression of OMP in rat olfactory mucosa in each group
3 讨论
AR是特应性个体接触致敏原后由IgE介导的递质 (主要是组胺)释放、并有多种免疫活性细胞和细胞因子等参与的鼻黏膜慢性炎症反应性疾病。AR的主要临床表现有鼻塞、流鼻涕、鼻痒、打喷嚏以及嗅觉功能障碍等。由于其在人群中发病率高,且发病率有逐年增加的趋势[13-14],特别是其可损伤患者嗅觉引发嗅觉障碍[15-16]。因此AR是引起嗅觉障碍的主要因素之一。
建立动物模型是研究AR发病机制及病理生理变化的基础和手段。本实验选择BALB/C小鼠作为建模动物,利用卵清蛋白加佐剂氢氧化铝先使动物机体致敏,再滴鼻维持致敏状态,方法简单,复制了在体征和病程方面都与人的临床AR近似的动物疾病模型,经症状行为学测试符合建模成功的标准。以实验动物行为学的改变评估其嗅觉功能是目前广泛应用的实验方法。BFT是Edwards早在1972年就在研究小鼠嗅觉障碍的行为时即已应用了的嗅觉评估方法。此后该类方法不断改进[12-18]。进行BFT操作所需实验装置花费低,操作比较容易,具有良好的可行性及可重复性。判断嗅觉障碍的标准即找到食物小球的时间大于300 s为存在嗅觉障碍。在本实验分组前对所有小鼠进行BFT预评估,所有小鼠均在300 s内找到食物小球。嗅觉行为学试验以300 s为分组标准是合理可行的。通过BFT检测,约76.36%的AR小鼠表现出嗅觉功能的障碍,可见嗅觉障碍是AR常见的症状。本实验中,AR模型动物的嗅黏膜上皮层变薄,各层细胞排列不整齐,层数明显减少,极性消失,说明AR模型小鼠的嗅黏膜发生了明显的病理改变,其嗅感受神经元本身存在病理损伤。
在嗅觉相关的研究中,OMP是近年来颇受关注的热点。OMP是与嗅觉密切相关的一种蛋白质,特异性地表达于成熟的ORNs。ORNs是嗅黏膜内惟一的神经元,其功能是感受空气中的气味分子,将化学信号转化为电信号,向嗅球和嗅觉高级中枢传递嗅觉信息[19-21]。研究嗅上皮中OMP的表达,可以显示出ORNs在嗅上皮内的分布情况,并能说明致病因素对嗅上皮中ORNs的影响。本实验通过免疫组化方法,对嗅上皮中的OMP表达进行定位、定性及定量的分析。结果显示,AR小鼠嗅黏膜的OMP表达比对照组减低,其中伴有嗅觉障碍的AR小鼠嗅黏膜的OMP表达水平显著低于对照组。进一步说明了AR伴有嗅觉障碍的小鼠嗅黏膜本身发生了病理改变。
GC是临床治疗嗅觉障碍的常用药物[22]。GC治疗嗅觉障碍的作用机制尚不完全清楚。目前已知GC通过抑制炎性细胞因子的产生,诱导抗炎因子的合成,减轻嗅黏膜的炎症反应,减轻其充血和肿胀,以增加空气中的气味分子与嗅区黏膜的接触面积,促进气味分子与ORNs结合,改善嗅觉。除上述的改善传导性因素的作用外,糖皮质激素对嗅黏膜本身也发挥着直接的作用。研究发现嗅黏膜中存在糖皮质激素受体[23],存在接受糖皮质激素调节的Na+-K+-ATP酶[24]。这些分子水平上的发现,均为GC通过直接影响嗅黏膜治疗嗅觉障碍提供了一定的理论依据。本实验中,应用布地奈德鼻内滴用进行干预7 d后,观察到小鼠嗅黏膜OMP的表达显著高于用药前水平,也高于同期观察的不用药的小鼠,而与对照组的OMP表达水平相当,说明鼻内局部应用糖皮质激素可以增加嗅上皮中嗅感受神经元的数量。而用药后第14天观察到的嗅黏膜OMP表达与用药后7 d的结果相当,均与对照组OMP的表达无明显差异,说明鼻内局部应用糖皮质激素增加嗅上皮ORNs的数量、改善嗅觉功能的作用,可以持续较长时间。在临床工作中,对于全身应用糖皮质激素,其对机体产生的副作用是医患双方均力图规避的问题。而鼻内局部应用的糖皮质激素药物具有局部吸收,全身生物利用度低,副作用小的明显优点。因此,鼻内局部应用糖皮质激素是治疗AR引起的嗅觉障碍的较好方法。
1 倪道凤.嗅觉障碍和嗅觉功能检[J].临床耳鼻咽喉科杂志,2003,17(9):571-575.
2 Kirtsrccsakul V,Naclcrio RM.Role of allergy in rhinosinusitis[J].Curr Opin Allery Clin Immunol,2004,4:17 -23.
3 Moll B,Klimek L,Eggers G.Comparison of olfactory function in patients with seasonal and perennial allergic rhinitis[J].Allergy,1998,53:297-301.
4 Cowart BJ,Flynn - Rodden K,McGeady SJ,et al.Hyposmia in allergic rhinitis[J].JAllergy Clin Immunol,1993,91:747 -751.
5 Rombaux P,Collet S,Eloy P.Smell disorders in ENT clinic [J].BENT,2005,1(Suppl 1):97-107.
6 Richard L,Doty,Anupam Mishra.Olfactory and its alteration by nasal obstruction rhinitis and rhinosinusitis[J].Laryngoscope,2001,111(3):409-423.
7 Faulcon P,Biacabe B,Bonfils P.Contribution of corticosteroid treatment in neurosensorial anosomia:a series of 62 patients[J].Ann Otolaryngol Chir Cervicofac,2000,117:374-377.
8 Heilmann S,Huettenbrink KB,Hummel T.Local and systemic administration of corticosteroid in the treatment of olfactory loss[J].Am J Rhinol,2004,18:29 -33.
9 Stevens MH.Steroid-dependent anosmia[J].Laryngoscope,2001,111:200-203.
10 倪道凤.嗅觉基础与临床[M].北京:人民卫生出版社,2010:186,204.
11 关静,倪道凤,王剑,等.上呼吸道感染和鼻部炎症性疾病嗅觉障碍的治疗 [J].临床耳鼻咽喉头颈外科杂志,2010,24(11):485-488.
12 Miescher SM,Vogel M.Molecular aspects of allergy[J].Mol Aspects Med,2003,23(6):413 -462.
13 顾之燕.呼吸道炎症反应[J].中华耳鼻咽喉科杂志,2001,36:397-399.
14 Amit A,Saxena VS,Pratibha N,et al.Mast cell stabilization,lipoxygenase inhibition, hyaluronidase inhibition,antihistaminic and antispasmodic activities of Aller-7,a novel botanical formulation for allergic rhinitis[J].Drugs Exp Clin Res,2003,29:107-115.
15 Mott AE,Cain WS,Lafreniere D.Topical corticosteroid treatment of anosmia associated with nasal and sinus disease[J].Arch Otolaryngol Head Neck Surg,1997,123:367 -372.
16 Simola M,Malmberg H.Sense of smell in allergic and nonallergic rhinitis[J].Allergy,1998,53:190-194.
17 Nathan BP,Yost J,Litherland MT,et al.Olfactory function in spoE knockout mice[J].Behav Brain Res,2004,150:1-7.
18 Liebenauer LL,Slotnick BM.Social organization and aggression in a group of olfactory bulbectomized male mice [J].Physiol Behav,1996,60:403-409.
19 Berghard A,Buck LB,Liman ER.Evidence for distinct signaling mechanisms in two mammalian olfactory sense organ[J].Proc Natl Acad Sci USA,1996,93(6):2365-2369.
20 Buck LB.The molecular architecture of odor and pheromone sensing in mammals[J].Cell,2000,100:611 -618.
21 陈志宏,倪道凤.气味受体研究进展[J].国外医学耳鼻咽喉科学分册,2003,27(2):92-95.
22 刘春军.鼻内镜结合糖皮质激素治疗鼻息肉病的临床疗效观察[J].中国全科医学,2011,14(6):2106.
23 Robinson AM,Kern RC,Foster JD.Expression of glucocorticoid receptor mRNA and protein in the olfactory mucosa:physiologic and pathophysiologic implications[J].Laryngoscope,1998,108:1238-1242.
24 Fong KJ,Kern RC,Foster JD,et al.Olfactory secretion and sodium,potassium-adenosine triphosphatase:regulation by corticosteroids[J].Laryngoscope,1999,109:383 -388.

