食物致病菌快速检测系统的设计与实现*
许 丽,董文钧,王学斌,陈本永
(浙江理工大学纳米测量技术实验室,杭州310018)
传统的细菌检测方法仍然停留在细菌培养和用标准菌落计数器或其它的照明放大镜计数的基础上,传统方法检测起来不仅繁琐,而且检测周期较长,约为24 h~48 h,难于满足目前对食品安全监测的要求[1]。基于抗原-抗体相互作用的免疫传感器由于其特异性和灵敏性使其成为研究的热点,通过抗原-抗体的相互作用,几乎所有的微生物可以直接或间接地被快速检测出来[2-9]。免疫传感器就其检测方法又可分为:电流检测法[2,4]、循环伏安法[3]、阻抗频谱法[5-6]、生物发光法[7]。其中阻抗频谱法具有检测速度快、无标记、信息量全面、成本低、易于操作等特点被广泛地应用于微生物免疫分析领域。免疫传感器按固定抗体的方法可以分为:生物素-(链霉)亲和素相互作用法[3,7]、导电聚合物包埋法[4,6]、自组装单层膜吸附法[5,8]、蛋白质A或G特异结合法[9]。生物素-亲和素相互作用法需要将捕获抗体进行生物素化修饰,蛋白质特异结合法只能针对少量种类细菌抗体,本文采用TiO2纳米线的物理吸附作用来固定抗体。
TiO2具有良好的生物相容性、化学稳定性和可忽略的蛋白质变性作用,这些特殊的性能都使其成为理想的生物传感材料[10]。由于二氧化钛纳米线与其它形态的二氧化钛相比,具有更大的比表面积和更强的吸附能力[11]。因此采用化学方法合成TiO2纳米线,半导体特性的TiO2纳米线上可以固定单克隆抗体,单克隆抗体能够与目标靶细菌特异性结合,导致TiO2纳米线的阻抗发生变化,可制备微生物免疫传感器[12]。本文基于TiO2纳米线束和电化学阻抗谱法设计了一套食物细菌自动检测一体化系统。以致病性大肠杆菌为例进行检测,实验结果表明,该检测系统的传感器具有较低的检测下限和较好的复用性,与常规方法相比大大缩短了检测周期,且易于操作和使用。
1 食物致病菌快速检测系统的设计与实现
本文设计的食物致病菌快速检测一体化系统如图1所示,主要是由步进电机、直流电机、蠕动泵头、传感器、检测控制电路和计算机组成。为了实现精确进样,本系统采用57型步进电机装上DG型蠕动泵头,再加上内径和管壁尺寸都为1 mm的Viton抗腐蚀微细软管,可以对试剂实现分辨率为0.01 μL的注射。在试验中为了节约样本试剂,在微细软管的末端装有注射头,先将注射头插入样本试剂液面下2 mm,控制步进电机倒转吸入试剂,然后将注射头移至传感器,控制步进电机正转排出试剂。而对于传感器纳米线束的自动清洗不需要很高的精度要求,可以使用直流电机装上102K型蠕动泵头,软管采用内径和管壁尺寸分别为2 mm和1 mm的Viton抗腐蚀微细软管。计算机作为上位机运行应用程序,采用图形化操作界面控制整个系统的运作。

图1 食物致病菌一体化检测系统框图
1.1 基于TiO2纳米线的微生物免疫传感器的工作原理
利用TiO2纳米线束对目标细菌进行检测的原理如图2所示,传感器两金电极之间的TiO2纳米线束的阻抗和金电极的阻抗为被测物理量,金电极的阻抗相对于半导体特性的TiO2纳米线束的阻抗来说极小,完全可以忽略。TiO2纳米线束具有很大的比表面积,可以牢牢地吸附住抗体,为了防止金电极和抗体相接触进而改变金电极的阻抗,传感器先用硫醇处理金电极,使其不能与抗体抗原相接触。然后加入单克隆抗体,使其固定于TiO2纳米线束表面,最后加入目标细菌,TiO2纳米线束上的单克隆抗体和目标靶细菌进行特异性免疫结合,从而使二氧化钛-抗体-细菌组成的复合纳米线束的阻抗发生变化。通过测量复合纳米线束阻抗的变化量,反推即可得知样本中所含目标靶细菌的数量。

图2 利用TiO2纳米线束微电极检测细菌的示意图
1.2 TiO2纳米线的制备
制备方法采用典型的水热法并加以改进,通过控制反应温度来制备TiO2纳米线。将1.0g锐钛矿TiO2粉末放入20mL二次去离子水中,超声30 min形成TiO2悬浊液,再将悬浊液加入盛有20 mL NaOH(10 mL/L)溶液的具有四氟乙烯内衬的高压釜中反应,反应温度控制在150℃ ~180℃,反应时间控制在12 h ~72 h[13]。反应结束后,用 10%(质量分数)盐酸将反应液pH值调至中性,边过滤边用二次去离子水清洗,直至无 Cl-(用 AgNO3鉴定Cl-)。经过滤后,将得到的沉积物在氮气的气氛下干燥,最后得到的白色产物是具有大比表面积和强吸附能力的多层次结构TiO2纳米线。
1.3 传感器的实现
将TiO2纳米线束置于氧化硅基片上,用微米级的铜网对纳米线做掩膜。使用JPC-1600离子溅射仪对掩膜后的纳米线基片进行镀金形成金电极,保证金电极与纳米线垂直,去掉铜掩膜,选择相邻的两个平行金电极做为连接电极,其余金电极用刀片刮除。用带有绝缘外皮的漆包铜丝焊接到金电极上,焊接处和金电极的大部用绝缘胶将其封装,铜丝做为导线与外界连接。采用3-巯基丙酸来修饰没有被绝缘胶封装的少部分金电极,阻止金电极与抗体相接触,最后分别用99.5%乙醇和二次去离子水清洗3次。
制备的TiO2纳米线金电极的光学显微镜照片如图3所示,相邻金电极之间距离约为30 μm,每个金电极宽约100 μm,TiO2纳米线束长达1 mm~5 mm,TiO2纳米线束的直径约为1 μm ~20 μm。

图3 TiO2纳米线金电极
1.4 检测控制电路的设计
如图1所示,系统的检测控制电路包括六个模块:单片机、阻抗检测模块、串行通信模块、步进电机驱动模块、直流电机驱动模块、电源模块。硬件电路的核心任务是测量出微生物免疫传感器中固定了抗体的二氧化钛纳米线束在捕获目标靶细菌前后阻抗的变化量,因此,检测控制电路设计的核心是阻抗检测模块,其测量出来的阻抗信息经单片机和串行通信模块传送到PC机上显示。
阻抗检测模块采用美国AD公司的高集成度的阻抗检测芯片AD5933。片上集成了直接数字频率合成器和12 bit、1MSPS的模数转换器。如图4所示,直接数字频率合成器DDS可以产生任意指定频率的正弦交流激励信号,然后通过前置放大器施加于传感器上。对经过传感器调制的响应信号进行放大、滤波后,ADC进行采样,然后由DSP引擎进行离散傅里叶变换(DFT)处理。DFT算法在每个频率点上计算出阻抗的一个实部(R)数据字和一个虚部(I)数据字。实部数据字和虚部数据字保存在对应的片上寄存器内,寄存器内容可以通过I2C总线从片上串行I2C接口读取。图1中SDA和SCL为串行I2C总线,VOUT是正弦激励信号输出端,VIN是阻抗信息检测信号输入端。

图4 阻抗检测模块框架图
单片机通过步进电机驱动模块来驱动步进电机,57型步进电机57BYHB76-03A的工作电压为12 V,额定电流为3 A,由于单片机的驱动能力有限,因此采用光耦PC817、达林顿功率晶体管TIP122和大功率限流电阻10 W 3 Ω组成步进电机驱动模块,控制DG型蠕动泵头的开启、停止、正反转、转动步数,实现了试剂的精确化进样。另外,单片机通过由光耦和可调限流电阻组成的直流电机驱动模块控制装有102K型蠕动泵头的直流电机ZGA28RO147转动,实现传感器的自动清洗。
1.5 程序设计
检测系统采用上下位机的设计方法,由上位机通过串口向下位机发送控制命令,下位单片机执行相应的控制命令并把采样结果通过串口传送给上位机PC。
由于阻抗检测芯片AD5933需要I2C总线而下位机没有专用的I2C总线接口,本系统在单片机的通用输入输出引脚中选取两个引脚采用软件时序模拟的方法实现I2C总线的接口功能。下位机采用轮询的方式接收来自上位机的命令,主要执行模块分为阻抗测量模块和电机控制模块,具体的阻抗测量模块程序流程如图5所示。上位机的用户控制应用程序采用Visual Basic 6.0编译环境来实现,具体实验控制界面如图6所示。

图5 下位机程序阻抗测量模块流程图

图6 上位机实验控制界面
2 实验
2.1 试剂
TiO2粉末(Degussa P25)、氢氧化钠、盐酸、3-巯基丙酸(99%)、99.5%乙醇和甘露醇,以上试剂均为分析纯级别,购自杭州高晶精细化工有限公司。10 mol/mL 的磷酸盐缓冲液(自配,PBS,pH=7.4),致病性大肠细菌(Enteropathogenic E.Coli,EPEC,上海谱振生物有限公司),致病性大肠杆菌抗体(bs-0658R,上海谱振生物有限公司),营养肉汤,麦康凯琼脂(杭州微生物试剂有限公司)。实验用水均为二次去离子水。
2.2 细菌准备和平板计数
将购置的大肠杆菌用普通的营养肉汤在37℃条件下培养16 h~20 h,然后用pH=7.4的PBS缓冲溶液将高浓度大肠杆菌溶液依次稀释成6个浓度梯度,分别装入 6 个小瓶,从 10-1到 10-6,每瓶 10 mL,分别标号1~6。用传统的平板计数法对各浓度溶液计数。
2.3 实验过程
检测细菌的基本步骤如下:第1步,将3-巯基丙酸修饰后的传感器接入检测系统,点击采样按钮,测量其阻抗频谱。第2步,安装注射头,点击吸取、进样按钮,控制蠕动泵将10 μL致病性大肠杆菌抗体滴在TiO2纳米线束表面上,在室温培养2 h,然后点击冲洗按钮用去离子水冲洗,最后点击采样按钮,测量固定抗体后传感器的阻抗频谱。第3步,换注射头,点击吸取、进样按钮,控制蠕动泵将10 μL致病性大肠杆菌(EPEC)滴在TiO2纳米线束表面上,在室温培养50 min,然后点击冲洗按钮用去离子水冲洗,最后点击采样按钮,测量加入细菌后传感器的阻抗频谱。第4步,把使用过的传感器置入蛋白质去垢剂中清洗,去除纳米线固定的抗体-抗原复合物,然后干燥备以后使用。
为了测试检测系统中传感器的复用性,取同一浓度的大肠杆菌溶液,对同一个传感器重复上述基本检测步骤3次。
1号~6号小瓶大肠杆菌溶液浓度,由平板计数得分别为:4.5×106cfu/mL、4.5×105cfu/mL、4.5×104cfu/mL、4.5×103cfu/mL、4.5×102cfu/mL、4.5×101cfu/mL。分别从1号~6号小瓶中取10 μL致病性大肠杆菌用自制检测系统进行检测。
3 实验结果分析
为了验证致病性大肠杆菌被抗体修饰的TiO2纳米线所捕获,对纳米线在细菌被捕获前后的扫描电子显微镜图片进行比较,如图7所示,可以看出,表面固定有抗体的纳米线在加入致病性大肠杆菌后,致病性大肠杆菌被吸附在纳米线的表面,被捕获的细菌大小约为2.0 μm,这与致病性大肠杆菌的大小相匹配。
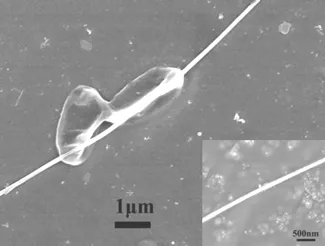
图7 TiO2纳米线捕获致病性大肠杆菌后的SEM图片(插图为捕获前的SEM图)
首先用自制的检测系统对没有固定抗体的传感器测试,然后对传感器固定抗体并测试,最后加入细菌待传感器捕获细菌后对其测试,这3个不同阶段测试所得的传感器阻抗谱如图8所示。从阻抗谱中可以看出,在10 000 Hz之前3个阶段的阻抗差异较为明显,验证了本检测系统的可用性,能够检测到细菌的存在。当抗体滴加在TiO2纳米线上后,纳米线的阻抗值有明显的下降,而大肠杆菌加入后纳米线的阻抗值又有明显的上升,这是因为在中低频率下TiO2纳米线的阻抗主要是由TiO2的极化所引起的。在0.1 mol/L的甘露醇溶液中(PH≈7),TiO2纳米线表面带有负电荷,而致病性大肠杆菌抗体带有正电荷,致病性大肠杆菌带有负电荷。当抗体滴加在纳米线表面时,带正电的抗体与带负电的纳米线发生静电吸引,使得抗体被牢牢地吸附在纳米线表面,从而导致纳米线表面净负电荷量减少,引起纳米线的阻抗值下降。而当大肠杆菌滴加在纳米线表面时,细菌与纳米线固定的抗体发生特异性反应而被抗体捕获,同时带负电荷大肠杆菌的加入使得纳米线表面净负电荷量比抗体固定后有所增加,从而引起TiO2纳米线阻抗值的增加。

图8 纳米线传感器三个不同阶段的阻抗谱
从图9可以看出扫描频率在1 000 Hz~10 000 Hz之间时自制检测系统(主要是TiO2纳米线传感器)的阻抗值基本重合,由此可知制作的传感器重复性较好,可以反复多次使用。

图9 用同一传感器对同一浓度的大肠杆菌检测3次的阻抗谱
从1号~6号小瓶中分别取10μL浓度为4.5×106cfu/mL~4.5×101cfu/mL 的致病性大肠杆菌进行检测,结果如图10所示。可以明显看出随着细菌浓度的下降对应的阻抗谱也在下降,当细菌浓度下降到4.5×101cfu/mL时,对应的阻抗谱已经与固定抗体后纳米线的阻抗谱难于区分,所以该传感器的检测下限为 4.5×102cfu/mL。

图10 加入不同浓度致病性大肠杆菌时的阻抗谱
为了研究免疫传感器捕获细菌后的阻抗值与细菌浓度的关系,在扫描频率为1 040 Hz下,取大肠杆菌不同浓度4.5×102cfu/mL ~4.5×106cfu/mL 的对数值(logC)及其对应的传感器阻抗值作图,并将其做线性回归拟合,拟合直线见图11。拟合后的直线方程为:y=302 687logC-533 666,其中y为传感器的阻抗值,相关系数R=0.93365。

图11 大肠杆菌浓度的对数值与其对应的阻抗值的线性拟合
4 结论
本文设计并研制了基于TiO2纳米线束微生物免疫传感器的食物致病菌快速检测一体化系统,对检测系统的硬件电路和上下位机软件程序进行了构建和实现,以大肠杆菌为例对系统进行测试实验,实验结果表明该系统可以快速检测出食物中大肠杆菌的存在,检测周期约为1 h,并验证了传感器的复用性,表明传感器可以多次重复使用。通过对细菌溶液梯度稀释检测,得出传感器的检测下限为4.5×102cfu/mL。在1 040 Hz扫描频率下,取大肠杆菌不同浓度的对数值及其对应的传感器阻抗值做线性回归拟合,但线性相关系数不是很高。
[1] 陈春田,张顺合,王林,等.细菌快速检测与传统培养方法结果比较[J].检验检疫学刊,2009,19(6):12-14.
[2] Liu S M,Yuan R,Chai Y Q,et al.A Label-Free Amperometric ImmunosensorBased on Horseradish Peroxidase Functionalized Carbon Nanotubes and Bilayer Gold Nanoparticles[J].Sensors and Actuators B,2011,156(1):388-394.
[3] Lu L S,Liu B,Li S F,et al.Improved Electrochemical Immunosensor for Myeloperoxidase in Human Serum Based on Nanogold/Cerium Dioxide-BMIMPF6/l-Cysteine Composite Film[J].Colloids and Surfaces B:Biointerfaces,2011,86(2):339-344.
[4] Qiu J D,Huang H,Liang R P.Biocompatible and Label-Free Amperometric Immunosensor for Hepatitis B Surface Antigen Using a Sensing Film Composed of Poly-Branched Ferrocene and Gold Nanoparticles[J].Microchim Acta,2011,174(2):97-105.
[5] Jin W J,Yang G J,Wu L P,et al.Detecting 5-Morpholino-3-Amino-2-Oxazolidone Residue in Food with Label-Free Electrochemical Impedimetric Immunosensor[J].Food Control,2011,22(10):1609-1616.
[6] Maria D L,Dulcinéia S P,Daniel F Guilherme,et al.Impedimetric Immunosensor for Electronegative Low Density Lipoprotein(LDL-)Based on Monoclonal Antibody Adsorbed on(Polyvinyl Formal)-Gold Nanoparticles Matrix[J].Sensors and Actuators B:Chemical,2011,155(2):775-781.
[7] 田青,刘儒平,刘晓红,等.大肠杆菌特异性快速检测系统研制[J].传感技术学报,2010,23(7):899-902.
[8] 张灯,陈松月,秦利锋,等.检测大肠杆菌O157∶H7的电化学阻抗谱生物传感器的研究[J].传感技术学报,2005,18(1):5-9.
[9] 李杜娟,王剑平,盖玲,等.快速检测大肠杆菌O157∶H7的电化学阻抗免疫生物传感器[J].传感技术学报,2008,21(5):709-714.
[10] Kozlova E A,Safatov A S,Kiselev S A,et al.Inactivation and Mineralization of Aerosol Deposited Model Pathogenic Microorganisms over TiO2and Pt/TiO2[J].Environmental Science & Technology,2010,44(13):5121-5126.
[11] Vivek D,Subas M,Shruti A,et al.Enhanced DSSC Performance with High Surface Area Thin Anatase TiO2Nanoleaves[J].Solar Energy,2011,85(6):1213-1219.
[12] Wang R H,Ruan C M,Kanayeva D,et al.TiO2Nanowire Bundle Microelectrode Based Impedance Immunosensor for Rapid and Sensitive Detection of Listeria Monocytogenes[J].Nano Letters,2008,8(9):2625-2631.
[13]吴凤芹,姚超,王茂华,等.不同晶型纳米二氧化钛的水热合成[J].日用化学工业,2008,38(6):370-373.

