姜黄素联合舒尼替尼治疗人786-0肾癌裸鼠移植瘤
田大伟,陈业刚,刘 鹏,汤 洋,王建民,韩瑞发
实验研究
姜黄素联合舒尼替尼治疗人786-0肾癌裸鼠移植瘤
田大伟1,陈业刚2,刘 鹏2,汤 洋1,王建民1,韩瑞发1
目的:探讨姜黄素联合舒尼替尼对抑制人肾癌细胞系786-0裸鼠移植瘤生长有无增效作用。方法:将32只人肾细胞癌裸鼠随机分为4组,阴性对照组以0.9%生理盐水0.2 mL腹腔注射,舒尼替尼组以舒尼替尼40 mg/kg腹腔注射,姜黄素组以姜黄素100 mg/kg腹腔注射,研究组以舒尼替尼联合姜黄素腹腔注射。结果:研究组较其他3组具有更强的抑瘤作用,远期效果高于舒尼替尼组(P<0.05);研究组比舒尼替尼组抗血管增殖作用更加明显(P<0.01);凋亡指数明显高于其他3组(P<0.05)。结论:姜黄素联合舒尼替尼抑瘤作用明显强于单独应用舒尼替尼或姜黄素。
姜黄素;舒尼替尼;肾癌;裸鼠;移植瘤
肾细胞癌对于化疗、放疗不敏感,舒尼替尼是其晚期的一线用药。但是随着舒尼替尼的应用时间延长,出现了舒尼替尼各种药物副作用及耐药性。因此如何减少舒尼替尼的副作用及延缓耐药性发生又成为了人们研究的新的方向。姜黄素是姜黄属药用植物中的多酚性药用成分,在防治肿瘤等方面有明显作用[1]。研究应用姜黄素联合舒尼替尼进行人肾癌ACNH裸鼠移植瘤抗血管动物实验,为中西医结合治疗恶性肿瘤寻找新的道路。
1 材料与方法
1.1 材料
1.1.1 实验动物 BALB/c裸小鼠,6~8周龄,雄性,体质量19~23 g。购自中国科学院上海实验动物中心, SPF实验室饲养。
1.1.2 细胞系 786-0(人)肾透明细胞癌,由天津医科大学第二附属医院泌尿外科研究所赠予。
1.1.3 药物与试剂 姜黄素由天津市中西医结合医院赠予;兔抗人CD34多抗(购自香港Abcam公司);舒尼替尼由辉瑞默沙东公司赠予。
1.2 方法
1.2.1 细胞培养及裸鼠模型建立 人肾透明细胞癌细胞株786-0用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素RPMI-1640培养液,在37℃的5%CO2培养箱中培养。取指数生长期的786-0细胞经胰酶消化分散,PBS洗涤2次,1000 r/min离心5 min,重悬于PBS中,调整细胞浓度为2×l07/mL。取100 μL(2×106个细胞/只)分别接种于32只裸鼠右肋皮下,SPF环境下饲养。
1.2.3 实动物分组及给药 待成瘤直径约6 mm,经统计学检验肿瘤体积无显著性差异(P>0.05),将荷瘤小鼠随机分为4组,每组8只,共32只。阴性对照组(A组):生理盐水0.2 mL腹腔注射,隔日1次,共10次。舒尼替尼组(C组):舒尼替尼40 mg/kg腹腔注射,隔日1次,共10次。姜黄素组(B):姜黄素100 mg/kg腹腔注射,隔日1次,共10次。研究组(D组):舒尼替尼联合姜黄素剂量及用法同上。
1.2.4 裸鼠肿瘤体积测定 给药后1周开始检测肿瘤体积变化,每隔3 d记录裸鼠皮下移植瘤大小及全身情况变化,并用游标卡尺测量瘤体最长径(a)与最短径(b),计算肿瘤体积:V(mm3)=ab2/2,绘制肿瘤生长曲线。1.2.5 免疫组化检测 30 d观察结束处死裸鼠,取瘤体称重,标本经10%福尔马林固定,石蜡包埋。作4 μm厚连续切片3张,采用SP法染色,按照免疫组织化学常规步骤操作,一抗为兔抗人CD34多克隆抗体。抗体稀释比均为1∶100。
1.2.6 TUNEL检测肿瘤组织细胞的凋亡 根据TUNEL反应检测试剂盒说明书操作。镜下观察,并数5个以上高倍视野,每个视野200个细胞,计数1000个细胞,阳性细胞数以百分数表示,即为肿瘤细胞凋亡指数(AI)。
2 结果
2.1 肿瘤生长曲线 裸鼠腹腔注射给药8 d,C、D组与A、B组比较显示出较强抑制肿瘤生长作用(P<0.05),A组与B组无明显统计学差异(P>0.05)。第15 d,B组肿瘤体积开始明显小于A组(P<0.05)。在以后的观察期间内,B、C、D组在15 d、20 d、25 d、30 d的肿瘤体积均明显小于A组(P<0.05)。第14 d,D组与C、B组相比,肿瘤体积减小(P<0.05)。说明舒尼替尼联合姜黄素治疗的远期效果较单独应用舒尼替尼明显加强。从肿瘤的体积生长变化曲线来看(图1、表1),D组肿瘤生长明显慢于其他各组,进一步说明了舒尼替尼联合姜黄素对肾细胞癌肿瘤生长有明显的抑制作用。通过对裸鼠生存期的观察,我们看到A组自治疗后14 d小鼠开始出现死亡。到观察期45 d结束,A、B、C三组中最多只有5只小鼠存活,而舒尼替尼联合姜黄素组小鼠死亡1只,存活率达到88.5%,相比其他组差异性显著(P<0.05)。表明联合治疗组可以明显延长荷瘤小鼠的生存期。
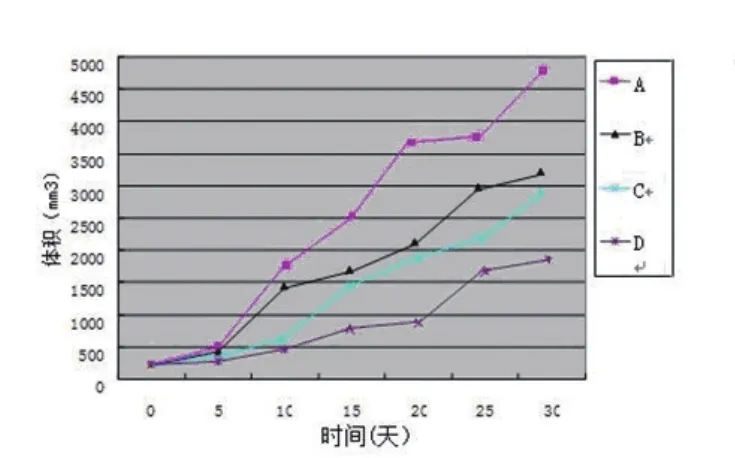
图1 裸鼠瘤体体积变化曲线
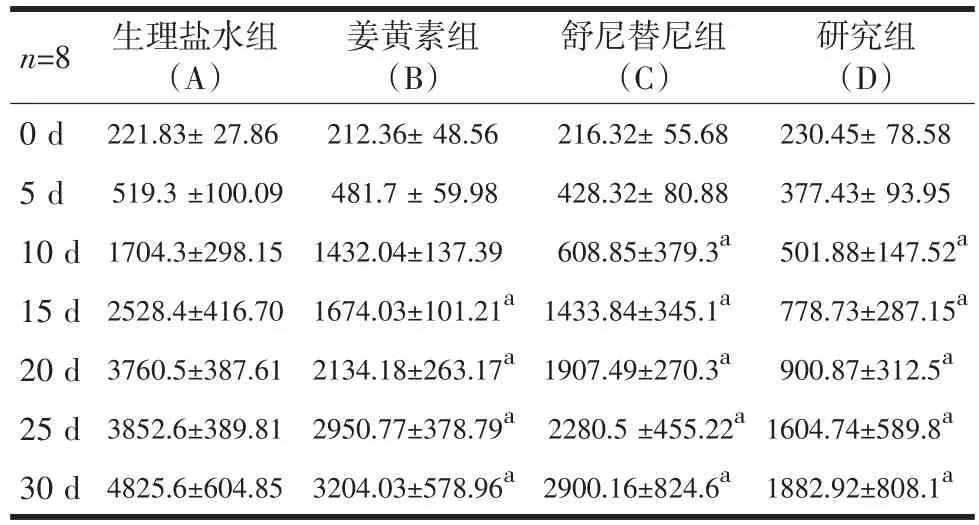
表1 各组人肾细胞癌荷瘤裸鼠体积各时间点对比
2.2 移植瘤组织细胞凋亡 TUNEL法检测细胞凋亡,在D组标本中,发现大量的棕色的凋亡细胞,和变性空泡,明显较其他各组凋亡细胞较多。D组的凋亡指数为(77.12±14.59)%,A组(21.43± 42.09)%,B组(43.07±7.13)%,C组(52.35%± 9.74)%,(P<0.05,图2)。
2.3 微血管密度免疫组化 以高倍镜(×200)镜下观察肾细胞膜被染成棕黄色或细胞质内出现棕黄色颗粒为阳性细胞,利用Image Pro Plus,(IPP)软件图像半定量分析技术,根据阳性细胞光密度总值(IOD)判定,A组IOD(66 191.90±5419.85);B组IOD(47 004.11±4218.09);C组IOD(30 195.50±9442.82);D组(15 575.72±6006.50)。D组MVD较A、B、C3组减少(P<0.01,图3,表2)。
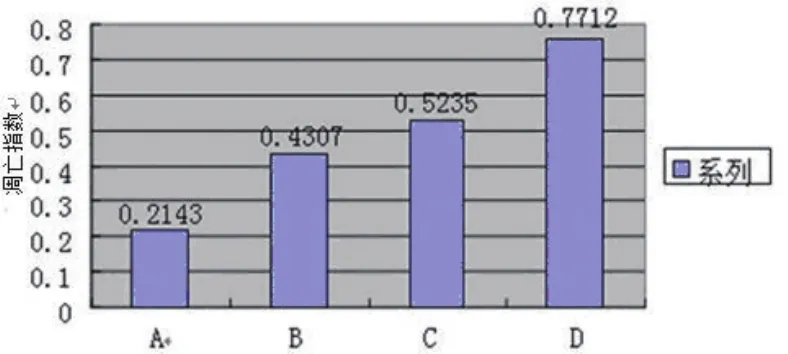
图2 细胞凋亡指数(TUNEL)
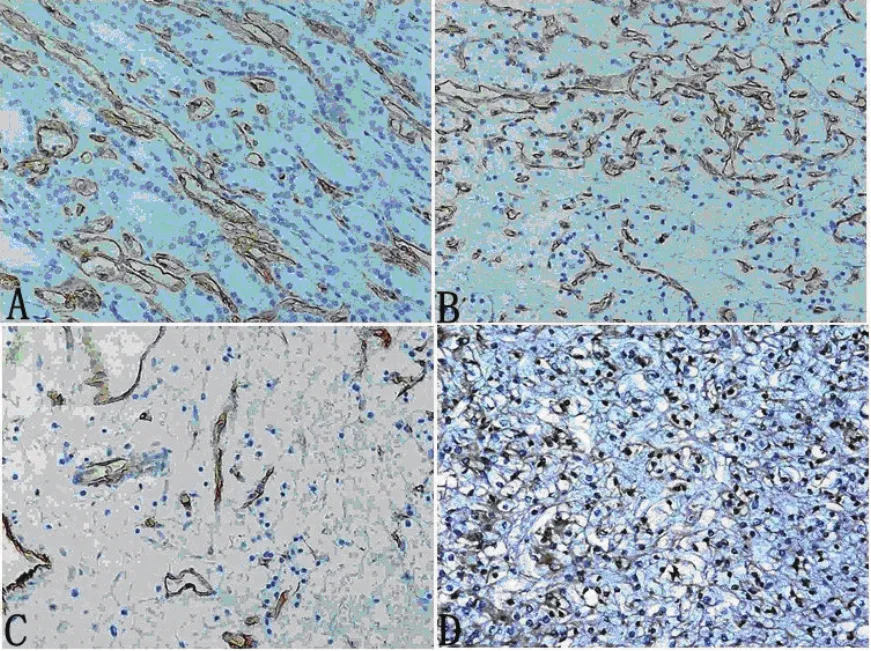
图3 微血管密度免疫组化200

表2 微血管密度表达
3 讨论
肾细胞癌(RCC)在泌尿外科恶心肿瘤疾病中仅次于膀胱移行细胞癌位居第二位。而肾细胞癌作为富血管恶性肿瘤,其肿瘤的生长、侵袭、转移都依赖于肿瘤血管的生成。近年来,随着对Von Hippel-Lindau基因和HIFα信号通路的深入研究,RCC发病的分子机制逐渐阐明,针对RCC细胞不同靶点的分子靶向药物陆续问世。舒尼替尼作为抗肾细胞癌血管生成药物,则作为目前治疗RCC的一线用药。与经典的细胞因子药物相比,舒尼替尼能够明显改善晚期转移性RCC患者的生存状况,ORR达到11%~47%,PFS为5~11个月,OS延长至19~26个月[2-3]。随着舒尼替尼在临床上的推广应用,舒尼替尼的毒副作用也逐渐体现出来,尤其在心血管和肾脏功能方面。一项包括来自13个临床中心共4999例RCC和其他恶性肿瘤患者的资料显示[4],接受舒尼替尼治疗者可以出现高血压和肾功能衰竭,所有级别的高血压和3级高血压的发生率分别为21.6%和6.8%,危险性随着肿瘤的类型和服用舒尼替尼的量而变动。与对照组相比,接受舒尼替尼治疗患者3级高血压和肾功能衰竭的危险性明显增加(P<0.01)。Telli等[5]的研究评估了48例应用舒尼替尼的患者,其中7例出现3或4级左室衰竭症状,出现时间为22~435 d,且3例停药后仍持续存在心功能衰竭。舒尼替尼不良反应除了心血管系统外,对于骨骼、血液和内分泌等系统的不良反应也相继报道。且随着舒尼替尼服用时间延长,其药物副作用也逐渐加重。因此,如何降低舒尼替尼的副作用损害,提高其药物效价,成为了目前人们关注的焦点。
中医中药对恶性肿瘤的治疗有其自身的特点,很多中药成分都具有抑制恶性肿瘤的作用。姜黄素是一种植物多酚,来源于姜黄、郁金、莪术、石菖蒲等的根茎,化学结构为C21H20O6。近年研究发现,姜黄素针对恶性肿瘤药理作用广泛,其中姜黄素具有明显的诱导癌细胞凋亡和抑制肿瘤血管增殖作用[6]。Brandt等[7]研究发现,姜黄素通过JNK/c-Jun/AP-1信号转导通路,实现了galectin-1所诱导的细胞凋亡。Wang等[8]在研究姜黄素对肝癌HepG2细胞的凋亡的诱导作用时发现,姜黄素能够抑制细胞生长,改变细胞表面表型形态。通过细胞内的游离钙离子浓度干扰细胞线粒体膜的状态,来抑制细胞生长,并抑制凋亡通路下游的效应Caspase-3和Caspase-7而发挥诱导凋亡的作用。有研究报道[9],姜黄素能诱导Bcl-2及Caspase-8的差异性表达。Bcl-2蛋白家族在细胞凋亡中有着重要的调节作用,目前Bcl-2是凋亡分子机制研究的主要靶分子。Caspase-8是死亡受体介导的凋亡途径中关键的启动因子,细胞凋亡依赖一类对天冬氨酸特异的半胱氨酸蛋白酶产生的级联反应。Caspase-8能够通过寡聚而自身切割活化,并能激活下游半胱氨酸蛋白酶,产生凋亡效应[10]。刘岩等[11]通过体外实验发现,姜黄素可以明显的促进RCC细胞凋亡,并且发现姜黄素可以下调基质蛋白酶MMP9及MMP2的表达,起到抗肿瘤侵袭的作用。因此认为,姜黄素具有抑制肿瘤侵袭与转移作用。本实验通过对裸鼠瘤体标本进行TUNEL检测发现,在单独使用姜黄素时,较空白对照组使肾细胞癌凋亡率有所升高,具有明显统计学意义。联合舒尼替尼治疗时,其导致RCC细胞凋亡率则较其他3组更高(P<0.05),姜黄素有可能增强了舒尼替尼促肿瘤细胞凋亡作用。
近年研究发现,姜黄素可以明显抑制肿瘤血管的增殖。丁志山等[12]建立了姜黄素鸡胚绒毛尿囊膜血管生成模型,发现姜黄素具有明显的抑制血管生成作用并且与计量成正相关。Weissenberger等[13]研究显示,姜黄素可抑制JAK1,2/STAT3信号传导通路的活性,还可抑制72-kd MMP的表达和转录,说明姜黄素可在转录和转录后水平调节基质金属酶蛋白(matrix metallop roteinase,MMP)发挥抑制血管生成作用。MMP在肿瘤转移和降解过程中可发挥重要作用,姜黄素则被发现可通过抑制MMP活性来抑制血管生成[14]。本实验研究通过对比各组荷瘤裸鼠瘤体标本的MVD免疫组化结果发现,在单独应用姜黄素时,其对肿瘤血管抑制作用较空白组有差异(P<0.05),而与舒尼替尼联合应用后,其治疗效果明显高于其他3组(P<0.01)。
通过对舒尼替尼联合姜黄素治疗人肾细胞癌发现,姜黄素可以明显的提高舒尼替尼的治疗效果,增强其抑制肿瘤血管增生和促进RCC细胞凋亡作用,使其具有更强的抑瘤作用。尤其在应用联合治疗后2周左右,其效果较单独用药更加明显。这可能与随着中药用量的增加引起药物浓度的蓄积,加强了其效果有关。这也与通常中药疗效相符,说明联合用药在长期服用后起远期效果更佳。我们也发现,在单独应用姜黄素时,其治疗效果并不明显。认为有可能存在以下原因,⑴标本例数较少,因为经费所限无法取得大样本数据,所以统计结果有可能存在缺陷。⑵中药有其自身特性,受其剂量、提取工艺及服药时间长短等多因素限制,尤其是用药时间长短,目前并没有一个科学的界定。本实验在姜黄素和舒尼替尼剂量上没有进行相关分组,不同舒尼替尼用量联合姜黄素,是否也能得到满意的治疗效果,是我们下一步的研究目的。如果在减少舒尼替尼的剂量后联合姜黄素仍能达到很好的治疗效果则可以在一定程度上减少舒尼替尼带来的药物副作用,和患者的经济负担从而进一步体现中西医结合治疗的优越性,为中西医结合治疗恶性肿瘤开拓一条新的道路。
[1]张建清.姜黄素的抗诱变、抗癌作用[J].国外医学(卫生学分册),2000,27(3):161-164.
[2]Rini BI,Halabi S,Rosenberg JE,et al.Bevacizumab plus interfer⁃on alfa compared with interferon alfa monotherapy in patients with metastatic renal cell carcinoma:CALGB 90206[J].Clin Oncol, 2008,26(33):5422-5428.
[3]Escudier B,Pluzanska A,Koralewski P,et al.Bevacizumab plus interferon alfa-2a for treatmentof metastatic renal cell carcinoma: a randomized,double-blind phaseⅢ trial[J].Lancet,2007,370 (9605):2103-2111.
[4]Zhu X,Stergiopoulos K,Wu S.Risk of hypertension and renal dys⁃function with an angiogenesis inhibitor sunitinib:systematic review and meta-analysis[J].Acta Oncol,2009,48(1):9-17.
[5]Telli ML,Witteles RM,Fisher GA,et al.Cardiotoxicity associated with the cancer therapeutic agent sunitinib malate[J].Ann Oncol, 2008,26(32):5204-5212.
[6]O′Sullivan-Coyne G,O′Sullivan GC,O′Donovan TR,et al.Cur⁃cumin induces apoptosis-independent death in oesophageal cancer cells[J].Br J Cancer,2009,101(9):1585-1595.
[7]Brandt B,Abou-Eladab EF,Tiedge M,et al.Role of the JNK/ c-Jun/AP-1 signaling pathway in galectin-1-induced T-cell death[J].Cell Death Dis,2010,1(2):23.
[8]Wang M,Ruan Y,Chen Q,et al.Curcumin induced HepG2 cell apoptosis-associated mitochondrial membrane potential and intra⁃cellular free Ca2+concentration[J].Eur J Pharmacol,2011,650(1):41-47.
[9]杨长春,王林源,梁计魁,等.Bcl-2基因家族与细胞凋亡[J].武警医学,2001,12(10):617-619.
[10]Huang TY,Tsai TH,Hsu CW,et al.Curcuminoids suppress the growth and induce apoptosis through caspase-3-dependent path⁃ways in glioblastoma multiforme(GBM)8401 cells[J].J Agric Food Chem,2010,58(19):10639-10645.
[11]刘岩,张春阳,张大田,等.姜黄素对人肾癌786-0细胞凋亡和侵袭的影响[J].中成药,2011,33(2):336-338.
[12]丁志山,高承贤,陈铌铍,等.姜黄素具有抑制血管生成与诱导肿瘤细胞凋亡双重作用[J].中国药理学通报,2003,19(2):171-173.
[13]Boonrao M,Yodkeeree S,Ampasavate C,et al.The inhibitory ef⁃fect of turmeric curcuminoids on matrix metalloproteinase-3 secre⁃tion in human invasive breast carcinoma cells[J].Arch Pharm Res,2010,33(7):989-998.
[14]Mitra A,Chakrabarti J,Banerji A,et al.Curcumin a potential in⁃hibitor of MMP-2 in human laryngeal squamous carcinoma cells HEp2[J].J Environ Pathol Toxicol Oncol,2006,25(4):679-690.
(收稿:2012-06-08 修回:2012-08-26)
(责任编辑 刘洪斌)
Experimental Study of Treatment Effect of Curcumin and Sunitinib on Transplanted Renal Clear Cell Carcinoma in Nude Mice
TIAN Da-wei,CHEN Ye-gang,LIU Peng,et al.Second Hospital of Tianjin Medi⁃
cal University,(300211),China
Objective To study whether curcumin could potentiate the antitumor effect of sunitinib on xeno⁃grafted tumor growth of human renal clear cell carcinoma in nude mice.Methods Thirty two nude mice bear⁃ing human renal clear cell 786-0 xenografted tumor were randomly divided into 4 groups(n=8 in each group): control group(0.2 mL 0.9%NS,intraperitoneal injection),sunitinib group(40 mg/kg,intraperitoneal injection), curcumin group(100 mg/kg,intraperitoneal injection),and the combination group of curcumin and sunitinib. Results Compared with the other three groups,the combination group of curcumin and sunitinib demonstrated significant tumor growth inhibition(P<0.05),the combination group could significantly slow down tumor growth,especially for a forward treatment effect than used sunitinib group alone(P<0.05).The cell apoptosis in⁃dex(TUNEL)showed that combination group apoptosis index was significantly higher than those in the other three groups(P<0.05).Combined treatment group showed more obvious action against vascular proliferation function than contrast used sunitinib alone(P<0.01). Conclusion The combination group of curcumin and sunitinib leads to suppression of tumor obviously better than used sunitinib or curcumin alone,therefore curcum⁃in may become sunitinib sensitizers and improve the treatment effect.
Curcumin;sunitinib;renal cancer;nude mice;transplantation tumor
Q95-33;R737.11
A
1007-6948(2012)05-0469-04
10.3969/j.issn.1007-6948.2012.05.011
1.天津医科大学第二医院泌尿外科(天津 300211)
2.天津市南开医院(天津 300100)
韩瑞发;E-mail:jianshi001@126.com

