pIRES-IL-24-PTEN双表达载体的构建及鉴定
丁嵩涛 彭惠民 周宇箭 刘含登
重庆医科大学实验教学中心,重庆 401331
肿瘤是威胁人类健康的一大疾病,手术、放疗、化疗等传统治疗方法对中晚期及转移性肿瘤疗效较差。近年来,随着分子生物学技术的发展,基因治疗已经运用于临床,然而肿瘤是一种多基因疾病,运用单一基因进行治疗往往达不到预期效果。因此同时运用多种基因联合治疗,基因治疗联合放疗化疗治疗肿瘤疾病成为近年来研究的热点[1]。
白细胞介素24(IL-24)属于白介素10(IL-10)细胞因子家族。研究发现,IL-24能够抑制多种肿瘤细胞增殖及诱导其凋亡,并且对正常细胞没有明显毒副作用[2]。PTEN是一种抑癌基因,其缺失与突变和肿瘤的生长、侵袭、转移密切相关。肿瘤细胞中过量表达PTEN能够引起肿瘤细胞凋亡,阻滞细胞周期,抑制肿瘤细胞生长和迁移[3]。
本实验通过将IL-24和张力蛋白同源基因(PTEN)两种不同作用途径的抑癌基因使用pIRES质粒构建双基因共表达载体,将重组共表达质粒pIRES-IL-24-PTEN转入肿瘤细胞,观察IL-24和PTEN表达情况,从而为探讨上述两种基因联合治疗肿瘤疾病的可能性及进一步研究其信号通路及抗癌机制提供实验基础。
1 材料与方法
1.1 一般材料
限制性内切酶(Nhe Ⅰ,MluⅠ,XbaⅠ,NotⅠ),T4 DNA连接酶,DL2000 marker,pMD18-T载体,PCR试剂盒购自TAKARA公司,胶回收试剂盒购自天根生化科技有限公司,引物由上海生物工程公司合成,pIRES载体购自Clontech公司,脂质体转染试剂盒购自Invitrogen公司,DMEM培养基和胎牛血清购自杭州四季青生物工程材料有限公司,小鼠抗人PTEN抗体和兔抗人IL-24抗体及HRP标记的二抗购自Santa Cruz公司,大肠杆菌DH5α,A549细胞,pGEX-IL-24质粒和pcDNA3.0-PTEN质粒为本室保存。
1.2 PCR扩增IL-24和PTEN基因片段
通过PCR方法从pGEX-IL-24质粒和pcDNA3.1-PTEN质粒扩增带有NheⅠ和MluⅠ酶切位点的IL-24片段以及带有XbaⅠ和NotⅠ酶切位点的PTEN片段,根据IL-24和PTEN报道序列设计引物,引物为:IL-24sense:5’-CGGCTAGC ATGAATTTTCAACAGAGGCTGCA-3’ IL-24antisense:5’-CGACGCGTTCAGAGCTTGTAGAATTTCTG-3’ PTENsense:5’-GCTCTAGACATGACAGCCATCATCAAAGAG-3’PTENantisense:5’-GTGCGGCCGCTTCAGACTTTTGTAATTTGTGT-3’ (划线部分为NheⅠ,MluⅠ,XbaⅠ,NotⅠ的酶切位点),反应体系:模板 2μL,10×Buffer2μL,dNTPs0.5μL,上下游引物各0.5μL,Taq酶0.25μL,灭菌水补充反应体系至20μL。反应参数:94℃预变性5 min,94℃变性30 s,退火30 s(IL-24退火温度:59℃;PTEN退火温度:55℃),72℃延伸1 min,经过30次循环后72℃延伸5 min。PCR产物经琼脂糖凝胶电泳鉴定,胶回收纯化后连接至pMD18-T载体,转化大肠杆菌DH5α,挑取阳性菌落提取质粒,酶切鉴定并送测序,测序正确的质粒命名为pMD18-IL-24和pMD18-PTEN。
1.3 构建pIRES-IL-24-PTEN载体
NheⅠ和MluⅠ双酶切pMD18-IL-24质粒和pIRES质粒,胶回收试剂盒分别回收目的片段,使用T4 DNA连接酶16℃过夜连接,连接产物纯化后转化DH5α大肠杆菌,挑取阳性菌株进行酶切鉴定。鉴定正确的菌株提取质粒,用XbaⅠ和NotⅠ双酶切,同时pMD18-PTEN质粒进行XbaⅠ,NotⅠ双酶切,胶回收目的片段,使用T4 DNA连接酶16℃过夜连接,连接产物转化DH5α大肠杆菌,筛选阳性克隆提取质粒进行酶切鉴定,并送测序,测序正确的菌株扩大培养,提取质粒并测OD260和OD280值,检测质粒纯度,同时检测质粒浓度。
1.4 A549细胞的培养和转染
复苏的A549细胞用含10%小牛血清的DMEM培养基于5%CO2、37℃、饱和湿度环境中培养,传2代后将细胞以0.6×105个/孔传代于24孔板,使用无双抗培养基培养,待细胞达到90%~95%融合,按照LipofectamineTM 2000转染试剂盒操作说明,质粒与脂体按1︰2.5比例转染。
1.5 IL-24和PTEN的表达和检测
转染后48 h收集细胞,蛋白裂解液裂解细胞,提取总蛋白,经SDS-PAGE分离后使用Tank法转移至PVDF膜,封闭后分别加入小鼠抗人PTEN抗体和兔抗人IL-24抗体,洗膜,加入HRP标记的二抗,DAB显色。
2 结果
2.1 IL-24和PTEN基因片段的扩增
以pGEX-IL-24质粒和pcDNA3.1-PTEN质粒为模板,用引入双酶切位点的IL-24引物和PTEN引物分别进行PCR扩增。扩增产物经琼脂糖凝胶电泳检测,在约640 bp和1 200 bp处分别得到清晰条带,与IL-24和PTEN基因大小相符。见图1。
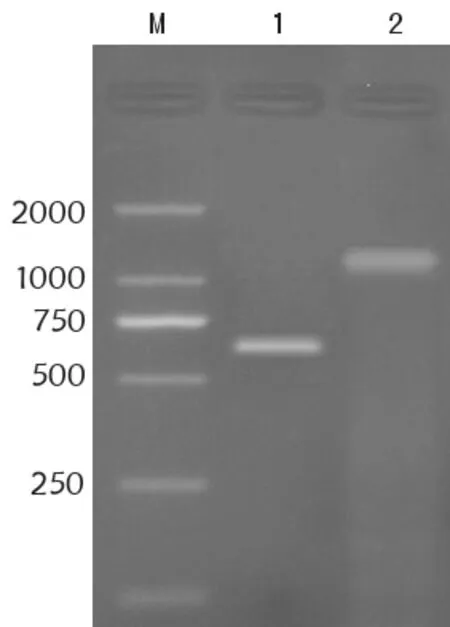
M:DNA marker(DL2000);1:IL-24 PCR产物;2:PTEN PCR 产物图1 琼脂糖凝胶电泳分析IL-24和PTEN基因PCR扩增产物
2.2 pIRES-IL-24-PTEN载体的构建
pIRES载体连接上IL-24和PTEN基因片段后分别进行NheⅠ,MluⅠ双酶切和XbaⅠ,NotⅠ双酶切鉴定,在约640bp处和1 200 bp处得到清晰条带,证明IL-24和PTEN基因片段已连接入载体,pIRES-IL-24-PTEN载体构建成功。见图2。
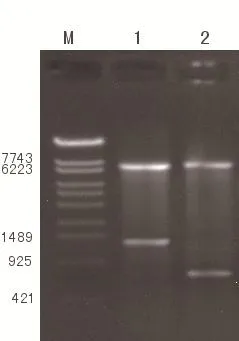
M:DNA marker(λ-EcoT14 I);1:pIRES-IL-24-PTEN经Xba I和Not I双酶切;2:pIRES-IL-24-PTEN经Nhe I和Mlu I双酶切图2 pIRES-IL-24-PTEN酶切电泳鉴定结果
2.3 Western blot检测IL-24和PTEN蛋白的表达
pIRES-IL-24-PTEN载体转染A549人肺癌细胞48 h后,收集细胞,提取总蛋白进行Western blot鉴定。结果可见转染质粒组出现IL-24和PTEN特异性条带和β-actin条带,未转染质粒组未出现IL-24和PTEN条带,只有β-actin条带出现,证明转染pIRES-IL-24-PTEN的A549细胞有IL-24和PTEN蛋白表达。见图3。
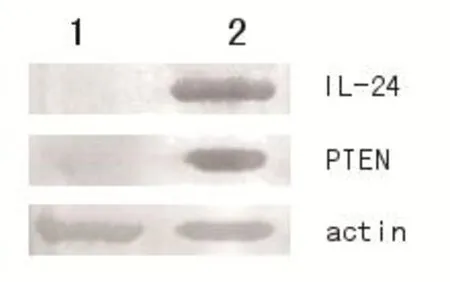
1:未转染pIRES-IL-24-PTEN载体;2:转染pIRES-IL-24-PTEN载体图3 Western blot法鉴定IL-24和PTEN基因在肺癌A549细胞中的表达
3 讨论
IL-24又名黑色素瘤分化相关基因7,具有多种生物学活性,可抑制多种肿瘤细胞生长并诱导其快速凋亡,抑制肿瘤血管生成,抑制肿瘤侵袭和转移,并具有免疫调节功能[4]。研究发现,IL-24通过多种信号通路特异诱导肿瘤细胞凋亡,其中包括:通过激活双链RNA依赖的蛋白激酶(PKR)信号途径,激活其下游因子eIF2α,Tyk2,p38MAPK,阻止细胞内蛋白合成,从而抑制肿瘤细胞生长并诱发凋亡[5];与BiP/GRP78结合,诱发未折叠蛋白反应(Unfolded Protein Response),激活p38 MAPK信号通路,上调GADD基因表达[6];通过改变促凋亡蛋白(Bax,Bad,Bak和 Bcl-xS)和抗凋亡蛋白(Bcl-2,Bcl-xL,Bcl-W,Mcl-1)的比例诱导肿瘤细胞凋亡[7]。
PTEN是一种肿瘤抑制因子,其突变和缺失与多种肿瘤的发生密切相关[8]。细胞内过量表达的PTEN具有抗肿瘤活性,可以通过拮抗PI3K-PKB/AKT信号途径,抑制肿瘤细胞生长,促进其凋亡[9];同时还可以抑制肿瘤细胞的侵袭和迁移并抑制肿瘤血管新生[10]。除此之外,PTEN还具有多种重要的生物学功能,如:PTEN可导致细胞周期阻滞在G0/G1期,说明其具有抑制细胞生长的功能[11];细胞核中PTEN主要维持基因组稳定并与染色质功能相关。研究还发现PTEN定位于着丝粒并与着丝粒蛋白C相结合,从而保持染色体的完整[12]。cDNA微阵列探针研究发现PTEN基因突变的细胞会发生广泛的基因表达谱改变,说明PTEN可能参与基因转录调节[13]。
进一步的cDNA微阵列探针研究发现非小细胞肺癌中由腺病毒介导表达IL-24可引起肿瘤抑制基因PTEN表达增加并抑制PI3K信号途径,说明IL-24和PTEN在信号通路上有关联[14],还需要进一步研究以揭示以上两种抑癌基因的信号通路及相互作用。
内部核糖体进入位点(IRES)来源于病毒和真核细胞mRNA 的5’端非翻译区,具有不依赖于5’帽子结构而募集核糖体并启动下游基因翻译的功能[15]。运用IRES构建双基因或多基因表达载体可以同时研究多种基因的相互作用及功能。本实验运用含有IRES位点的pIRES载体成功构建了pIRES-IL-24-PTEN双表达载体,可用于联合表达IL-24和PTEN基因,为进一步研究其协同抗癌作用及抗癌机理提供了实验基础。
[1] Reed JC.Apoptosis-regulating proteins as targets for drug discovery[J].Trends Mol Med,2001,7(7):314-319.
[2] Pestka S,Krause CD,Sarkar D,et al.Interleukin-10 and related cytokines and receptors[J].Annu Rev Immunol,2004,22:929-979.
[3] Weng L,Brown J,Eng C.PTEN induces apoptosis and cell cycle arrest through phosphoinositol-3-kinase/Akt-dependent and independent pathways[J].Hum Mol Genet,2001,10(3):237-242.
[4] Ramesh R,Ito I,Gopalan B,et al.Ectopic production of MDA-7/IL-24 inhibits invasion and migration of human lung cancer cells.[J].Mol Ther,2004,9(4):510-518.
[5] Pataer A,Vorburger SA,Barber GN,et al.Adenoviral transfer of the melanoma differentiation-associated gene 7 (mda7) induces apoptosis of lung cancer cells via up-regulation of the double-stranded RNA-dependent protein kinase(PKR)[J].Cancer Res,2002,62(8):2239-2243.
[6] Gupta P,Walter MR,Su ZZ,et al.BiP/GRP78 is an intracellular target for MDA-7/IL-24 induction of cancer-specific apoptosis[J].Cancer Res,2006,66(16):8182-8191.
[7] Lebedeva IV,Sarkar D,Su ZZ,et al.Bcl-2 and Bcl-x(L) differentially protect human prostate cancer cells from induction of apoptosis by melanoma differentiation associated gene-7,mda-7/IL-24 [J].Oncogene, 2003,22(54):8758-8773.
[8] Li J,Yen C,Liaw D,et al.PTEN, a putative protein tyrosine phosphatase gene mutated in human brain, breast,and prostate cancer[J].Science,1997,275(5308):1943-1947.
[9] Weng L,Brown J,Eng C.PTEN induces apoptosis and cell cycle arrest through phosphoinositol-3-kinase/Akt-dependent and –independent pathways[J].Hum Mol Genet,2001,10(3):237-242.
[10] Salmena I,Carracedo A,Pandolfi PP.Tenets of PTEN tumor suppression[J].Cell,2008,133(3):403-414.
[11] Ginn-Pease ME,Eng C.Increased nuclear phosphatase and tensin homologue deleted on chromosome 10 is associated with G0-G1 in MCF-7 cells[J].Cancer Res,2003,63(2):282-286.
[12] Shen WH,Balajee AS,Wang J,et al.Essential role for nuclear PTEN in maintaining chromosomal integrity[J]. Cell,2007,128(1):157-170.
[13] Matsushima-Nishiu M,Unoki M,Ono K,et al.Growth and gene expression profile analyses of endometrial cancer cells expressing exogenous PTEN[J].Cancer Res,2001,61(9):3741-3749.
[14] Mhashilkar AM,Stewart AL,Sieger K,et al.MDA-7 negatively regulates the beta-catenin and PI3K signaling pathways in breast and lung tumor cells[J].Mol Ther,2003,8(2):207-219.
[15] Vagner S,Galy B,Pymnnet S.Irresistible IRES Attracting the translation machinery to intemal ribosome entry sites[J].EMBO Rep,2001,2(10):893-898.

