康艾注射液和苦参素注射液对不同肿瘤细胞增殖的抑制作用
黄素培(新乡医学院第二附属医院药剂科,河南新乡 453002)
康艾注射液为我国独立研制的新一代抗恶性肿瘤中成药,由人参、黄芪、苦参素三味中药组方制成,对原发性肝癌、直肠癌和妇科肿瘤等有较好疗效。康艾注射液的主要成分为氧化苦参碱(oxymatrin,OMT),又称“苦参素”,是我国草药中有效成分被纯化的“三素”(另有黄连素、青蒿素)之一。近年来,对其抗肿瘤作用的基础研究充分显示OMT和其活性代谢物苦参碱(matrine,MT)抑制肿瘤细胞增殖、转移和表达[1-5],可能与含OMT的复方康艾注射液的抗肿瘤作用有关。但康艾注射液抗肿瘤作用的主要成分及作用机制目前尚不明确,且无研究报道。因此为更深入探讨康艾注射液抗肿瘤作用的主要成分及作用机制,我们对康艾注射液和其主要有效成分苦参素对不同肿瘤细胞增殖的抑制作用进行了对比研究,为揭示康艾注射液的科学内涵提供一定的依据。
1 仪器与材料
1.1 仪器
HERA细胞培养箱(德国heraeus公司产品,HERA Cell型);台式离心机(德国Heraes公司,Biofuge Stratos型);酶联免疫检测仪(奥地利Tecan公司产品,GeNios DNA Expert型);蒸汽消毒器(山东安得医疗科技有限公司产品,YXQG02型); Milli-Q超纯水制造系统(德国 Millipore公司产品,Milli-Q.SYNTHESIS型);OLYMPUS倒置显微镜(日本奥林巴斯光学工业株式会社产品,PM-10AD型);医用净化工作台(苏净集团苏州安泰空气技术有限公司产品,SWJ-1F型)。
1.2 材料
HO-8910细胞购自中国科学院上海细胞所;HyQ改良型RPMI 1640培养基(海克隆生物化学制品有限公司提供);胎牛血清(杭州四季青生物制品有限公司提供);胰酶(美国Amersco公司生产);注射用青霉素钠(山东潍坊制药厂生产);硫酸链霉素(大连美罗大药厂生产);康艾注射液(长白山制药股份有限公司生产);苦参素注射液(200 mg,山东方明药业股份有限公司生产);二甲基亚砜(DMSO,天津瑞金特化学品有限公司提供);氯丁胶新型交联剂(MTT,Sigma公司提供);96孔细胞培养板(Corning,NY 1483)。
2 方法
2.1 细胞株的复苏及传代培养
将装有人胃癌SGC-7901细胞的冻存管从液氮罐中取出,快速放入37℃恒温水锅中解冻。待完全解冻后,用吸管吸取含细胞的冻存液置无菌离心管,放入离心机1 500 rpm离心5 min,弃上清液。加入磷酸盐缓冲液(PBS)液洗涤,1 500 rpm离心5 min,弃上清液,重复2次。向冻存管中加入含10%胎牛血清的RPMI 1640培养液,用吸管轻轻吹打细胞。将细胞悬液移入培养瓶,加入适量含10%胎牛血清和1%双抗的培养液。将培养瓶放入培养箱37℃,5%CO2培养,次日观察细胞贴壁情况,酌情换液。培养2~3 d后对生长良好HO-8910细胞,按贴壁细胞传代要求用胰酶消化后制成单细胞悬液分瓶传代,继续培养。人大肠癌细胞株HCT-8、人卵巢癌细胞株HO-8910的复苏与上述人胃癌SGC-7901细胞的复苏方法类似。人白血病细胞株K-562按照悬浮细胞的复苏及传代要求复苏后制成单细胞悬液分瓶传代,继续培养。
2.2 不同瘤株药敏试验
取含5×104个/mL的HO-8910细胞悬液100 μL接种于96孔培养板,5%CO2培养箱孵育24 h后,分别加入苦参素注射液,使其终浓度为0.25、0.5、1.0、2.0、4.0 g·L-1,加RPMI 1640培养液至200 μL,另设空白孔(只加培养液200 μL)和对照孔(只加细胞悬液200 μL),每浓度均作6个平行孔,5% CO2培养箱孵育72 h后,加入20 μL MTT(5 mg·mL-1),37℃,5%CO2培养箱孵育4 h后,弃上清,每孔加入DMSO 200 μL,放入酶标仪,中速振荡5 min后,于570 nm波长处测定吸光度A值,每个浓度平行测定6孔。按下列公式求出生长抑制率(inhibition ratio,IR)。抑制率IR(%)=(1-实验组平均A值/空白对照平均A值)×100%。
按上述方法测定苦参素对人大肠癌HCT-8细胞、人胃癌SGC-7901细胞的抑制率,用IC50计算软件计算IC50。K-562细胞按上述方法处理至加 MTT温孵4 h后,1 500 rpm离心5 min,吸弃上清,再按上述步骤加入DMSO溶解后测其光密度值,计算抑瘤率及IC50。
2.3 单方和复方的抑瘤活性比较
取含5×104个/mL的HO-8910细胞悬液100 μL接种于96孔培养板,5%CO2培养箱孵育24 h后,分别加入康艾注射液(按OMT的含量算)和苦参素注射液,使其终浓度为0.25、0.5、1.0、2.0、4.0 g·L-1,加RPMI 1640培养液至200 μL,另设空白孔(只加培养液200 μL)和对照孔(只加细胞悬液200 μL),每浓度均作6个平行孔,5%CO2培养箱孵育72 h后,加入20 μL MTT(5 mg·mL-1),37℃,5%CO2培养箱孵育4 h后,弃上清,每孔加入DMSO 200 μL,放入酶标仪,中速振荡5 min后,于570 nm波长处测定吸光度A值,每个浓度平行测定6孔。按公式计算出IR。
2.4 细胞形态学观察
根据MTT实验结果,选择对肿瘤细胞抑制作用较强的浓度,分别加入半数抑制浓度的剂量,作用48 h,倒置显微镜下观察,摄片。同时用无药的培养液处理设对照。
3 结果
3.1 药物浓度和抑瘤效应
苦参素注射液和康艾注射液对HCT-8、K-562、HO-8910、SGC-7901的抑瘤率均随浓度的增高而增强,见表1。Pearson相关性检验结果显示,苦参素和康艾注射液的浓度与其对HCT-8、K-562、HO-8910、SGC-7901抑瘤率均呈正相关,其相关系数r分别为:0.935、0.933、0.942、0.952和0.947、0.915、0.953、0.964。
3.2 不同瘤株药敏性差异
苦参素注射液和康艾注射液对HCT-8、K-562、HO-8910、SGC-7901的 IC50分别为:1012.03、719.28、681.64、1 034.15 mg·L-1和905.99、764.10、686.27、995.52 mg·L-1,不同肿瘤细胞对同一药物的敏感性存在较大差异,苦参素和康艾对HO-8910细胞相对较为敏感。
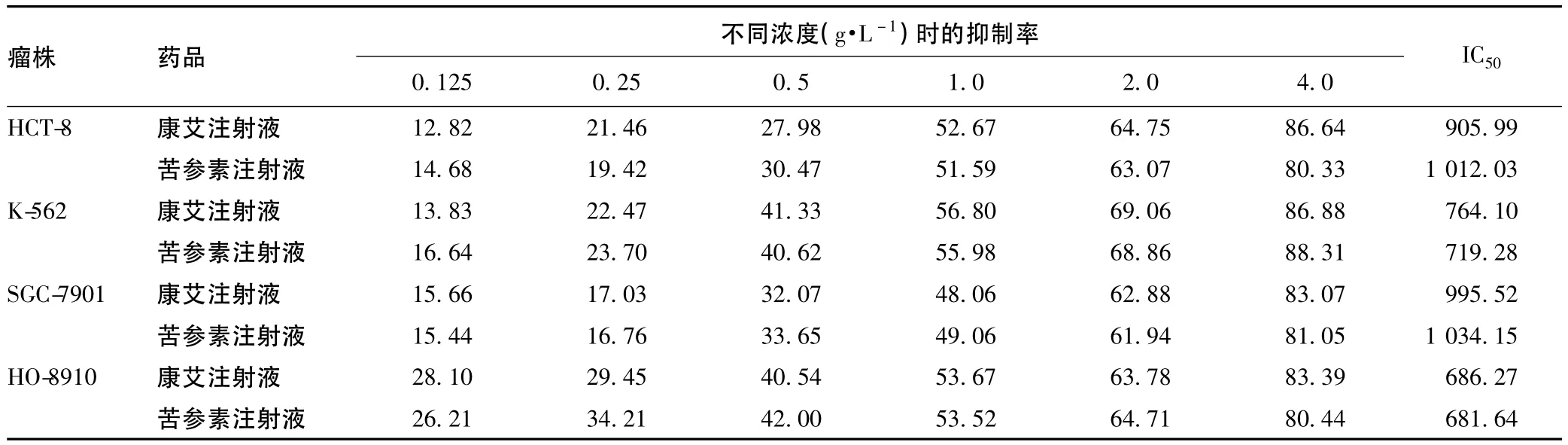
表1 苦参素注射液和康艾注射液对不同瘤株的抑制率(%)Tab 1 Inhibitory effects of Kushenin and Kangai injection on different tumor cells(inhibition ratio,%)
3.3 单方和复方抑瘤活性比较
配对t检验结果显示,相同浓度的苦参素注射液和康艾注射液体外对体外培养的肿瘤细胞增殖的抑制作用无显著性差异(P>0.05),结果提示氧化苦参碱即苦参素可能为复方康艾注射液中直接抑制肿瘤细胞增殖的主要有效成分。
3.4 给药后细胞的形态差异
接种24 h后,在普通倒置相差显微镜下观察到HCT-8、HO-8910、SGC-7901细胞基本都贴壁,K-562细胞饱满,边沿清晰。换液、加苦参素后逐日观察,发现苦参素作用下的HCT-8、HO-8910、SGC-7910细胞均逐渐变圆,体积变小,折光性减弱,细胞变粗糙,贴壁细胞减少,细胞形态为三角形、多边形和圆形,出现悬浮细胞,而且作用时间越长,现象越明显。当药物作用2 d后,苦参素作用组的细胞多数脱落,悬浮于培养液中,有少数细胞体积增大,细胞破裂,呈细胞坏死状。对照组细胞生长正常,细胞边缘清晰,贴壁细胞几乎无悬浮细胞,K-562细胞饱满,边沿清晰,形态正常,见图1~4。

图1 对照组与K-562细胞药物处理组细胞形态学Fig 1 Cell morphology of control and drug treated K-562cellsA对照组;B药物处理组A control cells;B drug treated cells

图2 对照组与HCT-8细胞药物处理组细胞形态学Fig 2 Cell morphology of control and drug treated HCT-8 cellsA对照组;B药物处理组A control cells;B drug treated cells

图3 对照组与SGC-7901细胞药物处理组细胞形态学Fig 3 Cell morphology of control and drug treated SGC-7901 cellA对照组;B药物处理组A control cells;B drug treated cells

图4 对照组与HO-8910细胞药物处理组细胞形态学Fig 4 Cell morphology of control and drug treated HO-8910 cellA对照组;B药物处理组A control cells;B drug treated cells
4 讨论
4.1 实验方法
MTT法是在1983年,由Mosmann首先建立的,因其快速、简便、重复性好、可半自动操作,逐年来在国内外的实验研究中被广泛采用,主要用于一些生物活性检测、抗肿瘤药物筛选、细胞毒性实验及肿瘤放射敏感性测定等[6]。MTT法在检测抗肿瘤药物对肿瘤细胞增殖的抑制作用时具有灵敏性高、结果重复性好、操作简便、经济、快速、可批量检测样品等特点,因此,在本课题中我们选择MTT法来检测目标药物对细胞生长、增殖的抑制作用。研究表明,MTT甲臜产物的吸收光谱在DMSO溶液中有两个峰,低峰为420 nm,高峰为560 nm左右,同时也有许多研究报告表明[7],MTT与细胞在37℃孵育4h后形成的MTT甲臜产物的最大吸收波长为570 nm,本实验显示MTT与实验所用肿瘤细胞在37℃孵育4 h后形成的MTT甲臜产物的最大吸收波长约为570 nm,因而本实验采用的酶标仪滤光片波长为570 nm。
4.2 药敏试验用瘤株
资料显示[8],不同的肿瘤细胞对药物的敏感性存在很大的差异,这种差异直接影响试验的结果,所以选择敏感瘤株进行药敏试验显得至关重要。本实验根据文献资料分别选用HO-8910、K-562、Hct-8、SCG-7901细胞进行了试验用瘤株筛选试验,结果显示不同的肿瘤细胞株对同一药物的敏感性不同,特定的药物试验中选择敏感瘤株显得至关重。
4.3 单方和复方
根据中药配伍理论,由于药物性质各有不同,配合后可发生各种变化,有的可以加强疗效,有的可以降低疗效。这就是中医中的“相恶”、“相杀”、“相须”、“相使”理论。康艾注射液为新一代纯中药注射液,除苦参素外,还含有从黄芪及人参中提取出的多种化学成分,其各成分在该复方中的发挥抗肿瘤作用效应机制及途径尚不明确,但根据中医理论,苦参素为该复方中的“君药”,可能为其直接抑瘤的主要成分。为此,我们对康艾注射液和苦参素注射液对不同肿瘤细胞增殖的抑制作用进行了对比分析,结果发现,康艾注射液和苦参素注射液体外的抑瘤作用无显著性差别,由此我们推测苦参素可能为康艾注射液在体外发挥直接抑瘤作用的主要物质。复方中的其他成分可能通过不同的途径和机制增强其抗肿瘤作用。
[1] Song MQ,Zhu JS,Chen JL,et al.Synergistic effect of oxymatrine and angiogenesis inhibitor NM-3 on modulating apoptosis in human gastric cancer cells[J].World J Gastroenterol,2007,13(12):1788-1793.
[2] 万旭英,罗 明,贺 平,等.苦参碱和氧化苦参碱体外对人肝癌细胞的诱导分化作用[J].中国药理学通报,2009,25(7):977-979.
[3] 赵军艳,郑艳敏,赵红艳,等.苦参碱和氧化苦参碱对肝癌细胞增殖凋亡及JAK-STAT信号通路的影响[J].中药药理与临床,2008,24(4):18-20.
[4] 胡 劲,杨 乐,何雪心,等.氧化苦参碱对喉癌细胞株Hep-2抑制增殖及诱导凋亡的实验研究[J].山东医药,2007,47(32):21-23.
[5] 郭启帅,黄 曦,李少林.苦参碱诱导卵巢癌SKOV_3细胞凋亡的机制研究[J].中国药理学通报,2010,26 (8):1104-1107.
[6] 杨翠云,刘永定.MTT方法评价微生物细胞活性的探讨[J].水生生物学报,2009,33(4):577-580.
[7] 赵嘉惠,张华屏,王春芳.MTT法在检测细胞增殖方面的探讨[J].山西医科大学学报,2007,38(3):262-263.
[8] 秦莉莉,金 毅,龙亚秋,等.5,8-二取代喹唑啉类化合物LJK-11对HER2高表达肿瘤细胞的作用和分子机制初探[J].沈阳药科大学学报,2007,24(1):53-60.

