4种芽孢杆菌来源木聚糖酶基因在大肠杆菌中的表达及酶活分析
焦志华徐娥陆平李卫芬
(1.浙江大学动物科学学院,浙江杭州310058;2.贵州大学动物科学学院,贵州贵阳550025)
木聚糖酶在饲料、造纸、食品、能源工业和环境科学上都有着十分广阔的用途,在饲料中添加木聚糖酶可以降解植物细胞壁,有利于动物的消化和吸收,提高饲料的利用率;木聚糖酶还可以降解可溶性多糖,降低其黏稠性,减少畜禽的肠道疾病,提高畜禽的成活率,同时还能减少环境污染。郝瑞英等[1]研究表明,断奶仔猪低磷饲粮中添加木聚糖酶能增加钙、磷的利用率,促进骨骼生长。俞沛初等[2]研究表明,添加木聚糖酶可显著提高仔猪对能量、粗蛋白质、粗脂肪、粗纤维等的表观消化率,同时结果还表明,添加外源酶可使仔猪肠道某些内源性消化酶的分泌量增加。徐骏等[3]研究表明,添加0.05%木聚糖酶能提高试验组仔鸡增重,降低料重比。
木聚糖酶广泛存在于动物、植物和微生物中,不同来源的木聚糖酶在结构和性质上有很大的差别。微生物是木聚糖酶的重要来源,它产生的木聚糖酶具有活力高、成本低、来源稳定、提取方便等明显优点,但是天然菌株产生木聚糖酶的量较低,限制了其在工业上的应用。当前研究的热点是通过基因工程将木聚糖酶基因进行外源表达,以提高木聚糖酶的产量,解决其在应用中的瓶颈问题。目前已有很多微生物的木聚糖酶基因被克隆测序并进行了异源表达[4-5],其中细菌木聚糖酶主要来自于芽孢杆菌属,如环状芽孢杆菌(B.cirxulans WL-12)[6]、枯草芽孢杆菌(B.subtilis)[7]、嗜热脂肪芽孢杆菌(B.stearothermopHilus T-6)[8]等,但是由于表达系统的差异,无法进行表达量和木聚糖酶性质的综合比较。因此,有必要对不同来源的芽孢杆菌木聚糖酶基因在同一表达系统中表达,然后对各表达产物的酶活、最适反应温度及耐热性进行分析比较,以期寻找能在大肠杆菌中稳定表达,并能产生高活性、耐高温的木聚糖酶的基因,为工业上大量生产木聚糖酶提供依据。
1 材料与方法
1.1 菌株、载体与主要试剂
浸麻芽孢杆菌(B.macerans)B3株、地衣芽孢杆菌(B.licheniformis)B6株、蜡样芽孢杆菌(B.cereus)B10株和枯草芽孢杆菌(B.subtilis)B12株、克隆宿主菌E.coli TOP10和表达宿主菌E.coli BL21(DE3)均由作者所在实验室保存;表达载体pET-30a(+)购自Invitrogen公司;pUCm-T vector购自Promega公司;木聚糖购自Sigma公司;X-Gal、IPTG、T4 DNA连接酶、TaqDNA聚合酶和各种限制性内切酶购自TaKaRa公司(大连);DNA Marker购自MBI公司(Maryland);质粒提取试剂盒、PCR清洗试剂盒、割胶回收试剂盒购自上海生物工程公司。
1.2 木聚糖酶基因的PCR扩增
参照GenBank上B.subtilis和B.cirsulans木聚糖酶基因的序列,用软件Primer5.0设计了一对引物,序列为:
上游引物(5PX):5'-AGGGGATCCATGTTTAAGTT TAAAAAGAAT-3';
下游引物(3PX):5'-GATCTCGAGTTACCACACTGTTACGTTA-3',分别加入BamHⅠ和XhoⅠ,由上海生物工程公司合成。
分别以B.macerans B3株、B.licheniformis B6株、B.cereus B10株和B.subtilis B12株为模板进行PCR扩增。PCR反应体系为:10×PCR缓冲液(含Mg2+)5.0 μl;dNTP(10 mM)1.0 μl;引物各1.0 μl;模板DNA 1.0 μl;Ex Taq 0.5 μl,加水至50 μl。PCR反应条件为:首先94℃预变性5 min;然后94℃变性40 s,55℃退火50 s,72℃延伸1 min,反应进行30个循环;最后72℃延伸10 min。用琼脂糖凝胶电泳进行初步鉴定。
1.3 4种木聚糖酶基因的克隆及测序
分别割胶回收4个目的基因片段,并与pUCm-T vector连接,阳性克隆送往上海博亚生物公司进行测序,用DNA tool 5.0软件进行分析,并在网上进行同源分析,通过scanprosite服务器分析酶家族。阳性克隆子命名为pUCm-T-xyl-BX,其中X区分4种木聚糖酶基因。
1.4 重组表达质粒及基因工程菌的构建
将提取的质粒pUCm-T-xyl-BX与载体pET-30a(+)分别用BamHⅠ和XhoⅠ双酶切,xylBX片段插入到pET-30a(+)的相应位点,分别得到重组质粒pET-30-xyl-BX。将重组质粒转化至E.coli BL21(DE3)感受态细胞,得到相应的工程菌BL21-xyl-BX。
1.5 目的蛋白表达
挑取单菌落接种于2.0 ml含100 μg/ml卡那霉素的LB液体培养基中,37℃150 r/min振摇培养过夜,取1 ml菌液转接于50 ml含卡那霉素的LB中,150 r/min振摇培养至OD600到0.6左右,加入IPTG至终浓度为1 mmol/l,诱导培养6 h。
1.6 目的蛋白质的SDS-PAGE鉴定
取1.0 ml菌液4℃离心菌液收集菌体,用80.0 μl磷酸盐缓冲液悬浮,加入20.0 ml 5×SDS-PAGE上样缓冲液裂解,沸水浴变性处理10 min,4℃、10 000 r/min离心10 min,取上清液10 μl进行SDS-PAGE凝胶电泳。
1.7 木聚糖酶学特性
诱导表达后,收集菌体并超声破碎,破碎液4℃、10 000 r/min离心10 min,取上清液为粗酶液,用于酶活力测定和酶学特性分析。参照Miller等[9]文献,采用DNS法测定木聚糖酶活。
在试管中加入1 000 μl浓度为0.5%的木聚糖底物,预热5 min,然后加入粗酶液100 μl,55℃准确反应10 min,加入500 μl DNS溶液终止反应,沸水浴5 min,冷却后于540 nm处比色,测定OD值。根据木聚糖酶活测定标准曲线计算4种木聚糖酶的酶活。
水波相送,古道相迎,粉墙静立,青砖不语,关于这座古镇的印象,尚等细读拾取。春江水暖、雁字回时再重游,好好感受古镇清晨的寂静,午后黄昏的纷华,蓝天碧水的映衬,霓虹灯影的点缀……其实已沉醉在千年古镇的桨声灯影里。
酶活力单位(U)定义:每秒钟水解木聚糖底物产生1 μmol木糖的酶量为1个木聚糖酶活力单位。
木聚糖酶的最适温度及热稳定性的测定方法参照Luo等[10]文献,在40~90℃范围内,每隔10℃设定1个反应温度,调节pH值7.0,反应10 min后,分别测定4种重组木聚糖酶在各温度下的酶活。不同木聚糖酶分别以各自在不同温度下的最高酶活为100%计算相对酶活,由此确定4种不同木聚糖酶的最适温度。
酶热稳定性测定:4种不同酶液分别在40、50、60、70、80℃处理20 min,立即冰浴,然后测定残余酶活性,以未处理酶样活性为100%。
2 结果
2.1 目的基因的克隆和序列分析
经过PCR扩增,琼脂糖凝胶电泳结果如图1所示,4个PCR扩增产物在650 bp左右均有一条特异条带,与预期大小一致。
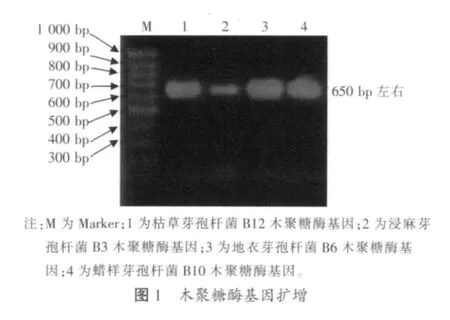
测序结果表明,4个木聚糖酶基因大小均为642 bp。经BLAST相似性分析后,结果显示,浸麻芽孢杆菌B3株的木聚糖酶基因、地衣芽孢杆菌B6株的木聚糖酶基因和蜡样芽孢杆菌B10株的木聚糖酶基因与已登录的枯草芽孢杆菌木聚糖酶基因(登录号为U51675、X59058和AF490979)序列相似性都在90%以上。枯草芽孢杆菌B12与已登录的枯草芽孢杆菌木聚糖酶基因(登录号为Z99114、AF02786和M36648)序列完全一样。其中除枯草芽孢杆菌B12木聚糖酶基因外,其他3个木聚糖酶基因均首次报道。
通过网上Clustal W软件对4种木聚糖酶基因序列进行比对,结果显示,这4个基因序列相互间的同源性在92%~98%间,其中,浸麻芽孢杆菌和枯草芽孢杆菌木聚糖酶基因的同源性最低,为92%。同样,对4种芽孢杆菌木聚糖酶基因的推译氨基酸序列进行比对发现,这些氨基酸序列的同源性都在95%以上,其中浸麻芽孢杆菌和枯草杆菌及蜡样芽孢杆菌之间的同源性最低,为95%(如图2)。

Scanprosite分析各木聚糖酶基因编码的氨基酸序列,发现4种酶均属于糖苷键水解酶11家族,都具有特征活性位点序列PLIEYYVVDSW(103~113),蜡样芽孢杆菌和枯草芽孢杆菌木聚糖酶还具有该家族的另一个特征序列MATEGYQSSGSS(197~208)。
2.2 木聚糖酶SDS-PAGE分析(见图3)
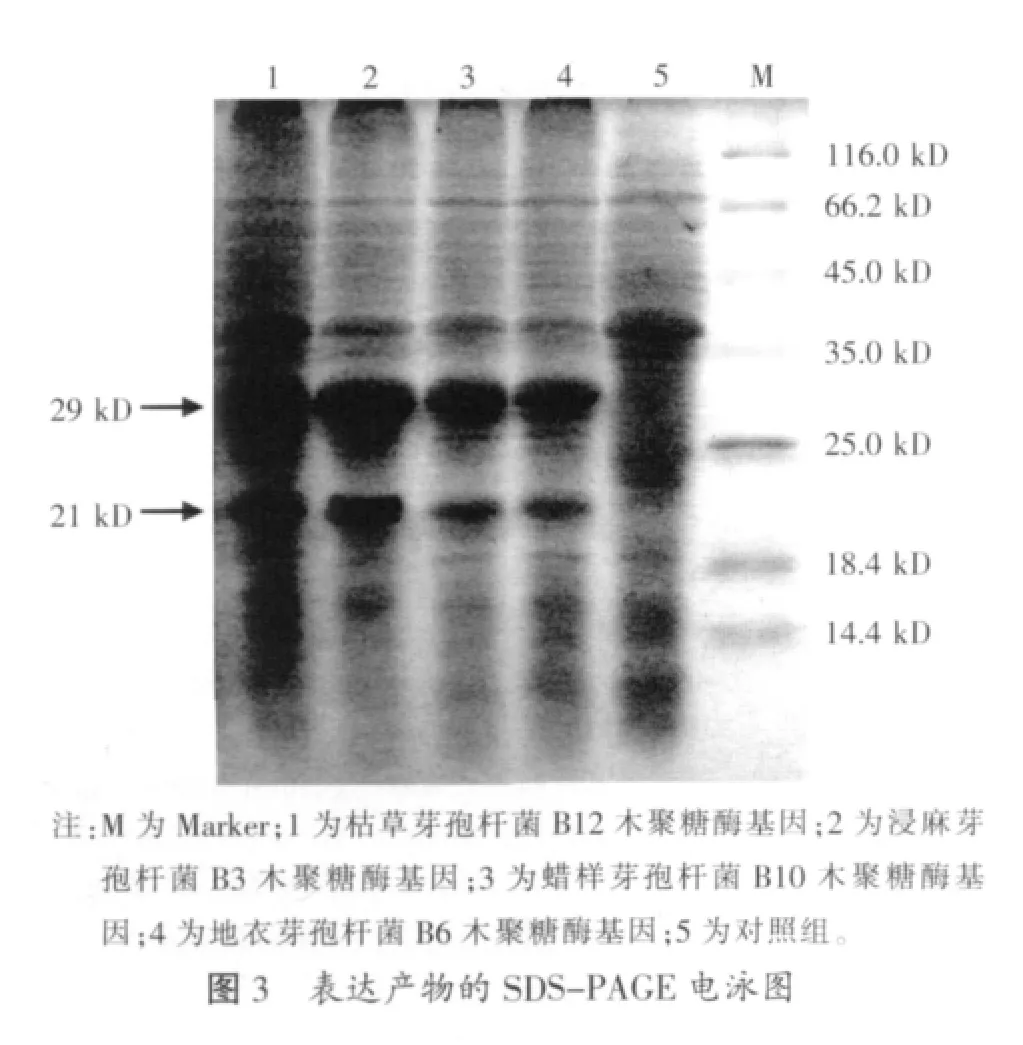
2.3 重组木聚糖酶的性质
2.3.1 重组木聚糖酶的酶活
4种重组酶工程菌经IPTG诱导表达后在55℃条件下测得的木聚糖酶活力差异较大,其中枯草芽孢杆菌木聚糖酶活力最高,达到98.98 U/ml,其它依次为:浸麻芽孢杆菌为36.16 U/ml,蜡样芽孢杆菌为7.22 U/ml,地衣芽孢杆菌为3.85 U/ml。
地衣芽孢杆菌和短芽孢杆菌木聚糖酶氨基酸序列同源性为100%,而短芽孢杆菌木聚糖酶的酶活力为地衣芽孢杆菌木聚糖酶的6.8倍,分析原因,两者基因序列的同源性为98%,其中地衣芽孢杆菌木聚糖酶基因中有较多相对于表达宿主而言的稀有密码子,如编码木聚糖酶的第92位氨基酸残基Gly的密码子在地衣芽孢杆菌和短芽孢杆菌中分别为GGA和GGG,其中前者为稀有密码子。
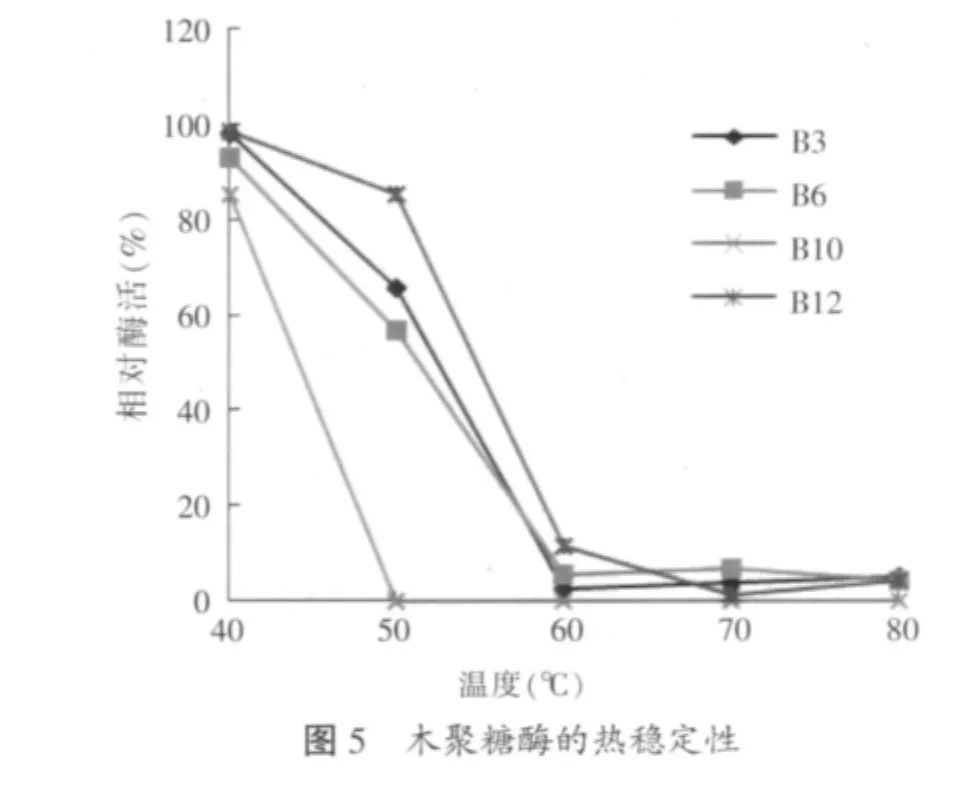
2.3.2 重组木聚糖酶的最适温度和热稳定性(见图4~图5)
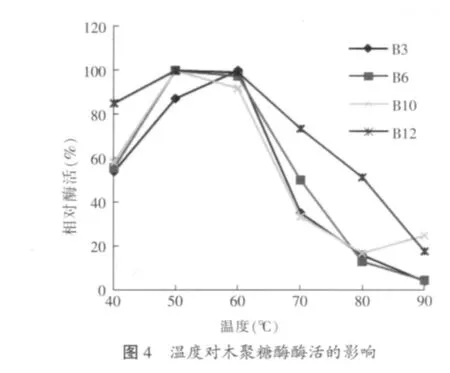
由图4可知,4种重组酶的最适反应温度均在50~60℃之间,当反应温度低于50℃时,4种酶相对酶活力均较稳定;当反应温度高于60℃,4种酶相对酶活力均迅速下降,但枯草芽孢杆菌木聚糖酶的相对酶活力始终高于其它3种酶,在70℃时,枯草芽孢杆菌木聚糖酶相对酶活力为73.6%,而浸麻芽孢杆菌、地衣芽孢杆菌和蜡样芽孢杆菌木聚糖酶的相对酶活力分别为35.2%、50%和33.3%。
由图5可知,除蜡样芽孢杆菌木聚糖酶外,其它3种木聚糖酶的相对耐热温度均为50℃。蜡样芽孢杆菌木聚糖酶经50℃处理20 min完全失活,其它3种木聚糖酶中枯草芽孢杆菌木聚糖酶残余相对酶活力最高,为85%,浸麻芽孢杆菌木聚糖酶残余相对酶活为65%,地衣芽孢杆菌木聚糖酶残余相对酶活最低,为56.6%。当温度高于60℃时,其他3种酶的相对酶活力均迅速下降,其中枯草芽孢杆菌木聚糖酶相对来说最为耐热。
3 讨论
木聚糖酶具有重要的工业应用价值,在饲料、食品、酿酒、医学、纺织、造纸、环境和能源等领域应用广泛。特别是在饲料工业中,木聚糖酶能有效地提高饲料利用率。自然界中分离出的能够产木聚糖酶的微生物大多存在着复杂的酶系,使得木聚糖酶的分离纯化比较困难。目前应用较多的是通过基因工程将木聚糖酶基因连接到合适的载体上并转化到相应的宿主菌中,这样可以简化木聚糖酶纯化过程[11]。
大肠杆菌表达系统由于具有培养条件简单、操作工艺成熟、培养周期短、蛋白表达量大等优点[12],仍是目前应用最普遍的一种表达系统。但是大肠杆菌表达系统所表达的外源蛋白通常以包涵体的形式存在。研究认为,包涵体形成可能是木聚糖酶自身氨基酸序列的缘故,折叠时不能迅速被大肠杆菌识别,导致翻译后的多肽链聚集成包涵体[13]。目前,已有多种方法用来解决蛋白过量表达时出现的包涵体的问题,如共表达分子伴侣、降低表达温度、分泌到胞外培养基或周质空间等[14]。有研究报道,氨基酸突变能增加重组蛋白的可溶性[15],本实验室的后续研究会在这方面进行尝试。
不同来源的木聚糖酶主链聚合度不同,支链残基的种类、数量、长度以及在主链上的结合位点不同,所以有不同类型的木聚糖酶。从分子角度来讲,这通常是由多个基因表达为几种同工酶的形式,也可能是由单个基因通过表达后修饰产生多个不同产物所致。这些表达后修饰包括mRNA的剪切,翻译后蛋白的糖基化、酰基化修饰以及亚基的聚合等。目前,许多生产中都离不开嗜极性木聚糖酶(包括嗜热、嗜碱和嗜酸等),如在食品工业中,很多加工都需要热处理,这就要求木聚糖酶在较高的温度下仍有较高的酶活;在造纸工业中,纸浆漂白环境为碱性,木聚糖酶需要在高pH值的环境下依然能保持较高的活性[16]。为使木聚糖酶更加高效地应用于生产中,一方面可以从一些耐极性细菌中筛选木聚糖酶基因进行外源表达;另一方面可以通过基因工程手段进行修饰,使得表达后的木聚糖酶具有耐热、耐酸碱等性质。许多真菌产酸性木聚糖酶普遍存在糖基化现象,如Talaramyces byssochiamydoides YH-50等,通常认为,糖基化与酶抵御极端环境、维持其稳定性有关[17]。另外,可以通过在蛋白质的N末端附近一个残基的置换和嵌合改变,引入二硫桥,使木聚糖酶的稳定性得到很大的提高,同时使在碱性条件下作用的pH值范围也得到了扩展[17]。
4 结论
本研究对4种不同木聚糖酶基因在同一宿主菌中进行外源表达,并测定比较了表达产物的酶活、最适反应温度及耐热性等。试验结果显示,枯草芽孢杆菌木聚糖酶在大肠杆菌中表达后的酶活、最适温度、耐热性相对较好。后续试验可以通过上述其他手段提高木聚糖酶的表达量、酶活及耐极性等。
[1] 郝瑞英,高俊杰.植酸酶和木聚糖酶对仔猪钙磷代谢及骨骼发育的影响[J].饲料博览,2009(6):1-5.
[2] 俞沛初,徐建雄,张荣.低能量日粮中添加非淀粉多糖酶对仔猪生长性能的影响[J].中国饲料,2005(11):9-11.
[3] 徐骏,袁华根,高峰.小麦日粮中添加木聚糖酶对肉仔鸡生长性能的影响[J].饲料研究,2007(4):70-72.
[4] Subramaniyan S,Prema P.Biotechnology of microbial xylanases:enzymology,molecular biology,and application[J].Crit.Rev.Biotechnol.,2002,22(1):33-64.
[5] Collins T,Gerday C,Feller G.Xylanases,xylanase families and extremophilic xylanases[J].FEMS Microbiol.Rev.,2005,29(1):3-23.[6]Esteban R,Villanueva J R,Villa T G.β-D-Xylanases of Bacillus circulans WL-12[J].Canadian Journal of Microbiology,1982,28(7):733-739.
[7] Bernier R,Desrochers M,Jurasek L,et al.Isolation and Characterization of a Xylanase from Bacillus subtilis[J].Appl.Environ.Microbiol.,1983,46(2):511-514.
[8] Khasin A,Alchanati I,Shoham Y.Purification and characterization of a thermostable xylanase from Bacillus stearothermophilus T-6[J].Appl.Environ.Microbiol.,1993,59(6):1725-1730.
[9] Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical chemistry,1959,31(3):426-428.
[10] Luo H Y,Wang Y,Li J,et al.Cloning,expression and characterization of a novel acidic xylanase,XYL11B,from the acidophilic fungus Bispora sp mey-1[J].Enzyme and microbial technology,2009,45(2):126-133.
[11] 周晨妍,李东峰,邬敏辰,等.木聚糖酶XynⅡ的D37N突变、表达及酶学性质变化[J].生物加工过程,2008,6(3):62-67.
[12] 薛业敏,曹建平,毛忠贵,等.木聚糖酶基因在大肠杆菌中的表达及表达蛋白的纯化[J].无锡轻工大学学报,2003,22(3):57-61.[13]殷尔康.木聚糖酶基因Xyn A在大肠杆菌中的高效表达[J].现代农业科技,2011(12):326-327.
[14] Choi J H,Lee S Y.Secretory and extracellular production of recombinant proteins using Escherichia coli[J].Appl.Microbiol.Biotechnol.,2004,64(5):625-635.
[15] Dale G E,Broger C,Langen H,et al.Improving protein solubility through rationally designed amino acid replacements:solubilization of the trimethoprim-resistant type S1 dihydrofolate reductase[J].Protein Eng.,1994,7(7):933-939.
[16] 黄六莲,陈礼辉,张建春,等.碱性木聚糖酶在中小径竹KP浆漂白中的应用[J].林业科学,2007,43(3):96-102.
[17] Kulkarni N,Shendye A,Rao M.Molecular and biotechnological aspects of xylanases[J].FEMS Microbiol.Rev.,1999,23(4):411-456.

