微生物燃料电池在固体废物堆肥中的应用进展
崔晋鑫,王鑫,唐景春
南开大学环境科学与工程学院 环境污染过程与基准教育部重点实验室,天津 300071
当今世界面临着最为严重而紧迫的两大问题:一是日益恶化的生存环境,另外就是濒临枯竭的化石能源。近年来迅速发展的科学技术当中,微生物燃料电池 (Microbial fuel cell,MFC)就是一种将处理污染和产生能量相结合的绿色产能技术。MFC是利用微生物为催化剂,将生化降解有机物质过程产生的能量,转化为电能[1],已在小分子有机酸、醇类、糖类、氨基酸和蛋白质、难降解有机物、有机废水等中得到成功应用[2]。而且研究发现,利用 MFC处理有机废水会产生一些特殊的处理功效,例如可以提高微生物对某些有机污染物如吡啶的降解能力[3],阴阳电极之间离子的转移可以实现生物脱盐等[4-6]。另外有学者在固体介质如土壤、底泥中应用MFC技术,发现植物生长过程中根系分泌物对微生物的刺激作用可以使电流输出功能功率提高7倍[7]。本文介绍了MFC技术新的应用方向,在堆肥处理固体有机废物过程中构建MFC,将堆肥中产生的生物能转变为电能[8-9]。传统的固体废物堆肥产生的废液和沼气有机物含量高[10],不仅仍然具有很强的污染性,而且其中的有机质能回收利用代价高。利用MFC可将堆肥中的废气和废液进行二次生物处理,在减轻或消除毒害的同时产生易于利用的电能,具有重要的实际意义。
1 固体废物堆肥微生物燃料电池的特点
微生物燃料电池在有机废物的处理中具有无污染和产能的优势,在固体废物堆肥中的应用与溶液和废水中相比又体现出新的特点。
1) 与废水作为底物的MFC相比,堆肥产电过程不需要频繁更换底物,为产电菌的富集和生长提供了更加稳定的外部环境。生活垃圾堆肥微生物电池的功率密度最大可达682 mW/m2[11],高于一般污水处理过程中的功率密度[12],但不同底物条件下堆肥微生物燃料电池的产电效率还需要进一步研究。
2) 由于堆肥的物料有机质含量高,在长时间内可以提供持续稳定的电流输出,节省了连续输送液态废水的能耗可作为小型的供电设备,具有较大的市场潜力。国外如日本有很多家庭用的小型堆肥装置,如在此基础上加入燃料电池的功能,在处理废弃物的同时产电,必然会受到普通家庭的欢迎。
3) 相对于废水需要外加热量来保持适宜的温度,促进各个反应进程的快速进行,固体废物堆肥可以通过自身产热来提高温度[13-15],不需要人工加热。随着温度的上升,系统的底物降解速率变高,产电性能也增大,节能的同时促进了产能。
4) 质子从阳极区向阴极区的传递效率对MFC的性能是非常重要的[16]。与溶液状态相比,固体废物作为降解底物时,阳极区质子浓度随着底物的降解而变化,不同的区域也会有差异,这就造成质子传递的不稳定,阻力变大,从而影响到阴极区的电极反应。
2 堆肥微生物燃料电池的微生物特征
堆肥主要是利用微生物生化降解固体废物中的有机质,利用16S/18S rRNA/DNA序列分析技术,Partanen等[17]对生活垃圾堆肥中的微生物多样性进行了研究,对得到的1 500条近全长16S rDNA序列进行统计学分析,结果表明在生活垃圾堆肥中可能存在超过2 000种不同的细菌。堆肥过程中形成的高度复杂的微生物种群,可以从2个方面有效地应用于微生物燃料电池。1) 堆肥形成的微生物种群中已经存在可以附着在阳极上促进阳极区电子释放,质子传递的产电微生物。李凤等[18]对农业有机废物与城市生活垃圾进行高温堆肥,结果表明农业有机废物的优势菌为巨大芽胞杆菌 Bacillus megaterium、根瘤菌Rhizobium sp.、黄孢原毛平革菌 Phanerochaete chrysosporium、青霉菌Penicillium sp. 同属或同种的菌株;城市生活垃圾的优势菌为 Bacillus megaterium、固氮螺菌属Azospirillum sp.、黄孢原毛平革菌Phanerochaete chrysosporium同种或同属的菌株。微生物燃料电池的主要阳极呼吸微生物种类包括土杆菌Geobacteraceae、变形杆菌Proteobacteria、厚壁菌 Firmicutes、拟杆菌Bacteriodetes及放线菌Actinobacteria[19]。无论是堆肥还是微生物燃料电池,底物和反应条件不同,微生物群落会发生很大的改变,但是堆肥微生物和微生物燃料电池阳极微生物存在紧密的联系,已经有实验证实。Bibiana等[20]研究发现堆肥浸出液可以有效地启动用于废弃物处理的微生物燃料电池,在处理奶酪废水的过程中,阳极在堆肥底部产生的渗滤液中静置一段时间然后运行微生物燃料电池,可以使电流密度增大10倍。另外以厨余垃圾和园林肥料为原料的堆肥微生物燃料电池也已经有报道[11,21]。2) 堆肥过程中形成的高度复杂的微生物群落环境,为产电微生物的产生和增殖提供了有利条件。在微生物燃料电池结构的诱导下,堆肥过程中的微生物群落发生了变化,除了降解底物的发酵微生物,逐步富集了大量的产电微生物。Sandrine等[22]应用计时电流法,在DSA阳极 (尺寸稳定阳极) 上施加一个相对于饱和甘汞电极稳定的电势,使阳极电势恒定在特定数值,记录电极表面电流的产生情况。结果表明在分别施加不同电势和置于不同堆肥反应器的 12组实验当中,呈现出相似的变化规律。刚开始的5 d 几乎没有DSA阳极电流,5 d后电流增加比较明显,这种增加的趋势一直可以持续10 d。恒定0.5 V电势的DSA阳极电流密度的最大值可达到385 mA/m2,经过消毒灭菌的恒定0.7 V电势的DSA阳极始终没有电流的产生。电流从无到有,逐步增加的过程,正是产电微生物生长与富集的过程。经过消毒杀菌的电极没有电流,表明了堆肥微生物被杀死后,破坏了复杂的微生物群落环境,产电微生物就无法诱导产生,从而也就没有了电流[23]。所以堆肥过程中微生物群落的复杂多样性,对于构建堆肥微生物燃料电池是非常重要的。
众多研究表明产电微生物具有复杂的微生物群落组成,阳极生物膜的微生物多样性要明显高于液体介质中的微生物多样性[24]。Chae等[25]采用16S rDNA分子生物学技术研究表明微生物燃料电池产电微生物种类与所使用底物相关,土杆菌属Geobacter及其类似微生物种是不同底物条件下普遍存在的产电微生物,β-Proteobacteria为产电微生物种的优势微生物种,而 Firmicutes在底物为丙酸时成为优势微生物。另一项研究中γ-Proteobacteria代替 β-Proteobacteria成为阴极室的主要微生物种类,占到总微生物种类的48.86%[26]。利用PCR-DGGE技术的研究结果表明,微生物燃料电池可以使某种微生物优先生长成为优势微生物,造成微生物群落的多样性降低[27]。通过对纯菌微生物燃料电池和混合菌微生物燃料电池产电效能的对比发现,混合菌微生物燃料电池的产电效率要远远高于纯菌微生物。所以堆肥过程中的混合菌微生物燃料电池的产电研究具有极大的应用价值和研究意义。Nevin等[28]推论,多种微生物的联合作用是微生物电池产生高电流密度的必要条件,但在混合菌微生物燃料电池的研究中遇到以下两个方面的瓶颈:1) 混合菌在实验研究中的重复性较差并很难保持稳定的群落组成。2) 从技术角度讲,一些常用的分析技术如分子扩增和基因表达对纯菌有优势,但对混合菌的分析来讲还很不成熟。基于以上问题,有关堆肥微生物燃料电池的微生物群落特点研究较少,但由于堆肥固体介质的特点,其微生物群落结构与液体介质的微生物燃料电池相比会有很大的差异,对其特点和功能进行深入研究是十分必要的。
3 堆肥过程中微生物燃料电池性能的影响因素
3.1 电极材料
MFC的电极对产电性能和有机物降解效果有非常重要的影响。电极材料必须具备3个条件[29-31]:1) 良好的导电性。电极必须能够有效地将电子传递到外电路,同时尽量降低电极内阻造成的损耗。2) 微生物兼容性。堆肥过程中由于底物成分复杂多样,阳极区会有大量的发酵微生物和产电微生物,随着阶段的不同,微生物种群有所变化,代谢产物亦随之变化。阳极浸泡在溶液中,电极材料需耐酸碱腐蚀,不能析出对微生物有害的物质,毒害和抑制微生物。3) 比表面积大。阳极表面是产电微生物生存的主要空间,因此如果要获得更多的产电微生物,就需要提供更大的微观表面供其附着生长。
常用的电极材料:1) 碳材料,如碳纸、碳棒、碳网、碳颗粒、碳毡、碳布等。这些材料电导率高,比表面积大,价格便宜,对于微生物电化学反应没有活性,性质稳定。作为堆肥的原料不同于废水,致密的碳布比空隙较大的碳网和碳颗粒更适合作电极。因为固体废物可能漏到碳网和碳颗粒的空隙之中,影响颗粒之间的电子传递,造成电极内阻增大,同时废物的降解也会受到影响。2) 导电聚合物。导电聚合物受人们欢迎的一个重要原因是它的电阻率可以根据需要调节。而且在实际的实验过程中导电聚合物也表现出了很多优势。Yuan等[32]通过在实验过程中电聚合吡咯改性MFC阳极,提高了MFC的输出功率密度。Niessen等[33]采用氟化聚苯胺作为阳极材料可以部分解决铂中毒的问题,提高阳极的催化活性。3) 不锈钢制品。金属具有规则的晶格结构,有大量可自由移动的电子,导电性能非常好。在以往设计的 MFC很少使用不锈钢作为电极材料,主要是考虑到以水溶液为产电底物时电极泡在水中,难以避免腐蚀的问题。在废物堆肥发酵过程中不锈钢电极的使用有了新的尝试。日本神奈川县环境科学研究院利用小麦麸厌氧发酵构建了MFC结构[34],实验中对比了电极材料分别使用不锈钢和碳棒电极时产电电压的不同,结果表明应用不锈钢电极材料比碳棒电极的产电电压高接近200 mV。在保证电极无腐蚀的情况下,不锈钢可替代碳材料成为阳极材料的首选。
阴极材料在保持导电性的同时,化学反应活性也是非常重要的,采用石墨、碳布、碳毡或碳纸作为基本材料时,附着高活性催化剂可降低阴极反应活化过电势,加快反应速率。阴极材料的孔隙、厚度、面积和催化剂的应用都对整个电池电路有很大影响。Oh等[35]使用表面镀铂的石墨电极作阴极,在接种120 h后电能达到0.097 mW,库伦效率在63%~78%。如果将阴极表面镀的铂除去,功率则减小78%。高活性催化剂使用Pt或者Pt-Ru等,可以有效促进电极反应。但Pt是非常昂贵的金属,寻找廉价而高效的替代品就显得非常重要。Yu等[36]的实验结果表明,以1 g/ L葡萄糖溶液为底物,氧气为阴极电子受体,酞菁铁 (FePc) 取代Pt作为阴极催化剂时,最大功率密度从593 mW/m2上升到了634 mW/m2。而且当底物换成乙酸时,FePc作为阴极催化剂,MFC的最大功率密度可达到2 011 mW/m2。同样Zhang等[37]一项实验结果显示,活性碳阴极的 MFC最大功率密度为1 220 mW/m2,Pt催化剂碳纤维布阴极MFC最大功率密度为1 060 mW/m2。卢娜等[38]构建双室连续流微生物燃料电池,研究二氧化锰(MnO2) 为阴极催化剂的催化效果,实验表明当阴极负载MnO2催化剂后,MFC的输出功率密度与不使用催化剂相比提高了约4.2倍。同时也有学者研究使用碳化钼 (Mo2C) 作为铂的代替品[39],实验发现当阴极的催化剂负载量分别为0.5 mg/cm2Pt,6.0 mg/cm2Mo2C和不使用催化剂时,MFC输出功率密度分别为3.64 W/m3,2.39 W/m3,0.61 W/m3。可见碳化钼的催化效果已经比较接近铂,是很有潜力替代铂的产品。我们的研究中利用牛粪为底物构建堆肥微生物燃料电池,阳极由碳纤维布构成,丙酮浸泡过夜除去表面的有机物以增强导电能力。阴极基本材料是碳纤维布,接触空气端使用4层的PTFE防水处理,接触底物的一端添加碳载铂催化剂使铂的浓度为0.1 mg/cm2。实验结果表明碳纤维布是非常好的电极材料,不仅导电能力好,而且在牛粪堆肥过程中没有腐蚀变质和变性的问题,蓬松的结构适合微生物的聚集和增殖,在2个月的运行中,堆肥微生物燃料电池的最大输出功率密度达到350 mW/m2,电动势最大达到635 mV。所以选用合理的电极材料,对电极材料进行适当的处理,是非常重要的。目前处理阴极所使用的催化剂大多比较昂贵,在保证催化效果的同时,寻找廉价的催化剂,是MFC得以广泛应用的保障。
3.2 隔膜
MFC的阴极区和阳极区,多数情况都需要
利用隔膜有效地分离开,防止阴阳极接触短路和电子受体对阳极区的渗入。常见的隔膜有阳离子交换膜 (CEM)、阴离子交换膜 (AEM)、双极膜(BPM)、微滤膜 (MFM)、超滤膜 (UFM)、盐桥、玻璃纤维膜、滤纸和其他多孔材料等[40-43]。这些隔膜基本可以分为离子交换膜和微孔交换膜两类。它们各有优缺点,离子交换膜的内阻比较小,传递离子效率高,能够防止氧气的渗透和底物的泄漏。但是离子交换膜造价很高,容易破损[44-46]。相对来讲,根据空隙大小起到隔离作用的微孔交换膜更适合在堆肥的MFC中应用。小林泰三等[9]就做了固体堆肥的MFC的性能评估。他们用割碎的草与肥料1∶2充分混合,并外加入微生物菌群和足够的水分。首先进行了厌氧堆肥的MFC的性能评价,实验表明阴阳极区隔膜会比较明显地影响产电效果。实验开始20 h后应用玻璃纤维为阴阳极区隔膜的 MFC的电流密度达到 42.5 mW/m2,相对于滤纸的34.5 mW/m2和聚合物膜的13 mW/m2,优势是非常明显的。对于产生电流密度差异的原因也是显而易见的,对堆肥MFC内阻进行测定,阴阳极区隔膜分别为玻璃纤维、滤纸和聚合物膜时,内阻阻值分别为75.03 Ω、89.71 Ω和179.81 Ω。可见不同的隔膜会对MFC的内阻有较大的影响,进而影响电池的输出电流能力。在近期以牛粪为底物的堆肥微生物燃料电池的实验中发现,玻璃纤维膜作为隔膜,吸水后变薄,变软,在牛粪的压紧下容易破漏,造成阴阳极的导电碳丝接触短路。为了防止玻璃纤维膜破损和边缘碳纤维布脱落造成短路,实验中使用两层面积比阳极碳纤维布大一点的玻璃纤维作为隔膜,系统的稳定性变好。通过拟合输出电压随电流变化曲线发现,玻璃纤维隔膜由一层变为两层时内阻从 75.34 Ω增加到 103.54 Ω,输出电压没有很大的变化。我们在选取隔膜的时候要注意根据不同的底物和操作条件进行判断,隔膜的可行性至关重要,例如使用滤纸作为隔膜,堆肥MFC在长期运行时产生的酸性物质可能导致分解消失,形成阴阳极合体的单极结构。所以在尽量实现最佳的电池产电能力和废物降解效果时,更重要的是注意安全和稳定性。
3.3 供氧和构型
氧气是一种较强的氧化剂,可以高效率地利用电子,同时氧气存在于空气中是非常廉价的。大部分MFC研究都是以氧气作为电子受体的。这就要求阴极区保持曝气,同时阳极区保持厌氧。与以前常见的可溶性底物的MFC不同,氧气在固体废物的堆肥发酵中起着非常关键的作用,从而影响到堆肥微生物燃料电池的产电性能。目前的研究当中主要通过改变MFC构型来实现氧气的供给。日本九州大学的小林泰三等[9]利用碳纤维板为电极材料,对施加有机肥料的碎草进行堆肥MFC实验,最高输出功率厌氧状态下为54.4 mW/m2,好氧状态下为114.2 mW/m2。小林泰三等设计的好氧堆肥MFC构型如图1所示,它的特点是阳极与隔膜紧密相连,隔膜与阴极之间是堆肥底物,通过导线将阴极、阳极和外电阻连接起来,构成回路。电极和隔膜面积小于反应容器口,从而使堆肥底物暴露于空气中,实现通气。厌氧堆肥MFC构型如图2所示,它的不同之处是电极和隔膜面积与反应容器相同,完全覆盖了堆肥底物,从而使底物与空气隔绝,实现厌氧。近期南开大学的研究中以养殖场的牛粪为堆肥的原料,构建阳极、隔膜、阴极三合一的微生物燃料电池,反应容器是圆柱形的有机玻璃,阴极置于圆柱形容器的底部,暴露于空气中。堆肥微生物燃料电池先敞开反应容器口,对牛粪进行好氧曝气,反应器构型见图 3,当外阻为1 000 Ω时,输出电压经过1 d迅速上升达到400 mV,此后增长速度下降,到第5天后输出电压基本稳定在500 mV。然后封闭反应容器口,进入厌氧阶段,反应器构型见图4,观察发现输出电压在原来 500 mV的基础上开始缓慢上升,1 d后达到550 mV,并且稳定近1个月。氧气对于堆肥微生物燃料电池具有双方面的作用,一方面足量的氧气可以加强和促进牛粪的降解,另一方面氧气进入阳极区会导致电子和质子的反应,从而破坏微生物燃料电池的结构。所以氧气的供给量对堆肥MFC的影响非常重要。我们需要根据不同的废物类型、堆肥容器的构造、废物中的有机物含量和碳氮的相对比例等因素进行确定氧气的量,从而达到废物降解和高效产电的有机统一。
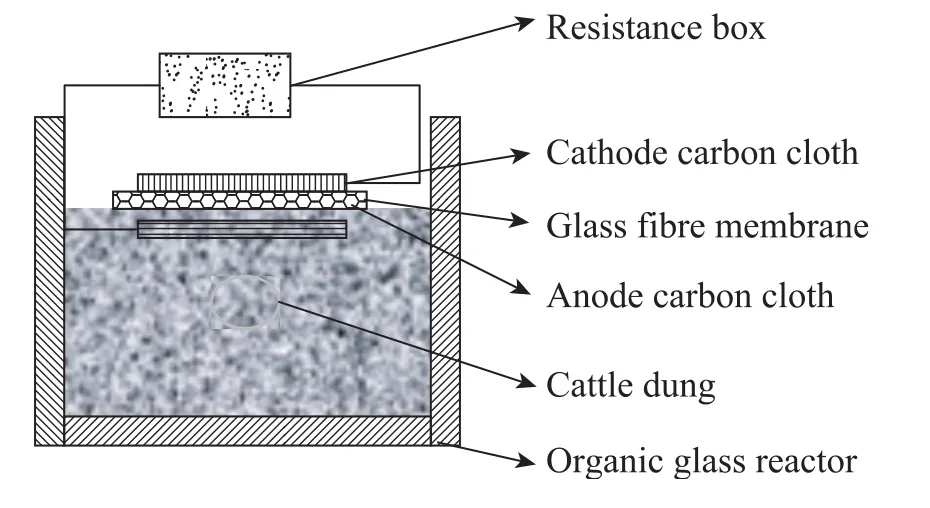
图1 好氧堆肥顶部微生物燃料电池Fig. 1 Aerobic composting with a top microbial fuel cell.
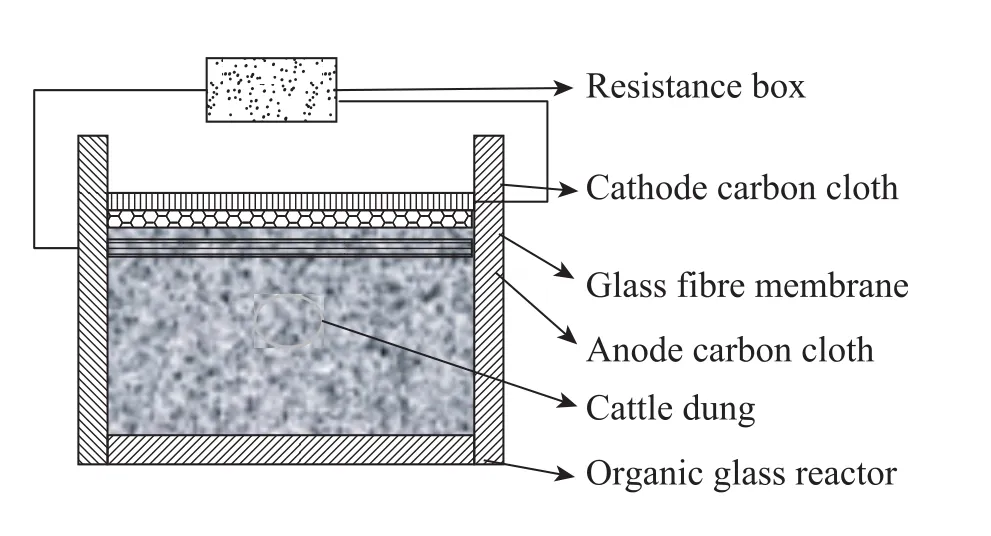
图2 厌氧堆肥顶部微生物燃料电池Fig. 2 Anaerobic composting microbial with a top microbial fuel cell.
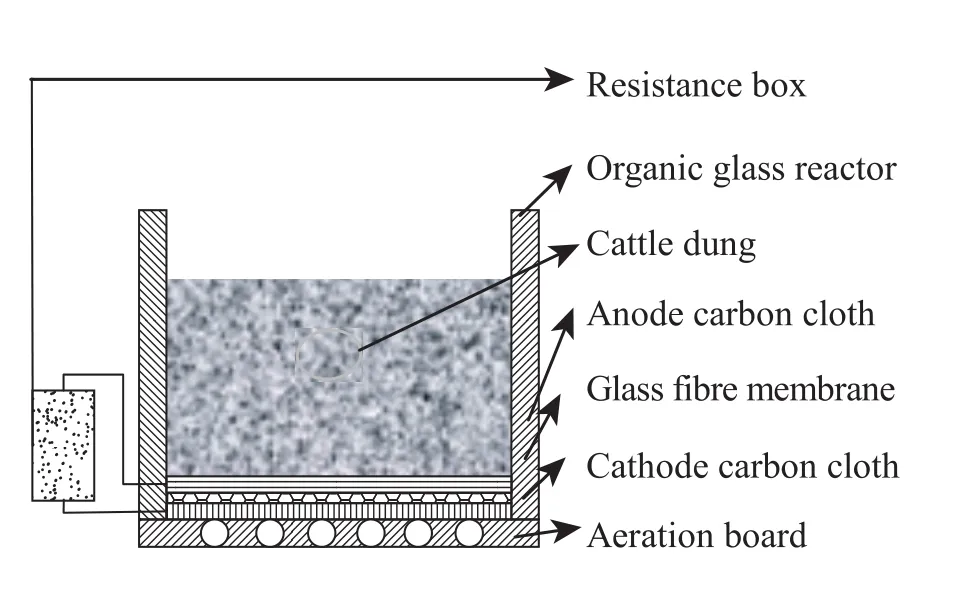
图3 好氧堆肥底部微生物燃料电池Fig. 3 Aerobic composting with a bottom microbial fuel cell.
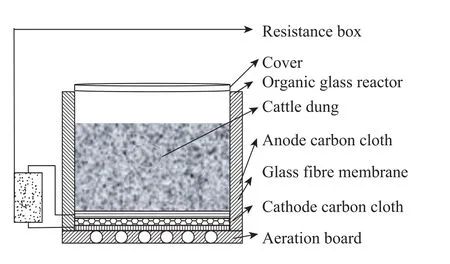
图4 厌氧堆肥底部微生物燃料电池Fig. 4 Anaerobic composting with a bottom microbial fuel cell.
5 展望
堆肥微生物燃料电池可以将生物质能直接转化为电能,根据底物和反应条件的不同,生成的产物可以是水、氢气和盐类等[47],不仅清洁无污染,而且有很高的经济价值。但是有关研究还处于初级阶段,很多重要的影响因素都没有进行过有效的研究,例如补充无机盐可以增大溶液的电导率,从而降低质子传递阻力,但是浓度太高又会造成微生物细胞失水。较高的温度一般有利于生化反应的进行,但是堆肥有时温度会达到50 ℃高于大多数产电微生物的适应温度范围。只有形成一定的溶液状态,质子才能够传递,阴、阳极才能够成为整体的结构,但是含水率过高又会对堆肥降解底物过程不利。总之,在发展绿色能源呼声日益升高的今天,作为具有消除污染和产能双重功效的废物处理技术,堆肥微生物燃料电池很可能成为固体废物资源化新的方向,如何将充分降解底物和高效的产电有机结合将成为人们研究的热点。
REFERENCES
[1] Logan BE, Hamelers B, Rozendal R, et al. Microbial fuel cells: methodology and technology. Environ Sci Technol, 2006, 40(17): 5181−5191.
[3] Zhang CP, Li MC, Liu GL, et al. Pyridine degradation in the microbial fuel cells. Hazard Mater, 2009, 172(1): 465−471.
[4] Cao X, Huang X, Liang P, et al. A new method for water desalination using microbial desalination cells. Environ Sci Technol, 2009, 43(18): 7148−7152.
[5] Mehanna M, Kiely PD, Call DF, et al. Microbial electrodialysis cell for simultaneous water desalination and hydrogen gas production. Environ Sci Technol, 2010, 44(24): 9578−9583.
[6] Feng YJ, Wang X, Li H, et al. Progress in electricity generation from biomass using microbial fuel cell (MFC). Environm Sci, 2010, 31(10): 2525−2530.
[7] De Schamphelaire L, van Den Bossche L, Dang HS, et al. Microbial fuel cells generating electricity from rhizodeposits of rice plants. Environ Sci Technol, 2008, 42(8): 3053−3058.
[8] Parot S, Délia ML, Bergel A. Acetate to enhance electrochemical activity of biofilms from garden compost. Electroch Acta, 2008, 53(6): 2737−2742.
[9] Takayuki K, Kiyoshi O, Noriyuki Y, et al. The development of compost type of microbial fuel cell by degradation of organic wastes. Kyusyu Univ, 2009, 8: 253−256.
[10] Gao D, Zhang HY, Li GX, et al. Effects of waste heat and microbial agents on composting efficiency and greenhouse gas emissions reduction of municipal solid wastes. Trans Chin Soc Agri Eng, 2010, 26(10): 264−271.
叫他们停啊。村长手指先远远对着牛皮糖戳了一下,然后在空中横着一划,就划到了那些民工那边,脸上有了一些不快。
[11] Moqsud MA, Omine, K. Bio-electricity generation by using organic waste in Bangladesh. Proceedings of International Conference on Environmental Aspects of Bangladesh, 2010: 122−124.
[12] Pant D, Bogaert GV, Diels L, et al. A review of the substrates used in microbial fuel cells(MFCs) for sustainable energy production. Bioresour Technol, 2010, 101(6): 1533−1543.
[13] Li WZ, Wang ZJ, Wang LL, et al. Factors affecting acetic acid content in the process of high-concentration hydrolysis and acidogenesis of cow manure. Trans Chin Soc Agri Eng, 2008, 24(4): 204−208.
[14] Song TS, Ye YJ, Xu Y, et al. Progress in microbial fuel cell for wastewater treatment and power generation. Mod Chem Ind, 2008, 28(4): 23−27.
[15] Huang LP, Cheng SA. Biomass energy utilization in microbial fuel cells: potentials and challenges. Chin J Biotech, 2010, 26(7): 942−949.黄丽萍, 成少安. 微生物燃料电池生物质能利用现状与展望. 生物工程学报, 2010, 26(7): 942−949.
[16] Ye YJ, Song TS, Xu Y, et al. Investigation on Influential factors in electricity generation of microbial fuel cell. Chin J Proc Eng, 2009, 9(3): 526−531.
[17] Partanen P, Hultman J, Paulin L, et al. Bacterial diversity at different stages of the composting process. BMC Microbiol, 2010, 10(1): 94.
[18] Li F, Zeng GM, Fan CZ, et al. Comparison microbial communities during high temperature period of composting of organic agriculture wastes and municipal domestic waste. Microbiology, 2009, 36(11): 1657−1663.
[19] Torres CI, Krajmalnik-Brown R, Parameswaran P, et al. Selecting anode-respiring bacteria based on anode potential: phylogenetic, electrochemical, and microscopic characterization. Environ Sci Technol, 2009, 43(24): 9519−9524.
[20] Cercado-Quezada B, Delia ML, Bergel A. Treatment of dairy wastes with a microbial anode formed from garden compost. Appl Electrochem, 2010, 40(2): 225−232.
[21] Parot S, Nercessian O, Delia ML, et al. Electrochemical checking of aerobic isolates from electrochemically active biofilms formed in compost. Appl Microbiol, 2009, 106(4): 1350−1359.
[22] Parot S, Délia ML, Bergel A. Forming electrochemically active biofilms from garden compost under chronoamperometry. Bioresour Technol, 2007, 99(11): 4809−4816.
[23] Dulon S, Parot S, Delia ML, et al. Electroactive biofilms: new means for electrochemistry. Appl Electrochem, 2007, 37(1): 173−179.
[24] Ki D, Park J, Lee J, et al. Microbial diversity and population dynamics of activated sludge microbial communities participating in electricity generation in microbial fuel cells. Water Sci Technol, 2008, 58(11): 2195−2201.
[25] Chae KJ, Choi MJ, Lee JW, et al. Effect of different substrates on the performance, bacterial diversity, and bacterial viability in microbial fuel cells. Bioresour Technol, 2009, 100(14): 3518−3525.
[26] Chen GW, Choi SJ, Cha JH, et al. Microbial community dynamics and electron transfer of a biocathode in microbial fuel cells. Korean J Chem Eng, 2010, 27(5): 1513−1520.
[27] Jong BC, Kim BH, Chang IS, et al. Enrichment, performance, and microbial diversity of a thermophilic mediatorless microbial fuel cell. Environ Sci Technol, 2006, 40(20): 6449−6454.
[28] Nevin KP, Richter H, Covalla SF, et al. Power output and columbic efficiencies from biofilms of Geobacter sulfurreducens comparable to mixed community microbial fuel cells. Environ Microbiol, 2008, 10(10): 2505−2514.
[29] Zeng LZ, Li WS. Research progress on the electrode materials for microbial FC. Chin Batt Ind, 2009, 14(4): 280−284.
[30] Sahoo NG, Jung YC, So HH, et al. Polypyrrole coated carbon nanotubes: synthesis, characterization, and enhanced electrical properties. Synth Metals, 2007, 157(8): 374−379.
[31] Logan BE, Hamelers B, Rozendal R, et al. Microbial fuel cells: methodology and technology. Environ Sci Technol, 2006, 40(17): 5181−5192.
[32] Yuan Y, Kim SH. Polypyrrole-coated reticulated vitreous carbon as anode in microbial fuel cell for higher energy output. Bull Korean Chem Soc, 2008, 29(1): 168−172.
[33] Niessen J, Schröder U, Rosenbaum M, et al. Fluorinated polyanilines as superior materials for electrocatalytic anodes in bacterial fuel cells. Electrochem Commun, 2004, 6(6): 571−575.
[34] Watanabe H. A study of microbial fuel cell using wheat bran. J Jpn Inst Energy, 2008, 87(10): 846−851.
[35] Oh SE, Min B, Logan BE. Cathode performance as a factor in electricity generation in microbial fuel cells. Environ Sci Technol, 2004, 38(18): 4900−4904.
[36] Yu EH, Cheng SA, Scott K, et al. Microbial fuel cell performance with Non-Pt cathode catalysts. J Power Sources, 2007, 171(2): 275−281.
[37] Zhang F, Cheng SA, Pant D, et al. Power generation using an activated carbon and metal mesh cathode in a microbial fuel cell. Electroch Commun, 2009, 11(11): 2177−2179.
[38] Lu N, Zhou B, Deng LF. Starch processing wastewater treatment using a continuous microbial fuel cell with MnO2cathodic catalyst. J Basic Sci Eng, 2009, 17(11): 66−73.
[39] Zeng LZ, Zhang LX, Li WS, et al. Molybdenum carbide as anodic catalyst for microbial fuel cell based on Klebsiella pneumoniae. Biosens Bioelectron, 2010, 25(12): 2696−2700.
[40] Harnisch F, Schröder U, Scholz F. The suitability of monopolar and bipolar ion exchange membranes as separators for biological fuel cells. Environ Sci Technol, 2008, 42(5): 1740−1746.
[41] Fan YZ, Hu HQ, Liu H. Sustainable power generation in microbial fuel cells usingbicarbonate buffer and proton transfer mechanisms. Environ Sci Technol, 2007, 41(23): 8154−8158.
[42] Li WW, Sheng GP, Liu XW, et al. Recent advances in the separators for microbial fuel cells. Bioresour Technol, 2011, 102(1): 244−252.
[43] Clauwaert P, Aelterman P, Pham TH, et al. Minimizing losses in bio-electrochemical systems: theroad to applications. Appl Microbiol Biotechnol, 2008, 79(6): 901−913.
[44] Fan YZ, Hu HQ, Liu H. Enhanced Coulombic efficiency and power density of air-cathode microbial fuel cells with an improved cell configuration. J Power Sources, 2007, 171(2): 348−354.
[45] Kim JR, Premier GC, Hawkes FR. Development of a tubular microbial fuel cell (MFC) employing a membrane electrode assembly cathode. J Power Sources, 2009, 187(2): 393−399.
[46] Zuo Y, Cheng S, Logan BE. Ion exchange membrane cathodes for scalable microbial fuel cells. Environ Sci Technol, 2008, 42(18): 6967−6972.
[47] Harnisch F, Schröeder U. From MFC to MXC: chemical and biological cathodes and their potential for microbial bioelectrochemical systems. Chem Soc Rev, 2010, 39(11): 4433−4448.

