水杨酸对丹参培养细胞中迷迭香酸生物合成及其相关酶的影响
焦蒙丽,曹蓉蓉,陈红艳,郝文芳,董娟娥
西北农林科技大学生命科学学院,陕西 杨凌 712100
植物次生代谢物因具有独特的性质而作为药品、食品添加剂、香料以及其他工业生产等方面的原料[1]。目前,多采用组织培养调控的方法来提高目标次生代谢物的产量。调控的方式有多种,如:加速生成目标化合物的化学合成速度、添加诱导子处理、非生物胁迫等[2]。常采用的方法是向高产细胞系中添加诱导子以提高目标次生代谢物的合成积累量[3]。
水杨酸 (Salicylic acid,SA) 是植物体内的一种信号分子,对植物的生长、发育和防御反应均具有关键的调控作用[4-6]。SA主要是通过参与植物体内的信号转导调控植物次生代谢途径中关键酶的活性,从而影响植物次生代谢物合成积累量的变化[7]。苯丙氨酸解氨酶 (Phenylanine ammonia-lyase,PAL) 是位于初生代谢和次生代谢分支处的关键酶[8],催化植物体内多种具有防御功能化合物的形成[1,9-10],也是合成迷迭香酸(Rosmarinic acid,RA) 分子结构上咖啡酰基的关键酶[11-12]。酪氨酸氨基转移酶 (Tyrosine aminotransferase,TAT) 是酪氨酸衍生的植物次生代谢途径中的限速酶,是合成RA分子结构上4-羟基苯乳酸的关键酶[12-13]。有研究表明,利用SA诱导子诱导后,在植物次生代谢物含量增加的同时,相应的PAL活性也有所上升。如利用一定浓度的SA处理成熟的葡萄,提高了葡萄中总酚的含量,且细胞中PAL的活性与总酚含量的变化呈正相关[14]。TAT的活性可以被L-α-aminooxyβ-phenyl-propionic acid (AOPP) 竞争性抑制[15]。但目前还不清楚SA诱导是否影响TAT的活性及迷迭香酸的合成积累量。
本研究以丹参悬浮培养细胞为材料,经 SA诱导,并利用TAT竞争性抑制剂AOPP处理,考察PAL和TAT的活性变化与迷迭香酸合成积累的关系,拟从酶学角度阐明SA诱导植物细胞合成次生代谢物的作用机制,为进一步利用丹参培养细胞定向生产RA提供理论依据。
1 材料与方法
1.1 愈伤组织诱导及继代培养
将新鲜的丹参种子 (来源于陕西商洛丹参GAP药源基地) 消毒处理后,在无菌条件下接种于含30 g/L蔗糖、5.5 g/L琼脂、pH 5.8的MS固体培养基上。在温度为 (25±2) ℃、光照时间为12~16 h、光照强度为2 000~3 000 Lx的条件下培养,2个月后生长出无菌苗。
将无菌苗上生长健壮的叶片剪成 0.5 cm× 0.5 cm大小的外植体,接种于MS固体培养基上(含 1.0 mg/L NAA、1.0 mg/L 6-BA、1.0 mg/L 2,4-D)。1个月后诱导出愈伤组织,每隔20 d继代培养1次,直到培养细胞性状稳定。培养条件同上。
1.2 诱导子和抑制剂处理
将继代培养3次性状稳定的愈伤组织再次继代培养12 d,转接到含25 mL MS液体培养基 (无生长调节物质和琼脂) 的50 mL的三角瓶中,在转速为125 r/min、温度为25 ℃的条件下黑暗悬浮培养。培养6 d后,在生长状况一致的培养细胞中分别用诱导子 (SA) 和抑制剂 (AOPP) 处理。根据实验设计,分别在处理后的1、4、6、8、24 h收获培养物进行次生代谢物含量和酶活性检测。
1.3 酶活性检测
1.3.1 PAL活性的测定
取新鲜的细胞,用蒸馏水将材料表面冲洗干净后,快速用吸水纸吸干表面水分。称取 1.0 g材料放入预冷的研钵中,加入5 mL 4 ℃下预冷的提取介质 (50 mmol/L硼酸缓冲液、5.0 mmol/L巯基乙醇、1.0 mmol/L EDTA-Na2、5%甘油、5% PVP,pH 8.8),冰浴下迅速研磨匀浆后,定容至8 mL。4 ℃、10 000 r/min离心15 min,上清液用于酶活性测定[16]。酶的检测体系包括:酶液0.5 mL、硼酸缓冲液 (pH 8.8) 2 mL、L-苯丙氨酸 (0.02 mol/L) 1 mL和蒸馏水1 mL。将酶的检测体系于37 ℃水浴中保温60 min后加入0.2 mL的6 mmol/L HCl终止反应。在290 nm下测定吸光度,以每分钟OD值变化0.01为1个酶活单位 (U)。酶活性按以下公式计算:
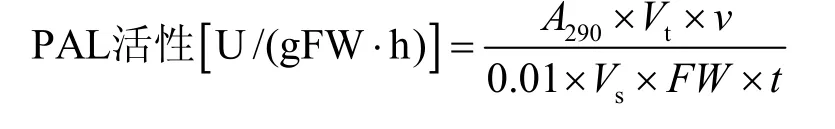
式中,Vt为提取粗酶液总体积 (mL),v为反应液总体积 (mL),Vs为测定时取用粗酶液体积(mL),FW为样品鲜重 (g),t为反应时间 (h)。
1.3.2 TAT活性的测定
取新鲜细胞,用蒸馏水将材料表面冲洗干净后,快速用吸水纸吸干表面水分。称取0.5 g材料放入预冷的研钵中,加入3 mL 4 ℃下预冷的提取介质 (0.1 mol/L磷酸缓冲液、0.1 mmol/L的EDTA、80 mmol/L的α-酮戊二酸、0.2 mmol/L的VB6和1 mmol/L的DTT,pH 7.3),冰浴下迅速研磨匀浆后,定容至5 mL。4 ℃、10 000 r/min离心15 min,保留上清液,用于酶活性检测[16]。酶活性的测定体系包括:酶液0.5 mL、0.2 mol/L磷酸缓冲液 (pH 7.6) 3 mL、17 mmol/L的α-酮戊二酸0.2 mL、88 mmol/L酪氨酸0.2 mL、0.2 mmol/L的VB60.1 mL。将检测体系于37 ℃水浴中保温30 min后加入0.5 mL 10 mmol/L的NaOH,继续在37 ℃条件下水浴30 min。反应液于331 nm波长处测吸光值,以每分钟OD值变化0.01为一个酶活单位 (U)。
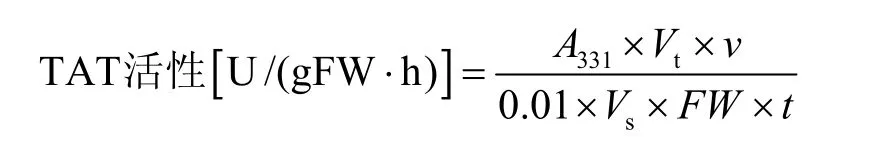
式中,Vt为提取粗酶液总体积 (mL),v为反应液总体积 (mL),Vs为测定时取用粗酶液体积(mL),FW为样品鲜重 (g),t为反应时间 (h)。
1.4 RA含量检测
采用超声波提取法提取RA[17]。精密称取在47 ℃下真空干燥的丹参细胞培养物干粉0.05 g,加入 70%甲醇水溶液 1 mL,用超声波提取45 min,8 000 r/min离心10 min,上清液经0.45 μm的微孔滤膜过滤,待检测。
色谱条件:色谱柱:WondaSil C18色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水-磷酸 (35∶65∶0.1,V/V/V),流动相使用前进行过滤和脱气处理;检测波长:285 nm;流速:1.0 mL/min;柱温:25 ℃;进样量:10 μL。
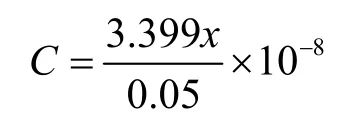
式中:C为样品中迷迭香酸的含量 (mg/g,DW);x为样品的峰面积;0.05为样品的干重 (g)。
2 结果与分析
2.1 SA对丹参培养细胞中RA积累量的影响
不同浓度的SA (6.25、12.5和25.0 mg/L) 诱导后丹参培养细胞中 RA的含量变化如图 1所示。浓度为6.25 mg/L的处理组,在SA诱导8 h时,培养细胞中 RA的积累量达到峰值(5.914 mg/g DW),随后RA的积累量有所减少,但仍略高于对照组。浓度为12.5 mg/L的处理组,在SA诱导4 h后,培养细胞中RA的积累量明显增高,在诱导 24 h时达到峰值 (6.113 mg/g DW)。浓度为25 mg/L的处理组,在SA诱导6 h时,RA 积累量明显增高,24 h达到峰值(5.227 mg/g DW)。总体来看,6.25 mg/L的SA可在较短的时间内诱导丹参培养细胞合成较多的 RA,且对培养细胞的生长没有造成伤害 (数据未显示)。因此,在后续的试验中均以6.25 mg/L的SA作为诱导子。
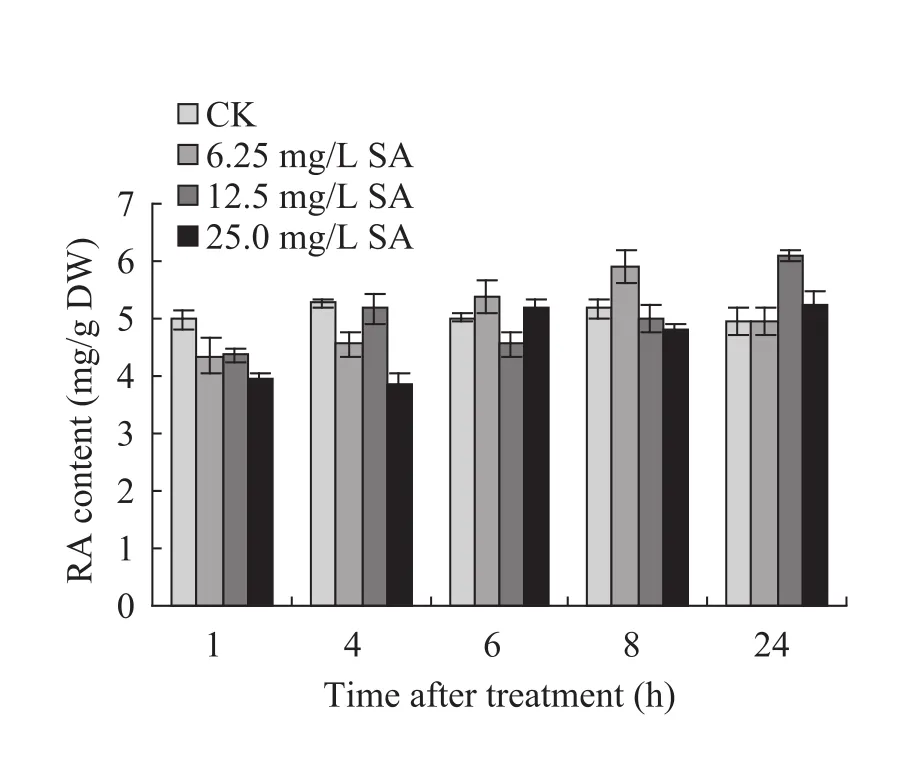
图1 不同浓度SA对丹参细胞中RA积累量的影响Fig. 1 Effects of SA in different concentrations on the accumulation of RA in S. miltiorrhiza cell cultures.
2.2 AOPP对丹参培养细胞中RA积累量的影响
AOPP对丹参培养细胞中RA积累量的影响如图2所示。用浓度为0.1 μmol/L的AOPP处理丹参培养细胞4 h时,与对照相比,细胞中RA的合成积累量有所下降;处理6 h时,RA的积累量明显下降 (仅为SA单独处理的76%),表现出较强的抑制效果。处理24 h时,AOPP对RA合成的抑制作用逐渐解除,此时RA的积累量与对照组和SA诱导组无显著差异。
2.3 AOPP与 SA共处理对丹参培养细胞中RA积累量的影响
AOPP和SA共处理对丹参细胞中RA积累量的影响如图3所示。0.1 μmol/L的AOPP处理1 h后再利用6.25 mg/L的SA诱导,诱导1~6 h时,随着处理时间的延长,AOPP抑制组RA的积累量逐渐降低,SA诱导组和共处理组(AOPP+SA) 培养细胞中 RA的积累量逐渐升高;处理24 h时,AOPP处理组的RA积累量与对照无显著差异,而共处理组的RA积累量显著高于SA诱导组和AOPP单独处理组。
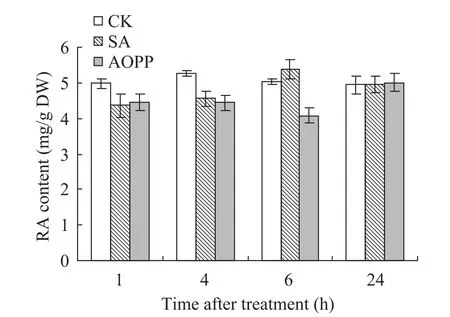
图2 AOPP对丹参细胞中RA积累量的影响Fig. 2 Effects of AOPP on the accumulation of RA in S. miltiorrhiza cell cultures.
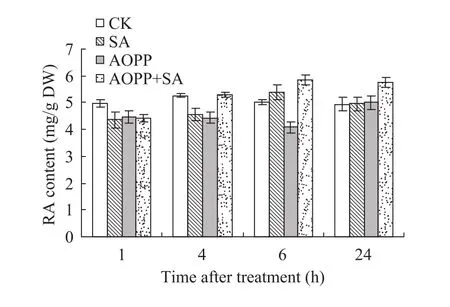
图3 AOPP和SA共处理对丹参细胞中RA积累量的影响Fig. 3 Effects of AOPP and SA on the accumulation of RA in S. miltiorrhiza cell culture.
2.4 SA对PAL和TAT活性的影响
利用不同浓度的SA (6.25、12.5和25 mg/L)诱导子处理丹参悬浮培养细胞,细胞中 TAT和PAL的活性变化如图4所示。SA诱导后,浓度最低的6.25 mg/L处理组培养细胞中TAT (图4A)和PAL (图4B) 的活性分别在1 h和4 h出现峰值;诱导浓度为12.5 mg/L时,TAT和PAL的活性分别在4 h和24 h出现峰值;诱导浓度为25 mg/L时,TAT和PAL分别在4 h和8 h出现最高值。可以看出,在选定的范围内,SA的浓度越低,诱导酶活性的峰值出现得越早。
2.5 AOPP对PAL和TAT活性的影响
图5为AOPP对丹参培养细胞中PAL和TAT活性的影响。从图5A可见,浓度为0.1 μmol/L的AOPP处理1 h后,对TAT的抑制效果明显;处理4 h后,AOPP对TAT的抑制作用逐渐解除;处理6 h后,AOPP对TAT的抑制作用完全解除;处理24 h后的TAT活性与对照组无显著差异。
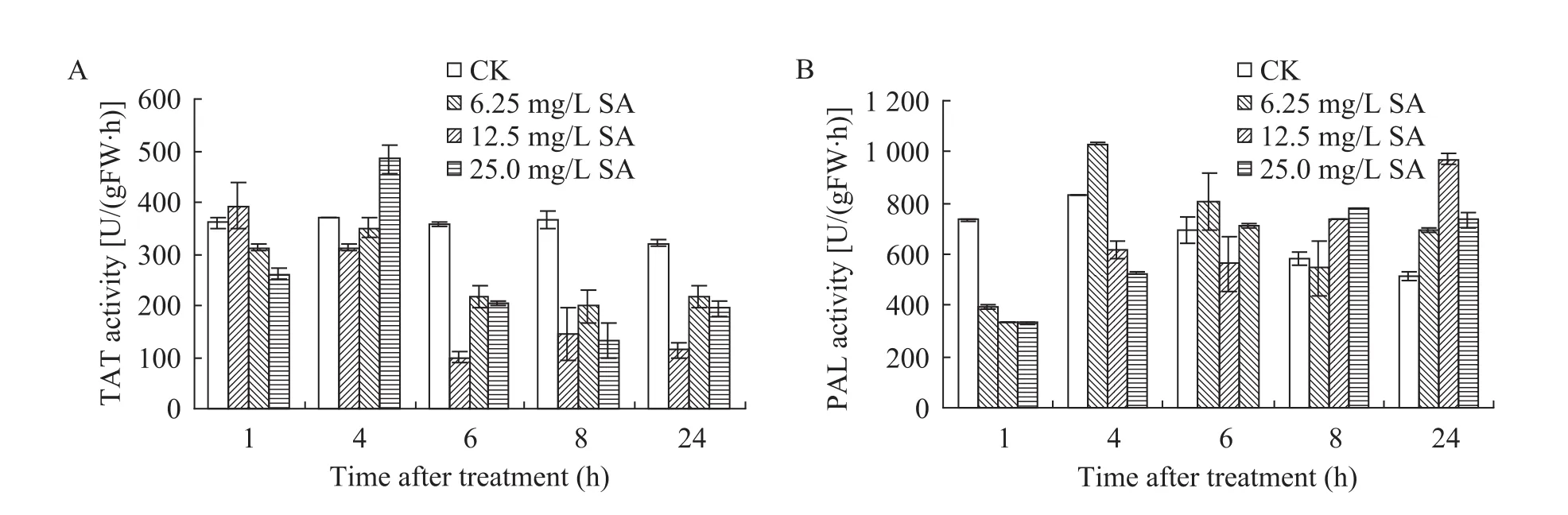
图4 不同浓度SA对丹参细胞中TAT (A) 和PAL (B) 活性的影响Fig. 4 Time course of TAT (A) and PAL (B) activities after SA treatment.

图5 0.1 μmol/LAOPP对丹参细胞中TAT (A) 和PAL (B) 活性的影响Fig. 5 Time course of TAT (A) and PAL (B) activities after 0.1 μmol/L AOPP treatment.
从图5B可见,0.1 μmol/L的AOPP处理1 h后,丹参培养细胞中PAL的活性开始下降;处理6 h时,PAL的活性下降至最低,为对照的44%;处理24 h时,PAL的活性与对照组无显著差异,说明AOPP对PAL的抑制作用直到24 h后才能解除。
2.6 AOPP与SA诱导子共处理对酶活性的影响
图6为用0.1 μmol/L的AOPP预先对丹参培养细胞处理1 h后,再添加6.25 mg/L的SA处理对TAT (图6A) 和PAL (图6B) 活性的影响。如图6A所示,在共处理1 h后,丹参培养细胞TAT的活性显著低于SA诱导组和对照组,但显著高于AOPP单独处理组;共处理4 h时,TAT活性与对照组无显著差异,但显著高于SA诱导组和AOPP单独处理组;共处理6 h后,TAT活性显著高于SA诱导组,但低于AOPP单独处理组和对照组。
由图6B可见,在1 h时,SA单独处理、AOPP单独处理、AOPP和SA共处理后的丹参培养细胞中PAL的活性均显著低于对照组;在4 h时,SA处理显著提高了PAL的活性,AOPP处理显著抑制了PAL的活性;6 h时,AOPP处理后的PAL活性降到最低。处理6 h时AOPP对PAL的抑制效果最强,导致共处理后的PAL活性显著低于对照;24 h时,随着AOPP对PAL活性抑制作用的解除,SA和AOPP共处理组的PAL的活性也显著升高,并高于对照组。
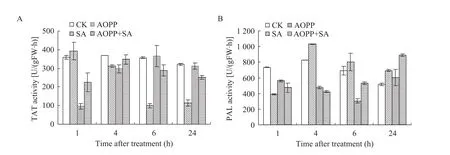
图6 AOPP与SA共处理对丹参细胞TAT (A) 和PAL (B) 活性的影响Fig. 6 Time course of TAT (A) and PAL (B) activities after co-treatment of SA and AOPP.
3 讨论
研究证明,水杨酸 (SA) 作为诱导子可诱导多种植物次生代谢物合成积累量的增加[1,14,18-19]。一定浓度的水杨酸诱导子可以通过改变植物次生代谢物合成途径中关键酶的活性来提高次生代谢物的合成积累量[7,14]。本研究中,6.25~25.0 mg/L的SA均可诱导丹参悬浮培养细胞中迷迭香酸 (RA) 积累量的增加,但低浓度(6.25~12.5 mg/L) SA诱导的RA积累量较高,诱导达到峰值所需要的时间也较短,说明水杨酸对迷迭香酸的诱导具有最佳浓度型的特征。进一步从酶学角度分析,植物体中的迷迭香酸主要由苯丙氨酸代谢途径衍生的咖啡酸和酪氨酸代谢途径衍生的 4-羟基苯乳酸经过迷迭香酸合成酶缩合而成,苯丙氨酸解氨酶 (PAL) 和酪氨酸氨基转移酶 (TAT) 分别为这两条代谢途径上的关键酶[12,20]。通过考察 SA诱导子、TAT的抑制剂(AOPP)、SA和AOPP共处理后丹参培养细胞中PAL和TAT的活性变化和相应RA积累量的变化发现,添加6.25 mg/L的SA诱导后,在RA大量积累的前期,PAL和TAT的活性在处理后4 h时均显著提高;处理后的6~24 h,PAL的活性均显著高于对照,但 TAT的活性逐渐显著低于对照。进一步用AOPP处理发现,在RA积累量减少的同时,PAL和TAT的活性均有所降低;AOPP对TAT活性的抑制作用在6 h后就可以解除,但对PAL活性的抑制作用在24 h才可解除。以上结果说明,在丹参培养细胞中,AOPP在作为TAT竞争性抑制剂的同时也可以作为PAL的抑制剂,与对鹰嘴豆[22]和草莓[23]的研究结果一致。此外,研究发现AOPP对丹参培养细胞TAT的抑制作用没有对 PAL的敏感。这一结果与对绿豆[15]和彩叶草Coleus blumei[21]的研究一致,AOPP没有对绿豆中的 TAT起到明显的抑制作用[15],对彩叶草 TAT活性的抑制作用也不敏感[21]。其主要原因可能是由于TAT具有植物种属特异性[15]。
当用AOPP和SA共同处理丹参培养细胞后发现,共处理组的细胞中RA的积累量比单独使用SA处理组的低,但比单独使用AOPP处理组的高。同时,PAL的活性与RA的含量之间表现出明显的正相关性。由此推测,在丹参培养细胞RA的生物合成过程中,PAL的酶促作用比TAT的明显。这一结果与对紫草 Lithospermum erythrorhizon的研究结果相吻合[11,13]。在用酵母诱导子诱导紫草悬浮培养细胞时,诱导后 PAL活性的增加与RA积累量成正相关[11];以茉莉酸甲酯为诱导子诱导紫草悬浮培养细胞时,PAL的活性在RA积累量增加之前也相应地表现出增高的趋势[13]。迄今为止,庞大的次生代谢合成途径中仍有许许多多的谜团尚未解开,对代谢途径的影响因素非常庞杂,究竟哪种酶在丹参RA代谢途径起到更为关键的作用,仍需要进一步运用现代分子生物学的手段进行更深层次探讨。
REFERENCES
[1] Zhao J, Davis LC, Verpoorte R. Elicitor signal transduction leading to production of plant secondary metabolites. Biotechnol Adv, 2005, 23(4): 283−333.
[2] Zhong JJ. Biochemical engineering of the production of plant-specific secondary metabolites by cell suspension cultures. Adv Biochem Eng Biotechnol, 2001, 72: 1−26.
[3] Zhao HL, Yu RM. Progress in the application of elicitors in the plant cell cultures. J Shenyang Pharm Univ, 2000, 17(2): 152−156.赵鸿莲,于荣敏. 诱导子在植物细胞培养中的应用研究进展. 沈阳药科大学学报,2000,17(2): 152−156.
[4] Delaney TP, Uknes S, Vernooij B, et al. A central role of salicylic acid in plant disease resistance. Science, 1994, 266(5188): 1247−1250.
[5] Conrath U, Pieterse CMJ, Mauch-Mani B. Priming in plant-pathogen interactions. Trends Plant Sci, 2002, 7(5): 210−216.
[6] Mauch-Mani B, Metraux JP. Salicylic acid and systemic acquired resistance to pathogen attack. Ann Bot, 1998, 82(5): 535−540.
[7] Dong JE, Zhang KJ, Liang ZS. Plant Secondary Metabolism and Its Regulation. Xi’an: Northwest Agriculture and Forestry University Press, 2009: 155−157.董娟娥,张康健,梁宗锁. 植物次生代谢与调控.西安:西北农林科技大学出版社,2009: 155−157.
[8] Dixon RA, Paiva NL. Stress-induced phenylpropanoid metabolism. Plant Cell, 1995, 7(7): 1085−1097.
[9] Sgarbi E, Fornasiero RB, Lins AP, et al. Phenol metabolism is differentially affected by ozone in two cell lines from grape (Vitis vinifera L.) leaf. Plant Sci, 2003, 165(5): 951−957.
[10] Solecka D, Kacperska A. Phenylpropanoid deficiency affects the course of plant acclimation to cold. Physiol Plant, 2003, 119(2): 253−262.
[11] Mizukami H, Ogawa T, Ohashi H, et al. Induction of rosmarinic acid biosynthesis in Lithospermum erythrorhizon cell suspension cultures by yeast extract. Plant Cell Rep, 1992, 11(9): 480−483.
[12] Yan Q, Shi M, Ng J, et al. Elicitor-induced rosmarinic acid accumulation and secondary metabolism enzyme activities in Salvia miltiorrhiza hairy roots. Plant Sci, 2006, 170(4): 853−858.
[13] Mizukami H, Tabira Y, Ellis BE. Methyl jasmonate-induced rosmarinic acid biosynthesis in Lithospermum erythrorhizon cell suspension cultures. Plant Cell Rep, 1993, 12(12): 706−709.
[14] Chen JY, Wen PF, Kong WF, et al. Effect of salicylic acid on phenylpropanoids and phenylalanine ammonia-lyase in harvested grape berries. Postharvest Biol Technol, 2006, 40(1): 64−72.
[15] De-Eknamkul W, Ellis BE. Tyrosine aminotransferase: the entrypoint enzyme of the tyrosine-derived pathway in rosmarinic acid biosynthesis. Phytochemistry, 1987, 26(7): 1941−1946.
[16] Wan GW. Effect of elicitors on accumulation of salvianolic acid and secondary metabolism enzyme activities in Salvia miltiorrhiza bunge callus [D]. Yangling: Northwest Agriculture and Forestry University, 2008.宛国伟. 诱导子对丹参酚酸类化合物含量及合成酶的影响[D]. 杨凌:西北农林科技大学,2008.
[17] Zheng LL. Study on major constituents’ contents and genetic relationship in Salvia miltiorrhiza bunges from different places[D]. Yangling: Northwest Agriculture and Forestry University, 2010.郑丽玲. 不同来源地丹参主要化学成分含量与遗传多样性的研究[D]. 杨凌:西北农林科技大学,2010.
[18] Pitta-Alvarez SI, Spollansky TC, Giulietti AM. The influence of different biotic and abiotic elicitors on the production and profile of tropane alkaloids in hairy root cultures of Brugmansia candida. Enzyme Microb Technol, 2000, 26(2/4): 252−258.
[19] Dong JE, Wan GW, Liang ZS. Accumulation of salicylic acid-induced phenolic compounds and raised activities of secondary metabolic and antioxidative enzymes in Salivia miltiorrhiza cell culture. J Biotechnol, 2010, 148(2/3): 99−104.
[20] Mizukami H, Ellis BE. Rosmarinic acid formation and differential expression of tyrosine aminotransferase isoforms in Anchusa officinalis cell suspension cultures. Plant Cell Reports, 1991, 10(6/7): 321−324.
[21] Ellis BE, Remmen S, Goeree G. Interaction between parallel pathways during biosynthesis of rosmarinic acid in cell suspension cultures of Coleus blumei. Planta, 1979, 147(2): 163−167.
[22] Barz W, Mackenbrock U. Constitutive and elicitation induced metabolism of isoflavones and pterocarpans in chickpea (Cicer arietinum) cell suspension cultures. Plant Cell, 1994, 38(2/3): 199−211.
[23] Edahiro J, Seki M. Phenylpropanoid metabolite supports cell aggregate formation in strawberry cell suspension culture. J Biosci Bioeng, 2006, 102(1): 8−13.

