威灵仙总皂苷诱导急性早幼粒细胞白血病细胞株NB4分化作用的研究*
黄 莉 黄纯兰
(泸州医学院附属医院,四川 泸州 646000)
近年来研究发现威灵仙中的有效成分三萜皂苷[1]可以通过诱导恶性肿瘤细胞的分化和凋亡达到抗肿瘤作用[2-3],笔者在前期研究中已经发现威灵仙总皂苷对NB4细胞具有诱导凋亡作用[4],但是对NB4细胞是否具有诱导分化作用尚无研究。因此,本研究拟从细胞的增殖抑制、形态变化和功能抗原表达等方面研究威灵仙总皂苷对急性早幼粒细胞白血病NB4细胞是否具有诱导分化作用,以期为进一步研究威灵仙在血液系统恶性肿瘤临床治疗上的应用提供实验依据。
1 材料与方法
1.1 材料 威灵仙总皂苷由泸州医学院药学院参照文献[5-7]提取,系棕色粉末状结晶,储存液 (16 mg/mL)用无血清RPMI1640(Gibeo公司产品)溶解,应用液用含10%小牛血清的RPMI配制;佛波醇酯(TPA)、硝基蓝四氮唑(NBT)、全反式维甲酸(ATRA)干粉为美国Sigma产品;CD11b和CD33购自BD公司。
1.2 细胞培养 NB4细胞株由四川大学华西医院干细胞生物研究室馈赠。将NB4细胞接种于含体积分数为10%小牛血清、青霉素100 IU/mL及链霉素100 μg/mL的RPMI1640培养液中,置于37℃、5%CO2的孵箱中悬浮培养。取对数生长期,台盼蓝染色拒染率在95%以上的细胞进行实验。
1.3 细胞增殖率和形态观察 取对数生长期的NB4细胞,以1×105/mL细胞密度分别接种于含5种不同质量浓度威灵仙总皂苷(分别为 25、50、100、200、400 μg/mL)的培养液中,并设不加药空白对照组和1 μmol/L ATRA阳性对照组,培养体系8 mL,连续培养5 d。每日取各组细胞,记数活细胞,绘制生长曲线,并计算第5日的生长抑制率。隔日取各浓度组细胞,离心涂片瑞氏染色后油镜下观察200个细胞形态变化并计算细胞诱导分化率,诱导分化率(%)=(200-早幼粒细胞)/200×100%。
1.4 硝基蓝四氮唑 (NBT)还原实验 取各实验组细胞悬液500 μL,与1 g/L的NBT溶液混合,加入200 μg/mL TPA溶液100 μL,37℃孵育30 min后离心涂片,光镜下见胞浆内含蓝黑色颗粒的为阳性细胞。计数200个细胞,得出NBT阳性细胞的百分率。实验重复3次。
1.5 透射电镜观察 收集第4日各实验组的细胞,离心,PBS洗涤,戊二醛固定,按常规制备超薄切片,在透射电镜下观察细胞核、染色质等的变化并照相。
1.6 细胞分化表面抗原CD11b和CD33的检测 取经威灵仙总皂苷作用后的细胞,用CD11b和CD33单抗对各组细胞进行免疫标记,用流式细胞仪检测细胞表面抗原表达(平均荧光强度)。
1.7 统计学处理 应用SPSS13.0统计软件。计量资料以(表示,各组应用方差分析。率的比较采用χ2检验。以a=0.05为检验水准。P<0.05为差异有统计学意义。
2 结 果
2.1 威灵仙总皂苷对NB4细胞生长的影响 不同质量浓度威灵仙总皂苷作用NB4细胞后,随着剂量增加和作用时间延长,细胞增殖明显受抑,呈现剂量和时间的量效关系。在96 h时出现抑制率的最高值。但在120 h,威灵仙总皂苷各组受抑率整体出现轻度下降。400 μg/mL组的抑制率变化幅度在各组中最大,96 h生长抑制率达到(37.41±2.16)%,与阳性对照组比较没有明显差异(P>0.05)。 见表 1。
表1 不同质量浓度威灵仙总皂苷在各时间点对NB4细胞生长的抑制率(%,
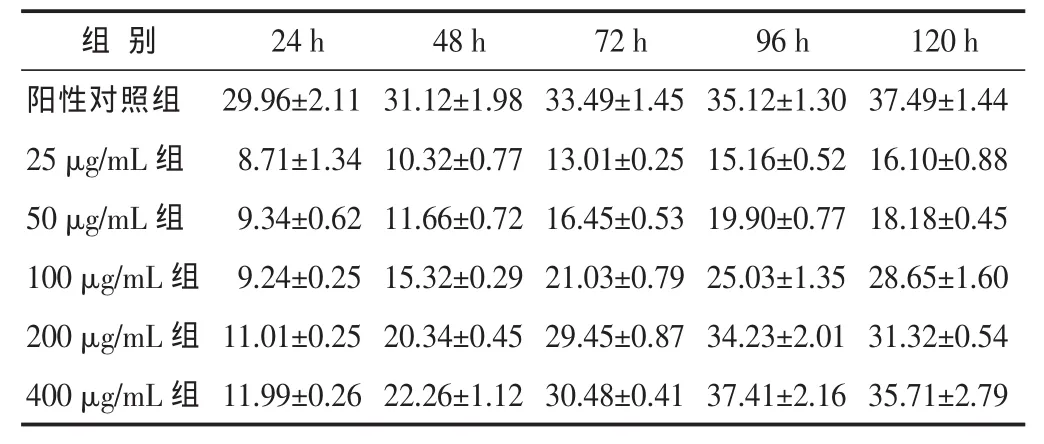
表1 不同质量浓度威灵仙总皂苷在各时间点对NB4细胞生长的抑制率(%,
?
2.2 威灵仙总皂苷对NB4细胞细胞形态及细胞分化率的影响与空白对照组相比,威灵仙总皂苷组在整个实验中未见典型分化作用,仅个别细胞核出现肾形或杆核。却出现了明显的核固缩、核边聚、核碎裂、胞膜出泡现象,并可见典型的凋亡小体。随浓度增高,时间延长,该现象越明显。而阳性对照组,细胞体积变小,胞浆增多,核缩小,核浆比例减少,细胞核由圆、椭圆转变为肾形、杆状,甚至出现分叶。见图1,表2。
表2 不同质量浓度威灵仙总皂苷作用96 h后对NB4细胞分化和形态的影响
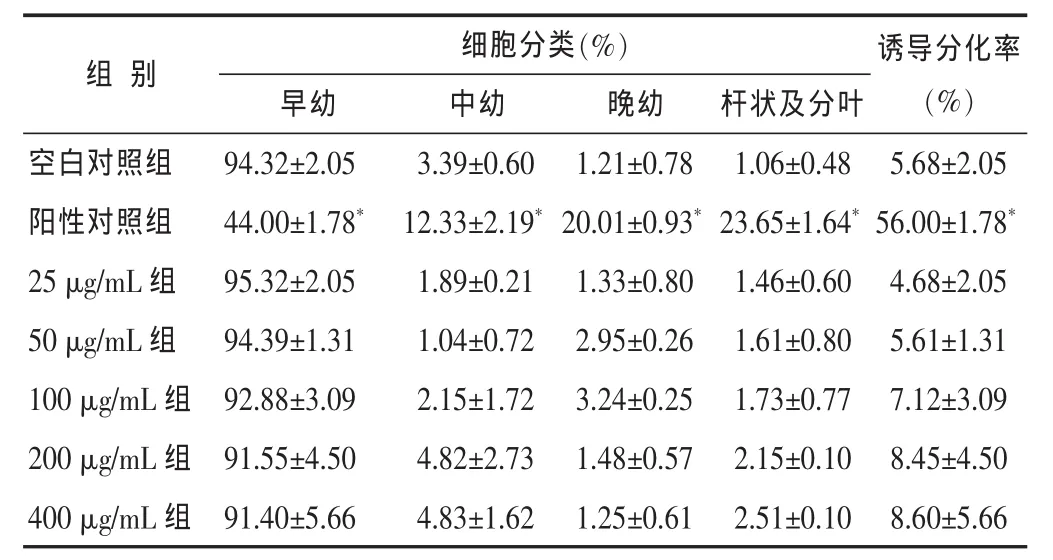
表2 不同质量浓度威灵仙总皂苷作用96 h后对NB4细胞分化和形态的影响
与空白对照组比较,*P<0.05,**P<0.01。下同。
?
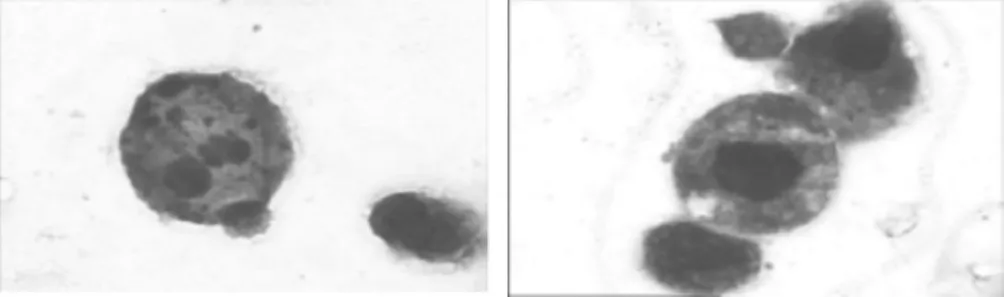
图1 威灵仙总皂苷400 μg/mL组72 h后NB4细胞形态(Wright's-Giemsa染色,×1000)
2.3 NBT还原实验结果 威灵仙总皂苷各浓度组作用于NB4细胞5 d后,NBT还原法检测结果显示,各实验浓度组细胞内无或者仅有少量的蓝色颗粒,随浓度和时间的变化,NBT阳性率无明显增加,与空白对照组比较无显著差异(P>0.05),明显低于阳性对照组(P<0.01)。见表3。
表3 不同质量浓度威灵仙总皂苷对NB4细胞NBT还原率的影响
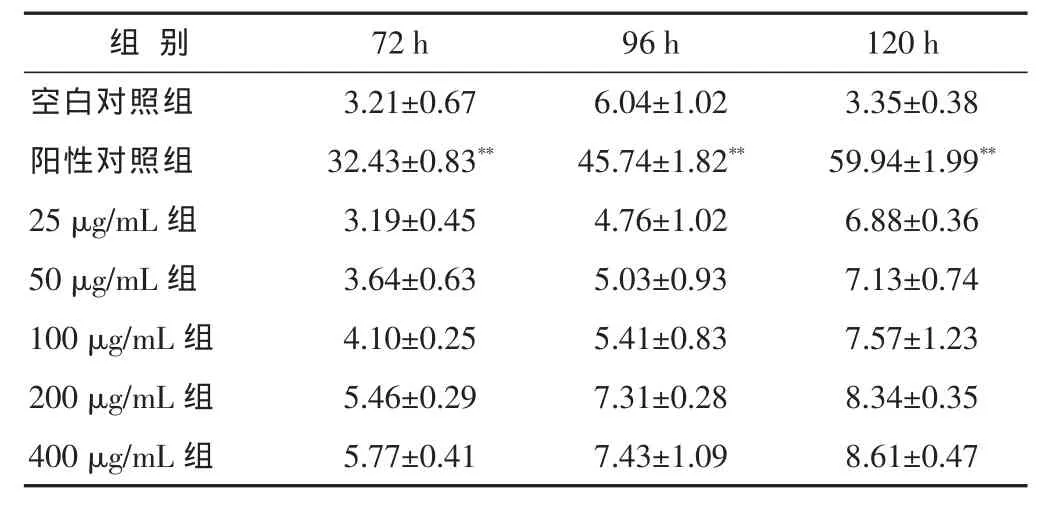
表3 不同质量浓度威灵仙总皂苷对NB4细胞NBT还原率的影响
?
2.4 透射电镜 与Wright's-Giemsa染色的细胞形态学改变类似,实验组经威灵仙总皂苷作用96 h后,在透射电镜下并未发现有较明显的胞浆、胞核成熟现象,仅个别细胞出现杆核或者肾形核改变。但是观察到NB4细胞明显呈现凋亡形态学变化:胞膜皱缩、染色质凝聚并边集呈月牙状改变,核仁消失。见图2。
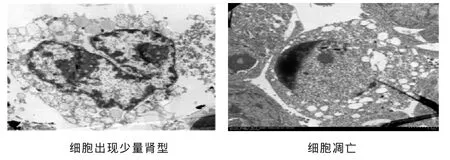
图2 威灵仙总皂苷400 μg/mL作用96 h后NB4细胞电镜图
2.5 细胞表面分化抗原CD11b、CD33的检测 1 μmol/L ATRA作用NB4细胞后,可明显使CD11b表达增加(P<0.01),CD33表达下降。而威灵仙总皂苷各剂量组CD11b表达的阳性率低,CD33表达无明显下降,与空白对照组比较无显著差异 (P>0.05)。 见图 3,表 4。
表4 不同质量浓度威灵仙总皂苷作用于NB4细胞72 h 后CD11b、CD33 表达(n=3
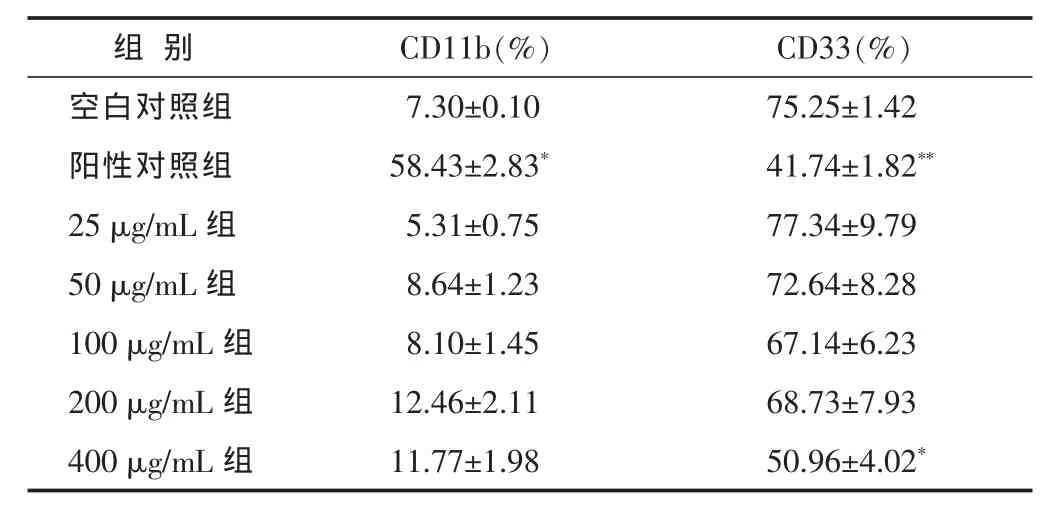
表4 不同质量浓度威灵仙总皂苷作用于NB4细胞72 h 后CD11b、CD33 表达(n=3
?
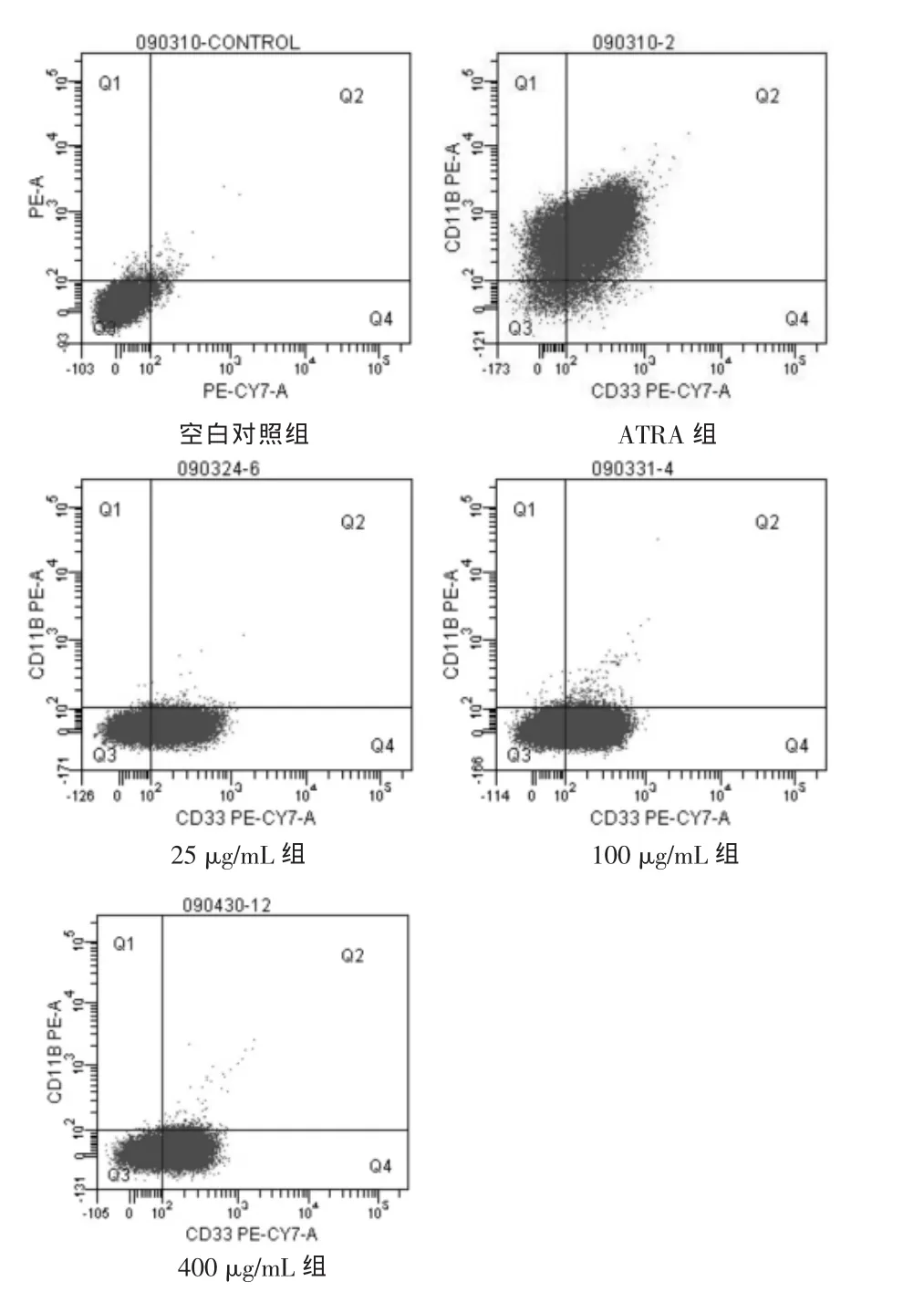
图3 不同剂量威灵仙总皂苷作用NB4细胞72h后CD11b、CD33的表达
3 讨 论
本研究发现威灵仙总皂苷对NB4细胞增殖有明显的抑制作用,随着作用质量浓度增大、作用时间增长,细胞增殖率明显降低,抑制率明显增高,呈现剂量和时间的量效关系。该结果与我们前期报道一致,与文献报道亦相符合[4]。在120 h所有实验组的抑制率出现整体轻度下降,根据120 h阴性对照组台盼蓝拒染率的明显下降,分析可能与在实验后期细胞死亡率增加有关。
NB4细胞在被诱导向正常细胞方向分化成熟过程中,逐渐获得吞噬能力,细胞糖代谢活跃。在TPA的激发下,细胞内超氧阴离子产生增多,中间代谢产物大量脱氢,所脱的氢能将无色染料NBT还原沉淀于胞质内,呈现蓝黑色颗粒沉着于细胞内有酶活性的部位,显微镜下可见阳性细胞有着色斑。这种细胞即为NBT还原阳性细胞,是细胞分化成熟的重要标志。本研究结果显示,不同剂量的威灵仙总皂苷作用NB4细胞后,细胞内无或者仅有少量的蓝色颗粒,但数量明显低于维甲酸诱导的阳性对照组,随着威灵仙总皂苷剂量的增加,NBT阳性率无明显增加,由此提示威灵仙总皂苷诱导分化作用不明显。同样,在透射电镜检测中发现,威灵仙总皂苷组干预后细胞并未出现较明显的胞浆、胞核成熟现象,但是却观察到NB4细胞呈现胞膜皱缩、染色质凝聚并边集呈月牙状改变,核仁消失等凋亡形态学变化。然而,在诱导分化实验中,细胞形态改变不一定典型,而且一些早期前体细胞缺乏形态学和生物学的特征,因而单凭形态学判断有一定的困难。现已知,随着白血病细胞分化,细胞膜表面某些蛋白抗原也相应发生改变,根据抗原表达可较精确地判断试验细胞所处的分化阶段。CD33抗原是早期粒细胞的标志,90%AML患者的白血病细胞表达CD33抗原,其表达降低可作为细胞分化成熟的标志之一。CD11b抗原是细胞成熟分化的另一标志,早幼及早中幼粒细胞表面不表达CD11b,而随着细胞分化成熟为各期粒细胞以及成熟单核细胞,CD11b表达阳性率逐渐升高[8],近年来已经把CD11b作为髓系白血病分化的重要标志。本研究采用流式细胞仪检测两种抗原的表达,其结果与镜下观测一致,NB4细胞经各剂量威灵仙总皂苷处理后,细胞表面的CD33未随时间和浓度的变化出现下降趋势,而CD11b也未随着时间和剂量的变化而表达增加。CD33、CD11b的表达与空白对照组相比无明显差异,而ARTA组可以显著提高NB4细胞CD11b的表达并诱导CD33抗原表达降低。流式法检测两种抗原表达结果与镜下观测一致。因此,通过本实验以及前期观察,威灵仙总皂苷各质量浓度组对急性早幼粒细胞白血病NB4细胞无明显的诱导分化作用。产生明显的增殖抑制作用的原因可能系诱导NB4发生凋亡为主。至于威灵仙总皂苷如何诱导细胞凋亡以及发生凋亡的机制有待进一步研究探讨。
[1] 吴寿金,赵泰,秦永祺.现代中草药成分化学[M].北京:中国医药科技出版社,2002:486.
[2] 赵燕强,杨立新,张宪民,等.威灵仙的成分、药理活性和临床应用的研究进展[J].中药材,2008,31(3):465.
[3] 邱光清,张敏,杨燕军.威灵仙总皂苷的抗肿瘤作用[J].中药材,1999,22(7):351-353.
[4] 周云,黄纯兰,李录克,等.威灵仙皂苷对急性早幼粒细胞白血病细胞株NB4细胞的凋亡诱导作用及其机制[J].肿瘤防治研究,2011,38(8):881-885.
[5] 黄莉,黄纯兰,周云,等.威灵仙总皂苷的分离纯化[J].四川中医,2009,27(3):40-42.
[6] 黎海彬,李小梅.大孔吸附树脂及其在天然产物研究中的应用[J].广东化工,2005,32(3):22-25.
[7] 徐先祥,夏伦祝.大孔吸附树脂分离纯化威灵仙总皂苷的工艺研究[J].中药新药与临床药理,2006,17(1):57-59.
[8] Pahl HL,Rosmarin AG,Tenen DG,et al.Characterization of the Myeloid specific CD11b promoter[J].Blood,1992,79:865-870.

