皂荚抗肝癌细胞成分的初步研究
张振宇 张晓丽 程红球
(1.汕头大学医学院第二附属医院,广东 汕头 515041;2广东省深圳市第二人民医院,广东 深圳 518035)
皂荚为豆科植物皂荚的果实,味咸,性温,无毒,是中医治疗乳腺癌、肺癌、肝癌等多种癌症常用的配伍药之一,被列为抗癌中草药。2005年6月,香港理工大学与美国国立癌症研究所研究发现[1-2],皂荚的浓缩液具有抗癌特性,可有效地抑制血癌及多种人类固体肿瘤,包括乳腺癌、肝癌和前列腺癌等癌细胞的生长,但其作用的物质基础不明。本实验主要通过逐级提纯皂荚研究其对肝癌细胞的作用机制,并为进一步分析其作用成分提供基础。
1 材料与方法
1.1 细胞株人肝癌细胞bel-7402,由上海细胞生物学研究所陈瑞铭1978年建株,购自武汉大学中国典型培养物保藏中心。
1.2 药物皂荚由湖北省药材公司提供,皂荚提取液由湖北中医学院药学院制作提供,皂荚生药质量浓度为1 g/mL。
1.3 试剂及仪器bax单抗、bcl-2单抗、P53单抗、超敏S-P(鼠)即用型免疫试剂盒、DAB显色剂、Annexin V-FITC细胞凋亡检测试剂盒、TIANamp Genmic血液/细胞/组织基因组DNA提取试剂盒、PCR-ELISA端粒酶试剂盒均由福建迈新公司提供,RPMI-1640培养液、DMSO、小牛血清、MTT等均由晶美公司提供。流式细胞仪(美国COUITER公司,EPICSELTE ESP型),倒置相差显微镜 (日本OLYMPUS公司,LH50A型),电泳仪(CBS公司,MGU-102T),凝胶成像分析仪 (美国UVP公司,GDS8000型),液闪仪(美国BACKMAN COULTER公司,LS6500型),酶标仪器(美国Bio-Rad公司),净化工作台(苏州,SW-CJIF 型),CO2培养箱(美国 SHELDON 公司,TC2323型)。
1.4 分组随机分为对照组、皂荚提取物低、中、高剂量组(质量浓度分别为 0.05、0.1、0.2 mg/mL)。
1.5 细胞培养人肝癌细胞bel-7402接种于含10%小牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640完全培养液中,在37℃、含5%CO2培养箱内培养,并用0.25%胰蛋白酶消化传代。
1.6 MTT法检测药物对细胞生长的抑制情况将传代的人肝癌细胞bel-7402浓度调整为5×105/mL,接种于96孔培养板,每孔200 μL,共分4组,每组均设为6个平行孔,培养24 h至细胞生长旺盛后,去培养液,随机分为对照组,皂荚提取物低、中、高剂量组 (质量浓度分别为0.05、0.1、0.2 mg/mL)。 对照组不加药物,皂荚提取物各剂量组分别加药液180 μL并继续培养。48 h后,各孔再加入 MTT 贮液(5 mg/mL)20 μL,继续培养 3 h,吸弃上清液,每孔加入DMSO 200 μL,将培养板置于微孔振荡器上振荡10 min,溶解微小结晶,然后全自动酶标仪上选择波长490 nm检测各孔A值。计算细胞增殖抑制率=(1-实验组A值/对照组A值)×100%。
1.7 流式细胞仪检测各组细胞凋亡峰将bel-7402细胞分别培养在对照组(无药血清培养液)、皂荚提取物低、中、高剂量组(质量浓度分别为 0.05、0.1、0.2 mg/mL)培养液中,培养 72 h后收集各组细胞并制成1×106/mL的细胞悬液,1000 r/min离心5 min,弃上清液,PBS洗涤2次后再将细胞浓度调整为1×106/mL,以 70%的冷乙醇 (1∶4)固定待检,用 PBS洗去固定液,加RNaseA,37℃水浴30 min,再加PI染色液混匀,4℃避光30 min,在流式细胞仪上选择488 nm激发光检测各组细胞DNA含量,得出凋亡率。
1.8 检测凋亡相关基因表达免疫组化法检测bax、bcl-2、P53蛋白的表达。取对数生长期细胞bel-7402,调整细胞浓度为1×105/mL接种于内置无菌玻片24孔培养板(1mL/孔)。培养24 h后,分为对照组(不加药物),皂荚提取物低、中、高剂量组(质量浓度分别为0.05、0.1、0.2 mg/mL)。以上各组平行3孔,继续培养,48 h后爬片用PBS漂洗两遍,经4%多聚甲醛固定30 min,PBS洗涤后自然风干,-20℃保存备用。检测方法按免疫组化试剂盒说明书进行。阳性细胞的特征为胞浆或胞核染为黄色或棕黄色,阴性细胞不染色。
1.9 端粒酶活性测定按端粒酶检测试剂盒说明书进行。即:将bel-7402细胞分别培养在对照组(无药血清培养液),皂荚提取物低、中、高剂量组(质量浓度分别为 0.05、0.1、0.2 mg/mL),培养72 h后收集各组细胞于1.5 mL Ep管,加入1×CHARPS裂解液200 μL,震荡悬浮细胞。冰浴包被30 min后,12000 r/min,4℃,离心20 min,吸取上清,即得到含有端粒酶的细胞提取物。在PCR管中加入 PCR 反应液(5×TARP反应液 10 μL、Taq酶 2U、双蒸水 37.6 μL、细胞提取物 2 μL),30 ℃,延伸扩增反应 30 min,然后进行PCR反应33个循环,每个循环包括94℃,30 s,55℃,30 s。将酶标板包被阻断稀释缓冲液两次后,加入TARP反应液5 μL,37 ℃孵育 60 min,洗涤,加入 anti-DAPAb 100 μL/孔室温包被30 min,洗涤,加入TMB反应液,室温包被3~10 min后,加入终止液100 μL/孔,在酶标仪上选择波长450 nm测定吸光度A值。计算抑制率=(1-实验组A值/对照组A值)×100%。
1.10 统计学处理应用SPSS10.0统计软件。数据采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 皂荚提取物对bel-7402细胞增殖的影响见表1。MTT法实验结果显示,皂荚提取物中、高剂量组对人肝癌细胞bel-7402增殖均具有显著的抑制作用 (P<0.05),其中高剂量组对bel-7402细胞增殖的抑制作用具有非常显著的统计学意义 (P<0.01)。
表1 各组bel-7402细胞增殖比较(±s)

表1 各组bel-7402细胞增殖比较(±s)
与对照组比较,*P<0.05,**P<0.01。 下同。
组 别 n A值 抑制率(%)对照组 6 1.721±0.031皂荚提取物低剂量组 6 1.556±0.023 9.31皂荚提取物中剂量组 6 1.502±0.017* 12.79皂荚提取物高剂量组 6 1.431±0.018** 16.86
2.2 皂荚提取物对bel-7402细胞周期的影响见表2。皂荚提取物低、中、高剂量组与对照组作用人肝癌bel-7402细胞72 h后,bel-7402细胞在G0~G1期的比例增高,S期的比例降低,与对照组比较差异非常显著(P<0.01),在G0~G1期前可见凋亡峰。
表2 各组bel-7402细胞周期比较(%,±s)
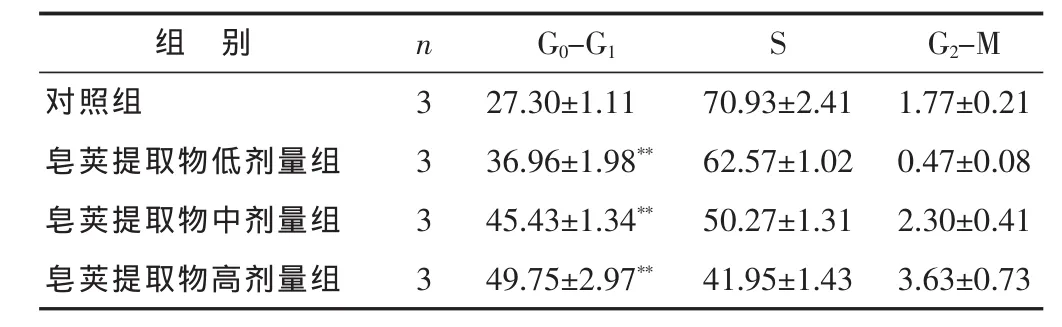
表2 各组bel-7402细胞周期比较(%,±s)
组 别 n G0-G1对照组 3 27.30±1.11皂荚提取物低剂量组 3 36.96±1.98**皂荚提取物中剂量组 3 45.43±1.34**皂荚提取物高剂量组 3 49.75±2.97**S G2-M 70.93±2.41 1.77±0.21 62.57±1.02 0.47±0.08 50.27±1.31 2.30±0.41 41.95±1.43 3.63±0.73
2.3 皂荚提取物对bel-7402细胞凋亡基因的影响见表3。皂荚提取物低、中、高剂量组bcl-2表达显色与对照组比较无显著差异,bax、P53表达显色较对照组明显加深,差异有统计学意义(P<0.05 或 0.01),且皂荚提取物低、中、高剂量组组间 bax、P53蛋白表达无显著差异。
表 3 各组 P53、bax、bcl-2 表达比较(%,±s)

表 3 各组 P53、bax、bcl-2 表达比较(%,±s)
组 别 n P53阳性细胞率对照组 3 24.50±6.04皂荚提取物低剂量组 3 26.13±0.47*皂荚提取物中剂量组 3 34.97±2.34**皂荚提取物高剂量组 3 38.50±0.53**bax阳性细胞率 bcl-2阳性细胞率21.03±2.57 41.27±2.14 27.80±1.21** 39.18±1.52 34.61±0.54** 37.23±1.16 40.33±0.52** 36.73±2.79
2.4 皂荚提取物对bel-7402细胞端粒酶活性的影响见表4。与对照组比较,皂荚提取物低、中、高剂量组显著下降(P<0.05或0.01),表明皂荚提取物各剂量血清均可抑制bel-7402细胞端粒酶活性,其中皂荚提取物高剂量组对bel-7402细胞端粒酶活性的抑制具有非常显著的作用(P<0.01),
表4 各组bel-7402端粒酶的活性比较(±s)

表4 各组bel-7402端粒酶的活性比较(±s)
组 别 n 端粒酶活性(A450) 抑制率(%)对照组 6 0.935±0.049皂荚提取物低剂量组 6 0.672±0.076* 28.7皂荚提取物中剂量组 6 0.632±0.035* 32.9皂荚提取物高剂量组 6 0.562±0.056** 40.4
3 讨 论
肝癌的发生机制大致认为是致癌因素导致染色体畸变 (错位、倒转、断裂、插入、重排等)、癌基因的激活、生长因子及其受体的异常、抑癌基因的失活等,导致肝细胞的遗传学特征发生改变,最终形成肝癌细胞。肝细胞癌变包括基因突变与基因调控失常两种理论解释。人肝癌细胞的生长受凋亡抑制基因与凋亡促进基因的调控。bax、bcl-2均可彼此形成异二聚体或与自身形成同源二聚体,其抑制或促进凋亡主要取决两者的比例。当bax蛋白或蛋白二聚体占优势时,细胞凋亡可被诱导;当bcl-2蛋白或蛋白二聚体占优势时,细胞凋亡被抑制。P53则严密监控细胞内外的变化,一旦细胞受到攻击出现损伤,P53立即被激活,使受损伤的细胞停顿在G1期以便DNA得到修复,或指示其进入凋亡[2]。P53基因发生突变或者其功能失活后,细胞周期的调节失去一种具有抑制作用的调节因子,细胞程序性死亡的调节失去一种具有促进作用的调节因子,最终使细胞生长和调节失控,导致细胞持续分裂和癌变[3]。当细胞周期发生障碍时,细胞增殖将受到抑制,而DNA合成障碍是细胞周期发生障碍的较常见原因[4-5]。 另外,研究表明[6-7],肿瘤细胞大多表达端粒酶活性增强,而细胞增殖周期的调控与端粒酶活化密切相关,端粒酶活化有可能是所有恶性肿瘤发生过程的一个必经之路,癌基因的激活和/或抑癌基因的失活最终导致端粒酶活化,从而导致细胞端粒的丢失与重新组合达到一种动态平衡,恶性肿瘤细胞得以无限繁殖[8]。
本实验显示,皂荚提取物对人肝癌细胞bel-7402的增殖具有显著抑制作用,能够诱导bel-7402细胞凋亡,抑制bel-7402细胞端粒酶活性,调控癌基因活化与抑癌基因失活,阻止肿瘤细胞的无限繁殖。与对照组比较,高剂量皂荚提取物对肿瘤细胞增殖的抑制作用更显著。本次研究的各个项目的数据结果并不完全一致,考虑可能与药物质量浓度的稳定性及纯度有一定关系。笔者推测皂荚提取物对肿瘤细胞的作用机制可能如下:抑制活化的端粒酶,阻止细胞DNA的无限繁殖;提升抑癌基因的活性,促进癌细胞的凋亡;可能作为一种信息物质,直接参与细胞凋亡活动,抑制肿瘤细胞DNA无限复制。
[1]Yashima K,Litey LA,Kaiser L,et al.Telomerase activity in gastriccancer[J].Cancer Res,1997,57(12):2373-2377.
[2]杨建青,杨连粤.化疗诱导人肝癌细胞凋亡中p53和bcl-2基因的调控[J].中华肝胆外科杂志,2001,7(1):31-33.
[3]成军.肿瘤相关基因[M].北京:北京医科大学出版社,1999:102.
[4]Enoch T,Norbury C.Cellular resoneses to DNA damage:Cell-cycle checkpoints,apotosisand the roles of p53 and Atm[J].Trends Biochem Sci,1995,20:426-430.
[5]Terada T,Nakanuma Y.Expression of apoptosis,proliferating cellnuclear antigens (bcl-2,C-myc,Fas,Lewis and p53)in human cholangiocarcinomas and hepatocellarcarcinomas[J].Pathol Int,1996,46:764-770.
[6]Kim NW,Piatysezk MA,Prouse KR,et al.Specific associasion of humantelomerse activity with immortal cellsand cancer[J].Sciene,1994,266(18):2011-2015.
[7]Landberg G,Niesen NH,Nilsson P,et al.Telomerase activity is asscission with cell cycle deregulation in human breast cancer[J].Cancer Res,1997,57(3):549-553.
[8]Rhyu MS.Telomerase,and immortality[J].Jnatl Cancer Inst,1995,87:884-885.

