血浆中PAI-1和TAFI水平与溶栓后出血性转化相关性研究
孙 威, 杨 颖, 李雪媛, 王洪志, 贾玉杰, 马舒贝, 张静波
溶栓后出血性转化一直是制约急性缺血性脑卒中开展溶栓治疗的重要因素。目前,世界各国指南均已对脑梗死的溶栓治疗达成共识,也有多组大型、随机、双盲安慰剂对照的实验证据支持。但对于溶栓后出血性转化问题却依然悬而未决,成为溶栓治疗领域一大难题。出血性转化受多种因素影响,如年龄、血压、血糖、梗死灶的大小、血脑屏障的完整性等等。
近年来,已有研究发现血浆组织型纤溶酶原激活物(t-PA)及其抑制剂纤溶酶原激活物抑制因子(plasminogen activator inhibitor,PAI),凝血酶激活的纤溶抑制物(thrombin activatable fibrinolysis inhibitor,TAFI)水平的变化对纤溶系统的平衡及出血性转化起重要作用[1~3]。因此溶栓治疗后出血转化相关的生物学标记物在血浆中的含量与rt-PA溶栓的疗效及出血风险的大小可能存在密切的关系。故我们采用了前瞻性的研究方法对45例急性脑梗死静脉rt-PA溶栓的患者血浆TAFI及PAI-1的水平进行了动态观察,并探讨其在溶栓后出血性转化中的预警作用。
1 资料与方法
1.1 研究对象 45例发病4.5h内急性脑梗死病例(其中有15例为后循环梗死病例,溶栓时间窗延长至12h以内。)。均为2008年1月~2011年12月我院神经内科住院患者。对符合溶栓条件的患者采用静脉Rt-PA以0.9mg/kg溶栓,总量≤90mg。
1.2 分组 (1)溶栓后出血转化组;(2)溶栓后无出血转化组。
1.3 溶栓标准 入选标准:(1)年龄18~80岁;(2)在症状出现4.5h内开始溶栓治疗,其中部分后循环梗死患者在发病12h内进行溶栓治疗;(3)临床诊断为缺血性脑卒中,推测原因为脑缺血,CT排除出血;(4)卒中症状持续至少30min,治疗前无明显改善。临床表现和全脑缺血(如晕厥)、癫痫或偏头痛相鉴别;(5)患者同意接受溶栓治疗,并同意对病史数据的采集保存和随访。排除标准:(1)CT检查发现高密度病灶(出血)、明显的占位效应伴中线移位(梗死范围大)、急性低密度病灶或脑沟消失>MCA供血范围的1/3、颅内肿瘤、动静脉畸形或蛛网膜下腔出血征象;(2)昏迷或临床评估(如NIHSS>25)和/或其它合适的影像学证实为严重卒中;(3)发病时伴有癫痫发作;(4)90d内有过卒中史;(5)其他RT-PA溶栓禁忌证同RT-PA药品说明书。
1.4 测定指标 样本在入院后溶栓前基线PAI-1、TAFI水平,溶栓后次日空腹静脉血的PAI-1、TAFI水平,样本的基线NIHSS评分。
1.4.1 临床指标 观察3个月内的好转率、死亡率、治愈率等,因与本文主题无关,故数据不予呈现。
1.5 试剂 ELISA试剂盒为美国SANTA试剂盒。
2 结果
2.1 一般情况 入组患者共有45例,全部予静脉rt-PA溶栓治疗,后循环梗死患者有15例。出血转化组有10例。其中症状性出血转化病例有3例,无出血转化组35例。患者平均年龄为66.60±12.98岁,男性略多于女性,少部分患者合并糖尿病,合并房颤接近 1/4(24.4%,11/45),近 2/3(68.9%,31/45)患者合并高血压病。溶栓前NIHSS为7.69±5.62分。两组病例基线资料差异无统计学意义(见表1)。
2.2 PAI-1指标的比较 溶栓前两组基线PAI-1水平差异有明显统计学意义(P=0.037)。溶栓后次日复查晨血PAI-1水平比较,出血转化组明显较无出血转化组值更低(P=0.035)(见表2),有统计学意义。两组病例的PAI-1水平在溶栓前后均无明显变化(P=0.509,0.136)(见表2)。
2.3 TAFI指标的比较 溶栓前两组基线TAFI水平有差异,出血转化组的TAFI值更低,与无出血转化组比较有明显统计学意义(P=0.024)。溶栓后次日复查晨血 TAFI水平比较,出血转化组的TAFI值同样低于无出血转化组,两组数据有明显统计学差异(P=0.042)(见表2)。两组病例的TAFI水平在溶栓前后均无明显变化(P=0.433,0.344)。
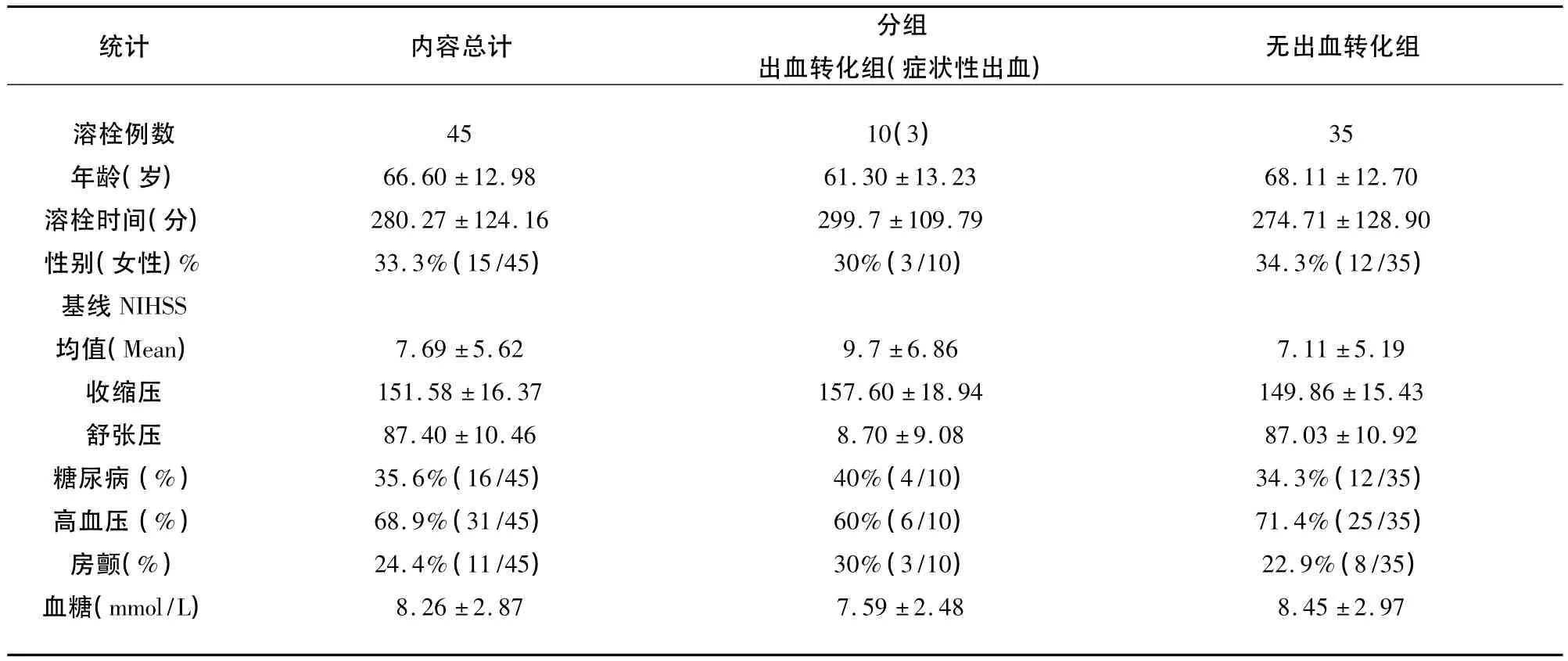
表1 溶栓患者的基本资料
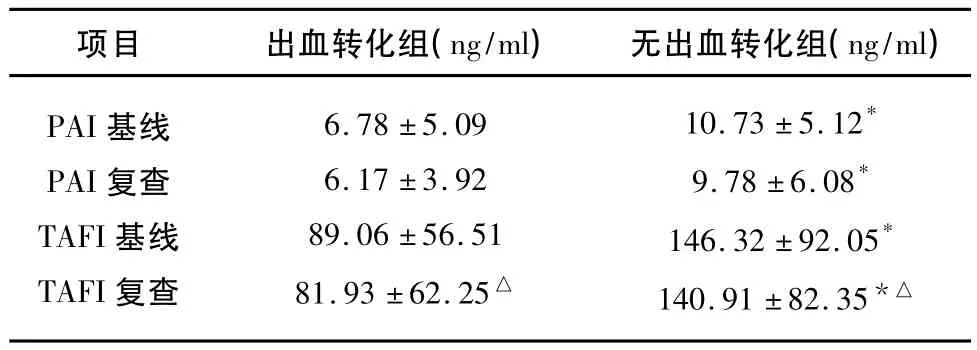
表2 不同时期PAI-1及TAFI水平比较
3 讨论
脑梗死后出血性转化(hemorrhagic transformation,HT)指的是急性脑梗死后发生的脑内出血,包括自然发生的出血和药物治疗后出现的出血。临床研究发现,急性脑梗死后自发出血性转化的发生率为10% ~43%[4],应用组织型纤溶酶原激活物(t-PA)或链激酶溶栓后出血性转化率提高2~3倍[4~6]。其原因在于急性脑梗死发生后,急性缺血缺氧可以导致血脑屏障破坏。在溶栓治疗后,血管再通,血流再灌注,出现再灌注损伤,可进一步破坏血脑屏障。此外,t-PA本身活性成分是一种糖蛋白,可直接激活纤溶酶原转化为纤溶酶,导致t-PA成为体内重要的纤溶激活剂。
同时体内还存在着PAI,PAI是很重要的纤溶系统的抑制因子,它主要包括PAI-1、PAI-2等。其中PAI-1尤为重要。PAI-1来自活化的血小板颗粒及增生的血管壁平滑肌细胞,PAI-1是一种丝氨酸蛋白酶抑制剂,分子量50kD,PAI-1基因位于7号染色体(q21.32q22),由9个外显子和8个内含子组成。PAI-1可通过与t-PA形成1∶1分子复合物,使t-PA失活。PAI-1是t-PA和尿激酶型纤溶酶原激活物的主要抑制剂。而rt-PA是重组的组织型纤溶酶原激活剂,故PAI-1很可能与rt-PA溶栓的治疗效果及出血风险存在密切的关系[7,8]。Hosomil等的研究结果认为“动脉硬化性脑梗死患者存在着以血浆tPA活性降低和PAI-1活性增高为特征的低纤溶状态”[12]。
我们的研究结果显示出血转化组溶栓前及溶栓后复查的PAI-1水平较无出血转化组水平更低(P=0.02),原因可能在于PAI基线水平低,导致对t-PA的抑制作用下降,一定程度促使纤溶过程失衡,高纤溶状态从而诱发出血性转化的发生。与本研究结论相同,目前已有研究证实了低PAI-1水平易导致出血[7,8]。Ribo等对大脑中动脉闭塞并接受 rt-PA 溶栓治疗的患者的研究发现:PAI-1<21.4g/L会使SICH 显著增加(OR=12.75;CI:1.17-139.2;P=0.04)。而且该研究还观察到PAI-1水平与出血严重程度相关[9]。
TAFI属含锌的金属羧基肽酶,由423个氨基酸残基(aa)组成,主要由肝脏合成,也存在于血小板内,在血小板激活时释放到血液。体外和体内实验的数据表明:“激活 TAFI则可抑制血栓溶解[1]”。TAFI以无活性的酶原形式在血液中循环,其血浆平均浓度约为75nmol/L。测量方法不同,结果可有38% ~169%的波动,也有实验报道称TAFI的血浆浓度为(113±13)nmol/L。当其浓度>275nmol/L时,与血栓溶解时间呈正相关。TAFI在体内可被凝血酶、凝血酶调节蛋白(TM)、纤溶酶、肝素、胰蛋白酶等物质激活[10]。但血浆TAFI的活性仅出现于血液凝固以后。能被纤维蛋白酶、纤维蛋白溶酶(plasmin),纤维蛋白酶-血栓调节素复合物(thrombin thrombo-modulin complex)等激活成为羧肽酶B样的酶(TAFIa),当TAFIa接触纤维蛋白凝块时,它就催化其C末端切去赖氨酸,从而减少纤维蛋白酶原激活所需的辅助因子的活性[11]。纤维蛋白酶原对纤维蛋白凝集作用效力减少,从而导致纤维蛋白溶解时间延长。在一定条件下,TAFIa浓度与溶栓时间呈正相关。已有研究证实有研究显示TAFI水平与增强rt-PA溶栓疗效及大脑中动脉的早期再通明显相关[3]。故TAFI具有抗纤溶的作用,其在血浆中的含量与rt-PA溶栓的疗效及出血风险的大小可能存在密切的关系。
本研究发现出血转化组的基线TAFI水平更低(P=0.052),说明在TAFI的抗纤溶作用明显减弱,促进了出血转化的发生。但与本研究结果不同的是Ribo等的研究,该研究观察了77例大脑中动脉闭塞并接受rt-PA溶栓治疗的患者[9]。结果发现TAFI>180%会使 SICH 显著增加(OR=12.9;CI:1.41~118.8;P=0.02)。对这个看似矛盾的结果,Ribo将其解释为:当血液中的TAFI水平过高时,会导致其活性降低,从而产生低纤溶状态,使出血风险增加。两个研究结论产生差异的原因在于,我们的研究包含了部分后循环梗死样本,且对照组也非健康对照组,与Ribo实验样本及试验方法均不同,故亦无法验证Ribo实验结论。
我们的研究还存在一些局限性如样本量较小、无健康对照组等,因此限制了一些统计学方法的应用。Ribo实验发现若联合TAFI>180%和PAI-1<21.4g/L两个指标,对预测rt-PA溶栓治疗后症状性出血的敏感性为75%,特异性为97.6%[9]。故可以这样认为如果对原始统计学变量进行细化分类,以二次变量进行统计学处理,可能会产生更积极的结果。但由于此项技术开展需要大样本量,而本研究出血性转化样本数量较少,暂无法进行更深入的统计学分析。有待于进一步扩大样本量后深入研究。
综上所述,通过本研究可得出血浆中PAI-1和TAFI水平与溶栓后出血性转化相关性较高。当溶栓前及溶栓后PAI-1及TAFI的低水平表达均可增加溶栓后出血性转化的风险。但是将两种指标对溶栓后脑出血性转化的预测应用于临床仍需不断探索及研究。
[1]Brouns R,Heylen E,Sheorajpanday R,et al.Carboxypeptidate U(TAFIa)decreases the efficacy of thrombolytic therapy in ischemic stroke patients[J].Clin Neurol Neurosurg,2009,111:165 -170.
[2]龙 洁,曲 辉,白 云,等.脑血栓形成患者血浆组织纤溶酶原激活物及其快速抑制物的变化及临床意义[J].中华神经科杂志,1998,31(5):267 -270.
[3]Montaner J,Ribo M,Monasterio J,et al.Thrombin-activable fibrinolysis inhibitor levels in the acute phase of ischemic stroke[J].Stroke,2003,34:1038 -1040.
[4]Berger C,Fiorelli M,Steiner T,et al.Hemorrhagic transformation of ischemic brain tissue:asymptomatic or symptomatic[J].Stroke,2001,32:1330-1335.
[5]Gilligan AK,Markus R,Read S,et al.Baseline blood pressure but not early computed tomography changes predicts major hemorrhage after streptokinase in acute ischemic stroke[J].Stroke,2002,33:2236 -2242.
[6]Motto C,Ciccone A,Aritze E,et al.Hemorrhage after an acute ischemic stroke[J].Stroke,1999,30:761 - 764.
[7]Ribo M,Montaner J,Molina CA,et al.Admission fibrinolytic profile is associated with symptomatic hemorrhagic transformation in stroke patient s treated with tissue plasminogen activator[J].Stroke,2004,35:2123-2127.
[8]Gils A,De Clerck PJ.The structural basis for the pathophysiological relevance of PAI-1 in cardiovascular diseases and the development of potential PAI-1 inhibitors[J].Thromb Haemost,2004,91:425 -437.
[9]Ribo M,Montaner J,Molina CA,et al.Admission fibrinolytic profile predict sclotlysis resistance in stroke patients treated with tissue plasminogen activator[J].Thromb Haemost,2004,91:1146 -1151.
[10]Mao SS,Cooper CM,Wood T,et al.Characterization of plasmin-mediated activation of plasma procarboxypeptidase B.modulation by glycosaminoglycans[J].J Biol Chem,1999,274(49):35046 -35052.
[11]Boffa MB,Hamill JD,Maret D,et al.Acute phase mediators modulate thrombin-aetivable fibrinolysis inhibitor(TAFI)gene expression in HepG2 cells[J].J Biol Chem,2003,278(11):9250 -9257.
[12]Hosomil N,Lucero J,Heo JH,et al.Rapid differential endogenous plasminogen activator expression after acute middle cerebral artery occlusion[J].Stroke,2001,32:341-348.

