肢体远端缺血预处理对抑制缺血性脑卒中的MRDWI研究
魏鼎泰, 陈秋雁, 吴富淋, 缪绍维, 张云亭
脑卒中是一种急性起病的脑血管意外,有着极高的致死率和致残率,是当今世界严重危害人类健康的疾病之一,迄今为止,尚未找到十分有效的办法治愈它。缺血预处理(ischemic preconditioning,IPC)能够使心肌、脑、肾脏以及骨骼肌等器官抵抗缺血损伤。这种保护效应可发生在同一器官的不同部位之间,也可发生在不同器官之间,称之为远端缺血预处理(remote preconditioning,RPC)[1]。RPC 能够保护包括心脏、肾脏、骨骼肌、胃、肺等在内的许多组织器官,更是目前针对实验性脑卒中治疗的新宠儿,其神经保护作用已在多种动物模型中得到证实[2~7]。尽管RPC的缺血保护性效应很明确,但对其具体机制目前知之甚少。
磁共振成像(magnetic resonance imaging,MRI),作为一种无创性成像技术在脑卒中的诊断上发挥着日益重要的作用,它不仅能够快速、特异性地显示出病灶,还能够协助评价病灶的可逆性,为临床治疗提供向导。弥散加权成像(diffusion weighted imaging,DWI)是一种能够检测活体组织内水分子扩散的无创性检查方法,DWI对细胞毒性水肿的存在有高度敏感性,可以发现超急性期的、小的以及多发的梗死灶,对急性或超急性期的梗死灶具有很大的确诊价值,被认为是早期诊断急性缺血性脑卒中最敏感的成像方式[8]。综上,RPC对脑缺血的神经保护作用明确,但应用MRI特别是DWI序列对RPC神经保护作用的评价尚未见报道,为此,我们以DWI作为检测指标来评价LRP对脑缺血的保护作用,并以此来间接探索肢体远端缺血预处理的神经保护机制。
1 材料和方法
1.1 动物 成年雄性SD大鼠(260~330g)48只,随机分为LRP组和脑缺血组。术前24h禁食不禁水;10%水合氯醛腹腔注射(300mg/kg),固定,脑缺血组分离出右侧股动脉,暴露90min;切开颈部皮肤,分离右侧颈总动脉、颈外动脉及颈内动脉,动脉夹夹闭颈内动脉,于颈外动脉近端近分叉处插入预先浸泡过2%肝素的线栓(直径0.24mm),松开颈内动脉夹,插入线栓直至距离分叉处约1.8cm~2.0cm,1h后拔出,结扎颈总动脉防止出血,缝合切口。LRP组肢体远端缺血预处理方法参照Ren等[6]所述,分离右下肢股动脉,动脉夹夹闭15min,恢复再灌15min,反复3个循环,后续脑缺血的诱导方法同前。术中保持大鼠体温在37℃ ±5℃。
1.2 MRI检测 大鼠恢复再灌后1、3、12、24h 行MRI(德国西门子 AvantoⅠclass 1.5T)检测,采用4cm 小线圈(德国西门子)采集T2WI/DWI图像。大鼠俯卧,采集冠状位图像。T2WI参数:TR/TE=2270ms/91ms;FOV100mm;层厚 3mm,7张。DWI参数:TR/TE=2800ms/136ms;FOV 130mm;层厚2.5mm,9 张。
1.3 神经行为学评分 大鼠在恢复再灌后24h参照5级4分法[9]进行神经行为学评分。0分:未见神经病学征象,即无神经功能缺损症状;1分:轻微的神经功能缺损,大鼠被提尾悬空时病灶对侧前肢呈屈曲、抬高、肩内收、肘关节伸直;2分:中度局灶性神经功能缺损,有向瘫痪侧旋转征象;3分:重度局灶性神经功能缺损,有向病灶对侧跌倒征象;4分:无自发活动及意识水平下降。
1.4 梗死面积的测量 大鼠在恢复再灌24h,10%水合氯醛腹腔注射麻醉,100ml预冷PBS(pH 7.4)心脏灌注,断头,冰上快速取脑,自额叶由前向后作冠状切片(厚2mm),共计5片;切片随后放入2%TTC染液(购自Amresco公司)室温孵育20min,4%多聚甲醛过夜;经扫描仪采集图像用于梗死面积测量。应用Image pro plus图像分析软件(Version 6.0,Media Cybernetics)对5张TTC染片扫描图像描边采集,分别测量皮层梗死面积及对侧大脑半球皮层面积,取其平均值,结果以皮层梗死面积/该对侧半球皮层面积的百分比来表示。
2 结果
2.1 LRP减少脑缺血梗死面积 TTC染色图片上可以直观的看出LRP组的梗死范围较脑缺血组缩小(见图1),统计结果显示LRP组的梗死面积为35.67±5.06%(n=5),较脑缺血组(45.75 ±3.70%)显著减少(P<0.01)(见图2)。
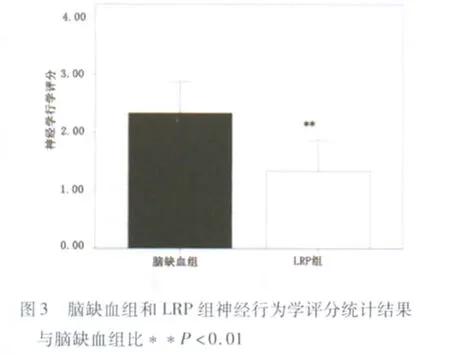
2.2 LRP改善脑缺血神经行为学缺陷 脑缺血组大鼠的行为学评分为2.333±0.5164(n=20);LRP组大鼠的行为学评分仅1.333±0.5164(n=20),其行为学缺陷较脑缺血组明显减轻(P<0.01)(见图3)。
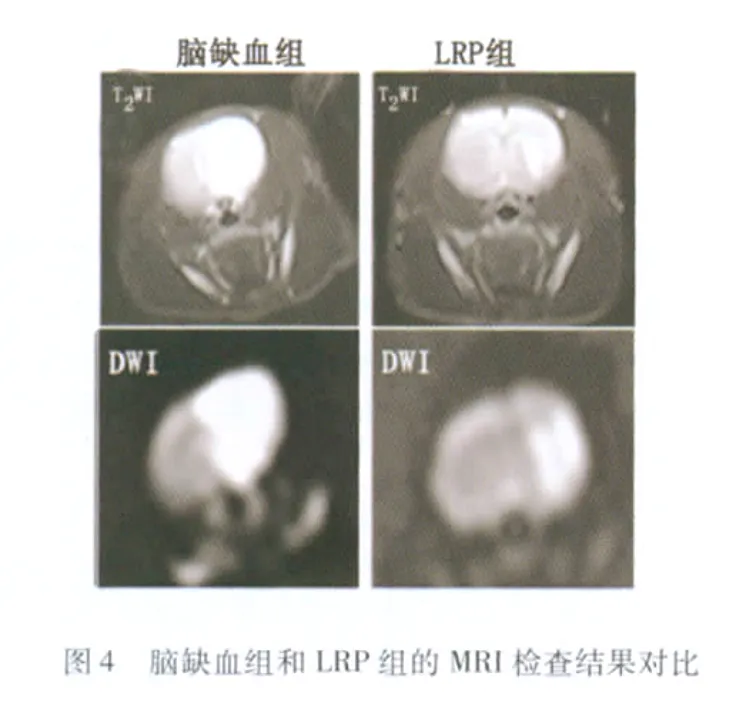
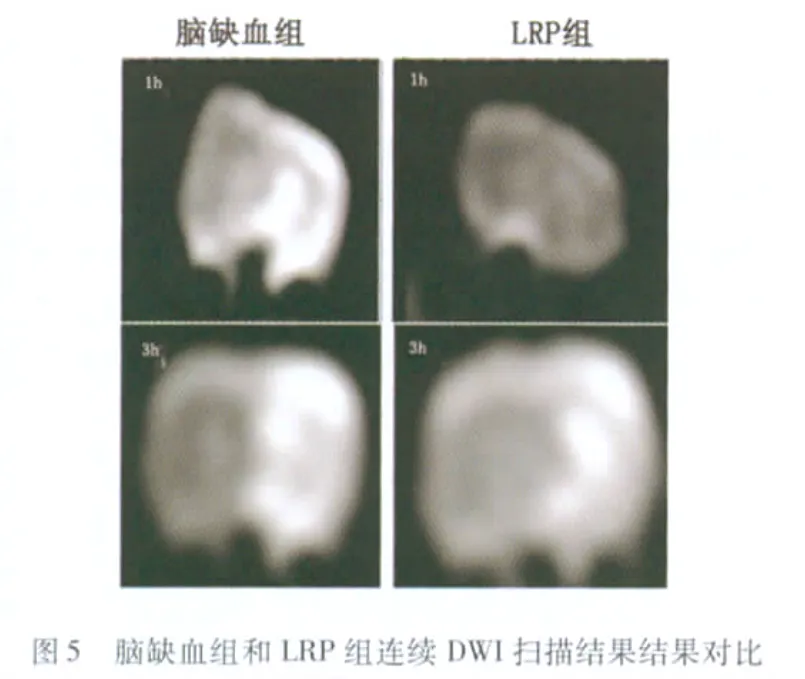
2.3 MRI表现 LRP组大鼠在 T2WI和 DWI上的病灶面积均较未经预处理的脑缺血组大鼠有所减小(见图4)。此外,连续的MRI扫描显示,经缺血预处理的大鼠在DWI上出现异常病灶的时间多在恢复再灌3h以后,而未经预处理的脑缺血组大鼠在1h的扫描点就已经出现了DWI的异常信号(见图5),这个现象未在T2WI中发现。
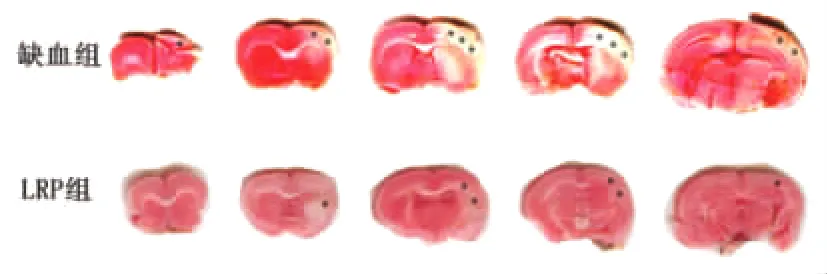
图1 TTC染色结果(*所示为梗死范围)
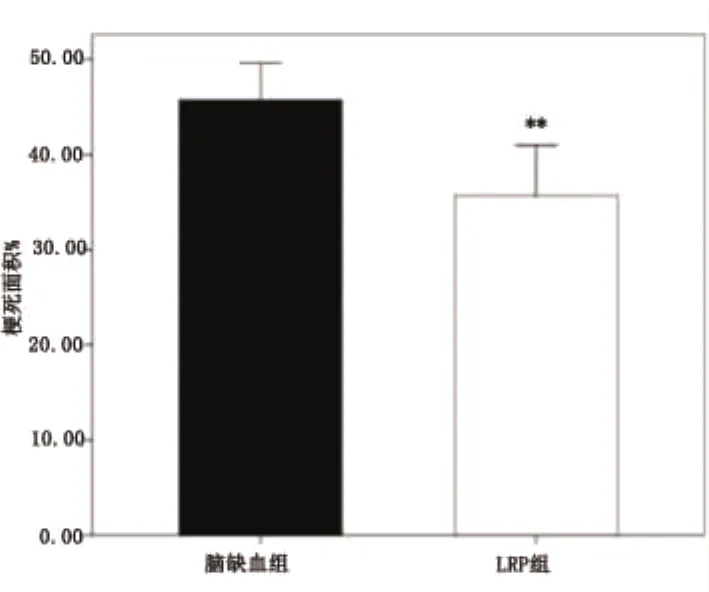
图2 脑缺血组和LRP组脑梗死面积的统计结果与脑缺血组比**P<0.01
3 讨论
在本项研究中,我们证实了LRP对后续的脑缺血刺激起到保护作用,首先表现在经过LRP处理的24只大鼠,神经学评分均在1~2分之间(1.333±0.5164,n=20),而未经预处理的24只脑缺血大鼠,神经学评分均在2 分以上(2.333 ±0.5164,n=20),表现更明显的行为学缺陷(P<0.01)(见图3),说明LRP能够改善神经行为学功能;其次,TTC的染色结果显示,LRP组的梗死面积较脑缺血组显著减少(35.67 ±5.06%vs 45.75 ±3.70%,P<0.01,n1=n2=5)(见图1、2)。LRP的神经保护作用明显,这与许多研究结果一致[4~7,10,11]。此外,本次研究是国内首次以MRI特别是DWI序列作为评价指标来评估肢体远端缺血预处理的神经保护作用;本项研究证实肢体远端缺血预处理不仅能够减少梗死病灶的面积,而且还能够延缓DWI上异常信号的出现时间(见图5)。
早期针对RPC的研究多采用一些有创性的研究手法,极大地限制了RPC在临床中的应用,直至1997年Oxman等[12]首次提出了一种低创性的预处理术式-肢体远端缺血预处理法,这种方法很快在研究领域得到了广泛应用。对于肢体缺血的具体处理方式也是多种多样的,比如夹闭双侧股动脉10min,恢复再灌 10min,重复 3 个循环[4,6],夹闭单侧股动脉30min[13],重复 2/3 循环的 5min 或 15min 的夹闭/再灌注[6],或者 15/30min 的单侧下肢动脉夹闭[4]。这些不同的术式之间必定存在着效果差异,在今后的研究中应更进一步致力于寻找出肢体预处理的最佳方式。
尽管RPC的缺血保护作用已在各式各样动物缺血模型中得到证实,但其确切机制还十分模糊。目前国内外关于RPC对脑缺血保护作用机制的相关文献寥寥无几,仅有少数一些研究给我们一些提示,Sun等[14]证实了肢体远端缺血预处理通过激活MAPK途径提高海马区神经元的存活率;Malhotra等[7]的研究表明RPC对脑的保护作用仅在预处理诱导后24h内有效,而使用神经阻滞剂六甲铵能够降低这种保护效应。另一项研究证实了RPC可以促进皮质神经元活性的修复,在低温停循环(HCA)下提高对缺氧缺血性损伤的耐受,同时还能帮助抵抗迟发的乳酸、丙酮酸爆发,并能够减轻厌氧代谢性损伤[15]。最近的一项研究表明RPC能够通过抑制galectin-9/Tim-3信号通路,抑制iNOS以及硝基酪氨酸的表达来提高脑组织的缺血耐受[11]。
在上述RPC机制的研究中,已有学者从细胞毒性、能量代谢等方面着手,在信号通路的转导上也有了初步的探索,而本项的研究结果为探索RPC的机制提供了一个全新的思考方向。在DWI序列检测对比中,我们发现,经LRP处理后的大鼠,其在DWI上出现的病灶较未处理的脑缺血大鼠不仅在面积上有所减少,而且出现的时间也较脑缺血组延迟:LRP组大鼠的病灶出现在3h的检测点以后,1h的检测点均未发现有DWI病灶的出现,而脑缺血组大鼠在1h的检测时间点就已经出现了异常信号(见图5),说明LRP很可能通过减轻或抑制缺血所致的脑水肿,从而延长脑梗死的治疗时间窗。我们知道,DWI的运用基础为水分子在组织中的布朗运动,DWI就是以直观的图像来反映细胞内水分子的微观运动,也是目前在活体上研究水分子微观运动的唯一的方法。在缺血发生的数分钟内,脑组织能量代谢受到破坏,Na-K/ATP酶和其他离子泵发生衰竭,从而使细胞内外的离子失去平衡,大量的细胞外水分进入到细胞内,引起细胞内水分增加,细胞外水分减少、细胞外间隙扭曲变形,上述因素均可引起扩散受限[16],弥散速度减慢在DWI上形成高信号,并可被表面扩张系数(apparent diffusion coefficient,ADC)所量化表现为ADC值减低。LRP很可能就是通过影响上述的某个甚至多个环节来实现其在DWI上的改变,比如通过影响与DWI密切相关的水通道蛋白。在一些脑缺血的模型中已检测到水通道蛋白的表达量减低[17~22],水通道蛋白的降低直接导致水分子向胞外运输的减少以及细胞肿胀[23],而缺血所致的弥散受限、ADC值减低正是由胶质细胞肿胀、细胞外间隙缩窄导致[24]。LRP减轻缺血脑水肿并延迟DWI异常信号的出现,很有可能是通过刺激上调水通道蛋白的表达或者抑制水通道蛋白的减少来实现的。当然着这种可能性及机制有待我们进一步探讨和研究。
综上,本项实验证实了LRP不仅能够减轻脑缺血所致的水肿,并能延迟DWI上病灶的出现,延长治疗时间窗,这为探讨RPC机制提供了一个新方向。RPC对脑缺血的保护作用明确,具有极大的临床应用潜质,但是只有深入全面地了解其机制,才能充分发挥它的临床应用价值。相信不久的将来,在RPC原理上建立的新技术能成为脑卒中的克星,造福全人类。
[1]Schott RJ,Rohmann S,Braun ER,et al.Ischemic preconditioning reduces infarct size in swine myocardium[J].Circ Res,1990,66(4):1133-1142.
[2]Kakimoto M,Kawaguch M,Sakamoto T,et al.Evaluation of rapid ischemic preconditioning in a rabbit model of spinal cord ischemia[J].Anesthesiology,2003,99(5):1112 -1117.
[3]Zhao HG,Li WB,Li QJ,et al.Limb ischemic preconditioning attenuates apoptosis of pyramidal neurons in the CA1 hippocampus induced by cerebral ischemia-reperfusion in rats[J].Sheng Li Xue Bao,2004,56(3):407-412.
[4]Dave KR,Saul I,Prado R,et al.Remote organ ischemic preconditioning protect brain from ischemic damage following asphyxial cardiac arrest[J].Neurosci Lett,2006,404(1 ~2):170 -175.
[5]Jin RL,Li WB,Li QJ,et al.The role of extracellular signal-regulated kinases in the neuroprotection of limb ischemic preconditioning[J].Neurosci Res,2006,55(1):65 -73.
[6]Ren C,Gao X,Steinberg GK,et al.Limb remote-preconditioning protects against focal ischemia in rats and contradicts the dogma of therapeutic time windows for preconditioning[J].Neuroscience,2008,151(4):1099-1103.
[7]Malhotra S,Naggar I,Stewart M,et al.Neurogenic pathway mediated remote preconditioning protects the brain from transient focal ischemic injury[J].Brain Res,2011,1386:184 -190.
[8]Baird AE,Lovblad KO,Schlang G,et al.Multiple acute stoke syndrome:marker of embolic disease[J].Neurology,2000,54:674 -678.
[9]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[10]Saxena PK,Balal A,Campbell K,et al.Does remote ischemic preconditioning prevent delayed hippocampal neuronal death following transient global cerebral ischemia in rats[J].Perfusion,2009,24:207-211.
[11]Wei D,Ren C,Chen X,et al.The chronic protective effects of limb remote preconditioning and the underlying mechanisms involved in inflammatory factors in rat stroke[J].PLoS One,2012,7(2):e30892.
[12]Oxman T,Arad M,Klein R,et al.Limb ischemia preconditions the heart against reperfusion tachyarrhythmia[J].J Physiol,1997(273):1707-1712.
[13]Waldow T,Alexiou K,Witt W,et al.Protection against acute porcine lungischemia/reperfusion injury by systemic preconditioning via hind limb ischemia[J].Transpl Int,2005,18:198 -205.
[14]Sun XC,Li WB,Li QJ,t al.Limb ischemic preconditioning induces brain ischemic tolerance via p38 MAPK[J].Brain Res,2006,1084:165-174.
[15]Yannopoulos FS,Makel T,Niemel E,et al.Improved cerebral recovery from hypothermic circulatory arrest after remote ischemic Preconditioning[J].Ann Thorac Surg,2010,90:182 -188.
[16]杨正汉,冯 逢,王霄英.《磁共振成像技术指南》修订版[M],人民军医出版社,2010.273 -273.
[17]Mahmood AM,Takashi O,Patricia D,et al.An α-syntrophin-dependent pool of AQP4 in astroglial end-feet confers bidirectional water flow between blood and brain[J].PNAS,2003,100:2106 -2111.
[18]Sato S,Umenishi F,Inamasu G,et al.Expression of water channel mRNA following cerebral ischemia[J].Acta Neurochir Suppl,2000,76:239 -241.
[19]Ke C,Poon WS,Ng HK,et al.Heterogeneous responses of aquaporin-4 in oedema formation in a replicated severe traumatic brain injury model in rats[J].Neurosci Lett,2001,301(1):21 -24.
[20]Kiening KL,van Landeghem FK,Schreiber S,et al.Decreased hemispheric Aquaporin-4 is linked to evolving brain edema following controlled cortical impact injury in rats[J].Neurosci Lett,2002,324(2):105-108.
[21]Badaut J,Hirt L,Granziera C,et al.Astrocyte-specific expression of aquaporin-9 in mouse brain is increased after transient focal cerebral ischemia[J].Cereb Blood Flow Metab,2001,21(5):477 -482.
[22]Yamamoto N,Yoneda K,Asai K,et al.Alterations in the expression of the AQP family in cultured rat astrocytes during hypoxia and reoxygenation[J].Brain Res,2001,90(1):26 -38.
[23]Meng S,Qiao M,Lin L,et al.Correspondence of AQP4 expression and hypoxic-ischaemic brain oedema monitored by magnetic resonance imaging in the immature and juvenile rat[J].Neurosci,2004,19(8):2261-2269.
[24]Qiao M,Krisztina L,Marc R,et al.Correlation of cerebral hypoxic-ischemic T2changes with tissue alterations in water content and protein extravasation[J].Stroke,2001,32:958 -963.

