活血益智片对血管性痴呆大鼠海马区环氧化酶-2、核因子-κB表达的影响
齐 越, 金 戈, 贾 冬, 刘 畅, 盛亮亮
血管性痴呆(vascular dementia,VD)是发生在脑血管病基础上的以记忆、认知功能缺损为主的智能持续性损害,是居于第2位的最常见痴呆[1],发病原因主要与反复性脑缺血再灌注有关[2],而随后促发的炎性反应则是导致脑缺血性损伤的重要因素。环氧化酶2(COX-2)和核转录因子-κB(NF-κB)通过自由基、氧化应激和神经炎症等多种途径参与脑缺血后炎症反应,引发学习记忆障碍。活血益智片是由石菖蒲、黄芪、当归、山楂、丹参等组成,诸药合用可具有益气活血,宁神益智的功效。本实验采用反复夹闭双侧颈总动脉同时腹腔注射硝普钠制造拟血管性痴呆大鼠模型,观察活血益智片对大鼠学习记忆能力的影响,并对海马COX-2、NF-κB蛋白表达进行检测,旨在探讨活血益智片治疗血管性痴呆的作用机制。
1 材料与方法
1.1 材料 健康成年SPF级雄性Wistar大鼠(北京维通利华实验动物技术有限公司)60只,体重(250 ±30)g;活血益智片,1.15g生药/片,辽宁中医药大学附属医院中医药实验中心提供,批号:091210;甲磺酸二氢麦角毒碱片,1mg×30,西安万隆制药有限责任公司制造,批号:080301;硝普纳粉针剂,每瓶50mg,北京双鹤药业有限公司制造,批号:081202;兔抗大鼠COX-2多克隆抗体,小鼠抗大鼠NF-κB多克隆抗体,山羊抗兔IgG抗体,山羊抗小鼠IgG抗体(Santa Cruz);Morris水迷宫(成都泰盟公司);Y迷宫(自制);Western blot电泳仪(BIO-RAD公司,美国)。
1.2 方法
1.2.1 模型制备 参考文献[3],腹腔注射水合氯醛350mg/kg麻醉后,大鼠仰卧位固定于手术台上,75%酒精消毒颈前皮肤,行颈正中切口,分离双侧颈总动脉(分离迷走神经),腹腔注射硝普钠2.5 mg/kg,立即用无创动脉夹夹闭双侧颈总动脉10min,松开动脉夹,再通10min,再夹闭10min,再通后,依次缝合颈部肌肉和皮肤,涂上青霉素,放回笼中保温饲养,假手术组只分离双侧颈总动脉。所有大鼠在相同条件下饲养,可自由得到食物和水。全部造模过程中用肛表密切观察动物肛温,保持动物肛温在(37.0±0.5)℃左右。术后每只大鼠肌注青霉素0.2万U,连续3d。
1.2.2 动物分组及处理 术后第7天,60只大鼠分为假手术组、模型组、活血益智片低剂量(1.55 g/kg)组、中剂量(3.1g/kg)组、高剂量(6.2g/kg)组、甲磺酸二氢麦角毒碱片(5.4mg/kg)组,每组10只。分组后第2天灌胃给药,给药容积10ml/kg,每日1次,假手术组及模型组给予同体积蒸馏水,连续给药 28d。
1.2.3 行为学观察-Y迷宫 实验装置由3个夹角为 120°的木制支臂组成,每臂长 40cm,高12cm,上宽10cm,下宽5cm。实验时将大鼠放入1个臂的末端,让其自由出入3个臂,记录8min内每只大鼠进入3个臂的总次数(N)及顺序,以连续进入3个不同的臂为1次正确交替反应,记录正确交替反应次数。自发交替反应率(%)=[正确交替反应次数/(N-2)]×100%。比较各组大鼠的自发交替反应率,以评价其空间工作记忆能力。
1.2.4 行为学观察-Morriss水迷宫 水迷宫水温23℃ ~25℃,水中加入牛奶,在固定象限设有安全台,液面高于安全台2cm,各组大鼠进行定位航行实验,连续5d,测定其逃避潜伏时间,第5天结束后,除去安全台,进行空间探索实验,测定其在固定象限的游泳时间及穿越安全台的次数。各组大鼠进行组间比较,评价其学习记忆能力。
1.2.5 Western blot印迹法检测海马 COX-2、NF-κB表达 冰上快速分离海马组织,按10ml/g的比例加入全细胞裂解液,组织经匀浆、超声破碎后,BCA法进行蛋白定量,12%SDS-PAGE凝胶电泳,转PVDF膜。杂交步骤如下:5%脱脂牛奶封闭PVDF膜2h,4℃下与 COX-2、NF-κB 一抗(1∶500)杂交反应过夜后,PBS漂洗PVDF膜3次,每次10min。再将PVDF膜分别与辣根过氧化物酶标记的山羊抗小鼠二抗(1∶3000)、山羊抗兔二抗(1∶5000)杂交反应2h。最后用 Tris-Nacl漂洗 PVDF膜3次,每次10min,加入ECL试剂反应5min,保鲜膜包裹,暗室进行X线胶片曝光、显影和定影。然后同一张PVDF膜再与 β-actin(1∶1000)进行杂交反应。Western blot印迹条带经Gel-oc凝胶成像分析系统扫描处理。
2 结果
2.1 大鼠行为学观察结果
2.1.1 Y迷宫 与假手术组相比,模型组的自发交替反应率降低(P<0.05);与模型组相比,活血益智片中、高剂量组可明显增加其自发交替反应率(P<0.05);提示活血益智片具有改善血管性痴呆大鼠空间工作记忆能力的作用(见图1)。
2.1.2 Morris水迷宫 各组大鼠术前筛查的平均逃避潜伏期无统计学差异(P>0.05),数据未显示。术后进行定位航行的成绩比较:与模型组相比,其它组大鼠学习和记忆逃避潜伏期均明显缩短(P<0.05;P<0.01)。空间探索实验结果比较:与模型组相比,其它组大鼠的固定象限游泳时间及穿越平台次数明显增加(P<0.05)。结果表明,与假手术组比较,模型组大鼠行为模式发生了改变,药物治疗组大鼠行为模式接近假手术组(见图2、3、4)。
2.2 COX-2、NF-κB检测结果与分析 Western blot印迹法结果显示,与假手术组相比,模型鼠脑海马组织内COX-2、NF-κB水平显著增高,经过活血益智片治疗后,COX-2、NF-κB水平显著降低(见图5)。
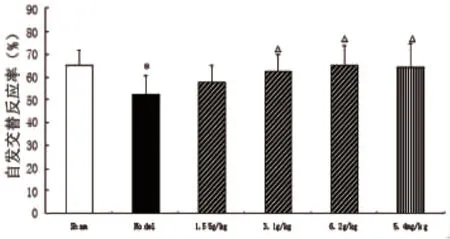
图1 活血益智片对血管性痴呆大鼠自发交替反应率的影响

图2 活血益智片对血管性痴呆大鼠逃避潜伏期的影响
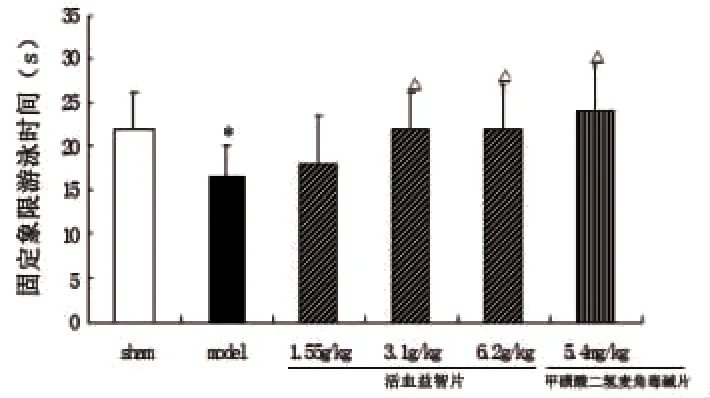
图3 活血益智片对血管性痴呆大鼠固定象限游泳时间的影响
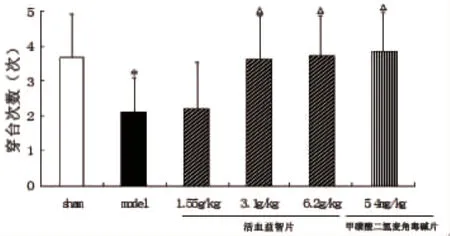
图4 活血益智片对血管性痴呆大鼠穿台次数的影响
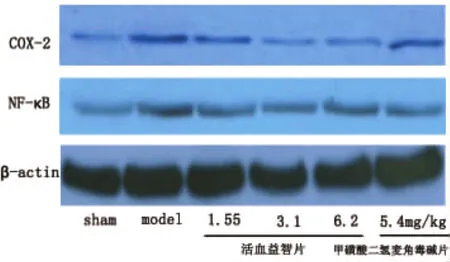
图5 Western blot印迹法检测海马区COX-2及NF-κB表达
3 讨论
慢性脑缺血再灌注与VD的病程进展有关[4],此种动物模型可以较好地模拟人类VD的脑血流量降低及认知功能障碍[5,6]。VD的主要临床表现为智能的降低,而学习记忆则是智能的最基本要素,且较易于测定分析,故往往把学习记忆的改善作为智能提高的一个主要指标。本实验采用反复夹闭双侧颈总动脉同时腹腔注射硝普钠方法建立慢性脑低灌注状态,Y迷宫和Morris水迷宫实验进行行为学检查,表现为模型组大鼠明显的记忆和学习障碍,认知功能显著下降,表明慢性低灌注状态对学习记忆功能是有影响的。本研究通过对VD大鼠的行为学观察,发现活血益智片可改善VD大鼠的记忆、学习和行为功能,表现为提高大鼠的自发交替反应率、缩短逃避潜伏期、增加固定象限游泳时间及穿越平台次数,具有脑保护作用。
海马是哺乳类动物学习和记忆的重要结构区。慢性脑缺血主要损伤海马,海马区锥体细胞可出现明显的变性、死亡、甚至丢失,可能是学习记忆障碍的主要原因,因此我们选用海马为研究对象。慢性脑缺血时,脑内的免疫细胞可释放大量的毒性介质,例如促炎症因子、活性氧、NO及谷氨酸盐[7]。这些物质将损害神经细胞,破坏血脑屏障(BBB),反过来,破坏的血脑屏障会进一步加重缺血脑区的损害[8]。此外,外周白细胞的聚集也可导致微循环障碍,进一步加重缺血脑区的损害[9],事实上,大量实验研究证实抑制炎症的级联反应可对缺血脑区进行保护[10]。核转录因子则是缺血后功能障碍炎症反应的主要调节物质[11]。
NF-κB是核转录因子,可参与多种促炎症因子的转录,在急性炎症反应中起重要的作用。关于炎症反应中NF-κB激活的研究多数在体外细胞培养实验中进行[12]。最近的动物实验研究也提示NF-κB参与了脑缺血后的炎症反应及后续的神经炎反应[13]。在人类皮层梗死[14]的病理过程中,可见 NF-κB的活性增强,且NF-κB活性的增加与COX-2基因表达增加相关联[15]。大鼠局灶性缺血模型中[16],NF-κB的活性在缺血后第4天和第7天明显增加。这些数据都支持NF-κB激活与人类的大脑炎症失调有关。本实验发现:假手术组未见明显NF-κB表达,而模型组 NF-κB表达显著增高,这与前人研究结果类似。活血益智片可降低NF-κB的表达,它可能通过:(1)蛋白与蛋白之间的相互作用,捕获 NF-κB;(2)阻碍 NF-κB 的核转录;(3)抑制NF-κB 的转录活性;(4)增强 IκB(NF-κB 的特异性抑制剂)的表达。
在人类和啮齿类动物的大脑中,COX-2主要存在于神经元内,为一种诱导酶,于1989年被Simmons等发现,静息状态下正常组织中无表达或弱表达,缺血刺激会使之表达上调[17]。大脑的局部及全脑缺血后,COX-2选择性抑制剂(NS-398)可减少神经元内COX-2的表达[18]及其脑损伤后所产生的相关炎症因子的表达。大量的脑缺血后的研究表明,神经元内的COX-2水平可通过氧自由基的产生促使神经元死亡,同时也伴随着COX-2 mRNA的上调。本实验结果表明,假手术组COX-2表达较弱,而模型组的 COX-2表达显著升高,活血益智片可降低COX-2的表达。人启动子区域含有2个NF-κB结合位点,该位点序列发生定向突变后,几乎完全封闭TNF-α 对 COX-2 基因的诱导[19],可见 NF-κB 位点为COX-2转录激活所必需。本实验的结果表明,模型组的NF-κB及 COX-2表达均增加,显示 NF-κB与COX-2表达相互促进,这与Lim等[20]的结果相符合。
综上所述,作者认为大鼠慢性脑缺血再灌注可刺激海马区的锥体细胞出现变性、死亡、甚至丢失,随后促使脑内免疫细胞释放炎症因子,活化NF-κB进入细胞核内,与COX-2启动子区域的NF-κB结合位点结合,促进COX-2基因的转录表达,活血益智片通过抑制NF-κB及COX-2表达,进而改善VD大鼠的认知能力障碍,产生脑保护作用。
[1]文 慧,贾 冬,齐 越,等.活血益智片对血管性痴呆小鼠记忆障碍及神经元凋亡蛋白表达的影响[J].中国临床药理学杂志,2010,2:129 -132.
[2]Corey-Bloom J,ThaiLJ,Galasko D,et al.Diagnosis and evaluation of demention[J].Neurology,1995,45:211 -218.
[3]王 蕊,杨秦飞,唐一鹏,等.大鼠拟“血管性痴呆”模型的改进[J].中国病理生理杂志,2000,16(10):914 -916.
[4]Dubois MF,Hebert R.The incidence of vascular dementia in Canada:a comparison with Europe and East Asia[J].Neuroepidemiology,2001,20:179 -187.
[5]Tomimoto H,Ihara,M,Wakita H,et al.Chronic cerebral hypoperfusion induces white matter lesions and loss of oligodendroglia with DNA fragmentation in the rat[J].Acta Neuropathology,2003,106:527 -534.
[6]Otori T,Katsumata T,Muramatsu H,et al.Long-term measurement of cerebral blood flow and metabolism in a rat chronic hypoperfusion model[J].Clin Exp Pharmacol Physiol,2003,30:266 - 272.
[7]Barone FC,Feuerstein GZ.Inflammatory mediators and stroke:new opportunities for novel therapeutics[J].J Cereb Blood Flow Metab,1999,19:819 -834.
[8]Liu R,Wen Y,Perez E,et al.17beta-Estradiol attenuates blood-brain barrier disruption induced by cerebral ischemia-reperfusion injury in female rats[J].Brain Res,2005,1060:55 -61.
[9]Pan J,Konstas AA,Bateman B,et al.Reperfusion injury following cerebral ischemia:pathophysiology,MR imaging,and potential therapies[J].Neuroradiology,2007,49:93 -102.
[10]Mehta SL,Manhas N,Raghubir R.Molecular targets in cerebral ischemia for developing novel therapeutics[J].Brain Res Rev,2007,54:34-66.
[11]Nurmi A,Lindsberg PJ,Koistinaho M,et al.Nuclear factor-kappaB contributesto infarction after permanent focal ischemia[J].Stroke,2004,35:987 -991.
[12]Howard EF,Chen Q,Cheng C,et al.NF-kappa B is activated and ICAM-1 gene expression is upregulated during reoxygenation of human brain endothelial cells[J].Neurosci Lett,1998,248:199 -203.
[13]Bethea JR,Castro M,Keane RW,et al.Traumatic spinal cord injury inducesnuclear factor-κB activation [J].J Neurosci,1998,18:3251-3260.
[14]Terai K,Matsuo A,McGeer EG,et al.Enhancement of immunoreactivity for NF-kappa B in human cerebral infarctions[J].Brain Res,1996,739:343 -349.
[15]Lukiw WJ,Bazan NG.Strong nuclear factor kappaB-DNA binding parallelscyclooxygenase-2 gene transcription in aging and in sporadic Alzheimer's diseasesuperior temporal lobe neocortex [J].J Neurosci Res,1998,53:583 -92.
[16]Li C,Ha T,Liu L,et al.Adenosine prevents activation of transcription factor NF-kappaB and enhances activator protein-1 binding activity in ischemic rat heart[J].Surgery,2000,127(2):161 -169.
[17]Tocco G,Freire – Moar J,Schreiber SS,et al.Maturational regulation and regional induction of cyclooxygenase-2 in rat brain:implications for Alzheimer's disease[J].Exp Neurol,1997,144:339 - 349.
[18]Nakayama M,Uchimura K,Zhu RL,et al.Cyclooxygenase-2 inhibition preventsdelayed death of CA1hippocampal neurons following global ischemia[J].Proc Natl Acad Sci USA,1998,95:10954 -10959.
[19]Reddy ST,Wadleigh DJ,Herschman HR,et al.Transcriptional Regulation of the cyclooxygenase-2 gene in activated mast cells[J].J Biol Chem,2000,275(5):3107 -3113.
[20]Lim JW,Kim H,Kim KH.Nuclear factor-kappaB regulates cyclo-oxygenase-2 expres sion and cell proliferation in human gastric cancer cells[J].Lab Invest,2001,81(3):349 -360.

