GRP78、CHOP、caspase-3和 caspase-9蛋白在缺血预处理大鼠脑组织中的表达及意义
闵鹤鸣, 鲁璐清, 王文娟, 武晓宁, 闵连秋
缺血/再灌注(ischemia/reperfusion)损伤是一种重要的由于供血障碍引起的应激性疾病[1],血供中断后一定时间内恢复,可引起缺血组织发生较血供恢复前更严重的损伤。有研究证明脑缺血/再灌注后存在内质网应激(endoplasmic reticulum stress,ERS),且与神经元凋亡有关[2,3]。caspase 家族是细胞凋亡过程中最重要的蛋白酶,其中caspase-9为凋亡启动酶,caspase-3为凋亡效应酶。2-脱氧葡萄糖(2-deoxyglucose,2-DG)是一种内质网的保护性蛋白GRP78的诱导剂,可以诱导ERS的发生。本研究从ERS的角度探讨脑缺血预处理在缺血/再灌注大鼠脑损伤中的保护作用及其机制。
1 材料与方法
1.1 动物与分组 健康雄性成年Sprague-Dawley(SD)大鼠48只,体重280~320g,由辽宁医学院实验动物中心提供,许可证号:SCXK(辽)2003-0007。随机分为脑缺血预处理组:缺血预处理30min,再灌注3d,再次缺血2h,再灌注24h处死大鼠;2-DG预处理组:2-DG溶于双蒸水,工作浓度为50mg/ml,按照100mg·kg-1·d-1的剂量给予大鼠腹腔注射,每天一次,连续7d后进行假手术处理,再灌注3d,缺血2h,再灌注24h处死大鼠;脑缺血/再灌注组:假手术处理,再灌注3d,缺血2h,再灌注24h处死大鼠;对照组:第一次假手术后再灌注3d,第2次假手术后再灌注24h处死大鼠。每组12只。
模型制备:参照 Longa[4]和 Nagasawa[5]报道的方法加以改进制备大鼠大脑中动脉(MCA)局灶性脑缺血再灌注模型。大鼠用10%水合氯醛350mg·kg-1腹腔注射麻醉,颈部正中切口,分离并结扎左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)和ICA的颅外分支-翼腭动脉。将ICA远心端用动脉夹夹闭,距CCA分叉处近心端0.5cm处将CCA剪一小口,插入碳素鱼线,松开动脉夹,向ICA插入鱼线(20±2)mm,直至稍感阻力,栓线进入ICA后,穿过MCA起始端至大脑前动脉近端,阻断MCA的所有血流来源,扎紧备线,外留10mm线头。30min后轻轻提拉所留线头,拔出5mm,使血流再通,形成再灌注,将栓线尾部埋在皮下,缝合切口,再灌注3d后用相同方法进行缺血及再灌注。模型成功的标准为大鼠清醒后出现左侧Horner征及对侧以前肢为主的瘫痪,神经行为学评分在1~3分[4]。假手术为仅暴露CCA、ECA及ICA,栓线插入CCA及ICA但不阻断MCA,术前禁食12h,术中及术后维持体温在37℃左右,术后单笼饲养。
1.2 药品和试剂 GRP78、CHOP和 caspase-9多克隆一抗购于北京博奥森生物技术有限公司;caspase-3多克隆一抗购于北京中杉金桥生物技术有限公司;2-DG购于天津致远化学试剂有限公司;免疫组化试剂盒和显色试剂盒由北京博奥森生物技术有限公司和北京中杉金桥生物技术有限公司提供;TUNEL细胞凋亡试剂盒由南京凯基生物发展有限公司提供。
1.3 检测指标
1.3.1 神经行为学评分 采用 Z ea Longa[4]6级5分制评分标准进行神经行为学评分。
1.3.2 脑梗死体积测定 进行神经行为学评分后将大鼠断头处死,迅速取出左脑,去除嗅球、小脑和低位脑干,于-20℃冰箱中速冻2min,将大脑作连续2mm冠状切片,共6片,然后将脑片放入2%TTC磷酸盐缓冲液中37℃恒温孵育1h,正常脑组织染为红色,梗死灶呈白色。数码相机拍照后,应用病理图像分析仪测量脑梗死面积。根据公式V=(A1+---+An)t/2算出梗死体积,其中t为切片厚度,A为梗死面积[6]。
1.3.3 脑含水量的测定 采用干、湿重法,动物在规定时相点处死,断头取脑,分别取两侧大脑半球脑组织标本,先用电子天平称取湿重,然后将标本置于95℃ ~100℃红外线干燥箱内烘干24~48h至恒重,称取干重。脑含水量用湿重的百分比表示,即脑含水量(%)=(湿重-干重)/湿重×100%。
1.3.4 免疫组化检测缺血区脑组织 G RP78、CHOP、caspase-3和caspase-9蛋白表达 采用链霉菌抗生物素蛋白-过氧化物酶连结(SP)法。石蜡切片常规脱蜡至水,3%双氧水室温处理10min,微波加热抗原修复,自然冷却至50℃,去除过氧化物酶,去除背景染色,加 GRP78、CHOP、caspase-3 和caspase-9一抗,4℃过夜;加生物素化地高辛抗体,置于恒温箱中 3 0min,加 S ABC,37℃,40min,DAB 显色,显微镜下控制时间;苏木素复染,中性树胶封片,镜下观察。
2 结果
2.1 各组大鼠神经行为学评分的变化 与对照组相比,其余3组大鼠的神经行为学评分差异非常显著(P<0.01);与脑缺血/再灌注组比较,脑缺血预处理组和2-DG预处理组的神经行为学评分明显降低,差异具有显著性(P<0.01);而脑缺血预处理组和2-DG预处理组之间的神经行为学评分无显著性差异(P>0.05)(见表1)。
2.2 各组大鼠脑梗死体积的变化 与对照组相比,其余3组大鼠脑梗死体积差异非常显著(P<0.01);与脑缺血/再灌注组比较,脑缺血预处理组和2-DG预处理组的脑梗死体积明显缩小,差异具有显著性(P<0.01);而脑缺血预处理组和2-DG预处理组之间的脑梗死体积变化无显著性差异(P>0.05)(见表1)。
2.3 各组大鼠脑含水量的变化 与对照组相比,其余3组大鼠脑含水量差异非常显著(P<0.01);与脑缺血/再灌注组比较,脑缺血预处理组和2-DG预处理组的脑含水量明显降低,差异具有显著性(P<0.01);而脑缺血预处理组和2-DG预处理组之间的脑含水量无显著性差异(P>0.05)(见表1)。
2.4 免疫组化检测大鼠脑组织GRP78、CHOP、caspase-3和caspase-9蛋白的表达 光学显微镜下观察,GRP78阳性染色细胞呈棕黄色,染色位于胞浆,细胞形态大部分正常,形态相对饱满,呈圆形或椭圆形。对照组的GRP78阳性染色细胞表达不明显;与对照组相比,其余3组的GRP78阳性染色细胞表达明显增加,差异非常显著(P<0.01);与脑缺血/再灌注组比较,脑缺血预处理组和2-DG预处理组的GRP78阳性染色细胞表达明显增加,差异非常显著(P<0.01);而脑缺血预处理组和2-DG预处理组之间的GRP78阳性染色细胞表达无显著性差异(P>0.05)。CHOP阳性染色细胞胞浆呈现棕黄色淡染,细胞核也呈现棕色,多数细胞核发生形态学改变,胞核皱缩,呈梭形或条索状;caspase-3阳性染色细胞为胞核染色呈棕黄色,可见细胞皱缩、变形,体积变小;caspase-9阳性染色细胞呈棕黄色,胞浆胞核均有表达,但以胞核表达为主,部分细胞可见细胞坏死的形态改变及染色质浓缩。对照组的 CHOP、caspase-3和caspase-9阳性染色细胞仅有微量表达;与对照组相比,其余 3组的 CHOP、caspase-3和caspase-9阳性染色细胞表达明显增加,差异非常显著(P<0.01);与脑缺血/再灌注组比较,脑缺血预处理组和 2-DG预处理组的 CHOP、caspase-3和caspase-9阳性染色细胞表达减少,差异非常显著(P<0.01);而脑缺血预处理组和2-DG预处理组之间的CHOP、caspase-3和caspase-9阳性染色细胞表达无显著性差异(P>0.05)(见表2)。
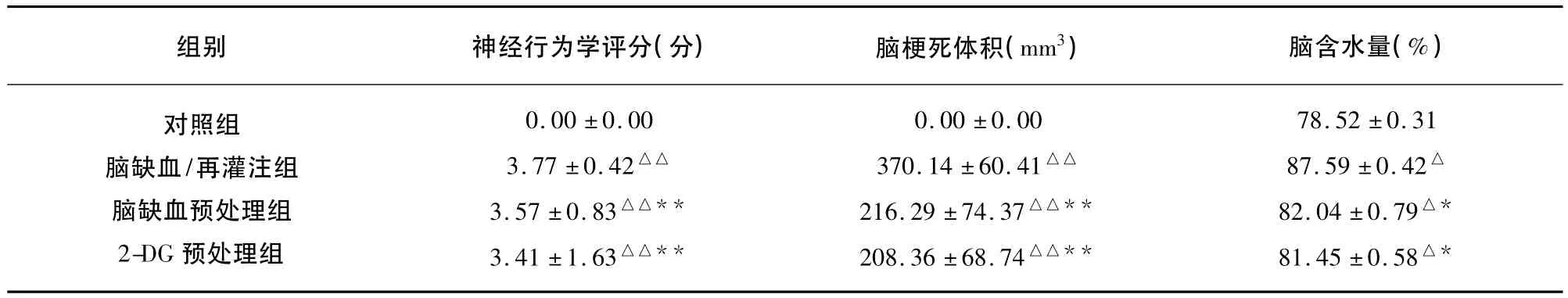
表1 各组大鼠神经行为学评分、脑梗死体积和脑含水量的变化(χ ± s ,n=6)
表2 各组大鼠GRP78、CHOP、caspase-3和caspase-9蛋白的表达(±s,n=6)
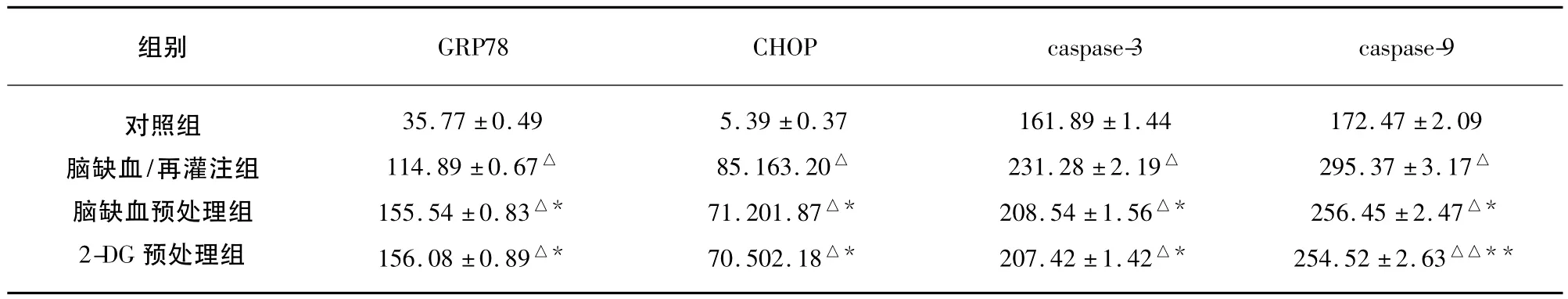
表2 各组大鼠GRP78、CHOP、caspase-3和caspase-9蛋白的表达(±s,n=6)
与对照组相比△P<0.01;与脑缺血再灌注组相比*P<0.01
组别GRP78 CHOP caspase-3 caspase-9对照组脑缺血/再灌注组脑缺血预处理组2-DG预处理组35.77 ±0.49 114.89 ±0.67△155.54 ±0.83△*156.08 ±0.89△*5.39 ±0.37 85.163.20△71.201.87△*70.502.18△*161.89 ±1.44 231.28 ±2.19△208.54 ±1.56△*207.42 ±1.42△*172.47 ±2.09 295.37 ±3.17△256.45 ±2.47△*254.52 ±2.63△△**
3 讨论
内质网是细胞内重要的亚细胞结构,为蛋白质合成、翻译后修饰、折叠、寡聚化而形成正确构象及分泌的场所,还参与脂质代谢和类固醇激素的合成、钙的储存等。正常情况下,内质网内环境的稳定是实现其功能的基本条件,因此内质网具有极强的内稳态体系。尽管如此,仍有很多因素可导致内质网功能的内稳态失衡,引发ERS。缺血/再灌注时缺氧、酸中毒、ATP耗竭、钙超载及大量自由基生成等均可作为诱导ERS的刺激因素,ERS在缺血/再灌注损伤的发生发展中具有重要意义[7]。
GRP78和CHOP是ERS的2个经典标志物[8]。GRP78在ERS时表达上调,是ERS的标志性蛋白和保护性因子,可促进内质网中未折叠蛋白正确折叠、修饰,具有在应激状态下保护内质网功能的作用[8~10]。GRP78 还具有维持细胞内钙平衡的作用[11]。CHOP是内质网相关促凋亡蛋白,在正常细胞中表达很低,但是在ERS时下被大量诱导表达,激活细胞凋亡途径[12,13]。
脑缺血预处理是指对脑预先进行短暂的、一次或多次亚致死性缺血预处理,可以减轻24h后发生的致死性脑缺血再灌注所造成的损伤,产生神经保护作用。本研究发现,30min局灶性脑缺血预处理再灌注后,可以明显降低大鼠缺血2h后再灌注24h的神经行为学评分、缩小脑梗死灶体积和降低脑组织含水量;与脑缺血/再灌注组相比,预处理缺血组GRP78的蛋白表达明显增加,CHOP的蛋白表达明显减少,与2-DG预处理组相似,推测脑缺血预处理可能触发了体内的ERS过程,对随后而发生缺血/再灌注所造成损伤的具有神经保护作用。
caspase家族是细胞凋亡过程中最重要的蛋白酶,细胞凋亡的最后实施是通过caspase的激活而实现的[14]。ERS 时 caspase 被特异性激活[15],其激活过程表现为级联反应:即先激活凋亡始动子caspase-9,再激活凋亡效应子caspase-3,作用于特异性的底物引起细胞的凋亡。本研究同时发现,与对照组相比,脑缺血再灌注组、脑缺血预处理组和2-DG预处理组的caspase-3和caspase-9蛋白的表达量明显增加,表明脑缺血/再灌注损伤能引起 caspase-3和caspase-9蛋白的活化,启动的细胞凋亡途径以caspase-3和caspase-9表达上调为主,提示caspase-3和caspase-9的激活在脑缺血/再灌注损伤中发挥重要作用,并可能与细胞凋亡有关;而脑预处理缺血组和2-DG预处理组caspase-3和caspase-9的表达量明显少于脑缺血/再灌注组,进一步提示脑预处理缺血通过抑制caspase-3和caspase-9的激活,减轻了神经元的凋亡,对大鼠脑缺血/再灌注损伤具有保护作用。
[1]吴小玮,何娅妮.内质网应激与肾脏疾病[J].肾脏病与透析肾移植杂志,2007,16(4):364 -368.
[2]Shibata M,Hattori H,Sasaki T,et al.Activation of caspase-12 by endoplasmic reticulum stress induced by transient middle cerebral artery occlusion in mice[J].Neuroscience,2003,118(2):491 -499.
[3]Paschen W,Aufenberg C,Hotop S,et al.Transient cerebral ischemia activates Processing of xbp1 messenger RNA indicative of endoplasmic reticulum stress[J].Cereb Blood Flow Metab,2003,23(4):449 -461.
[4]Longa EZ,Weinstein PR,Carlotn S,et al.Reversible middle cerebral artery oclusion without craniotomy in rats[J].Stroke,1989,20(1):84-91.
[5]Nagasawa H,Kogure K.Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion[J].Stroke,1989,20(8):1037 - 1043.
[6]Kitagawa H,Hayashi T,Mitsummoto Y.Reduction of ischemic brain injury by topical application of glial cell line-derived neurotrophic factor after permanent middle cerebral artery occlusion in rats[J].Stroke,1998,29(7):1417 -1422.
[7]祝筱梅,刘秀华.内质网应激与缺血再灌注损伤及其防护[J].国际病理科学与临床杂志,2006,26(2):177-180.
[8]Yoshida H,Haze K,Yanagi H,et al.Identification of the cis-acting endoplasmic reticulum stress response element responsible for transcriptional induction of mammalian glucose-regulated proteins involvement of basic leucine zipper transcription factors[J].J Biol Chem,1998,273(50):33-41.
[9]Lee E,Nichols P,Spicer D,et al.GRP78 as a novel predictor of responsiveness to chemo therapy in breast cancer[J].Cancer Res,2006,66(16):7849 -7853.
[10]Oida Y,Izuta H,Oyagi A,et al.Induction of BiP,an ER-resident protein,prevents the neuronal death induced by transient forebrain ischemia in gerbil[J].Brain Res,2008,1208:217 - 224.
[11]Verkhratsky A.Endoplasmic reticulum calcium signaling in nerve cells[J].Biol Res,2004,37(4):693 -699.
[12]Zinszner H.CHOP is implicated in programmed cell death in response to impaired function of the endoplasmic reticulum[J].Genes Dev,1998,12(7):982 -995.
[13]Mccullough KD,Martindale JL,Klotz LO,et al.GADD153 sensitizes cells to endoplasmic reticulum stress by down-regulating Bcl-2 and perturbing the cellular redoxstate[J].Mol Cell Biol,2001,21(4):1249-1259.
[14]Bratton SB,MacFarlane M,Cain K,et al.Protein complexes activate distinct caspase cascades in death receptor and stress-induced apoptosis[J].Exp Cell Res,2000,256(1):27 - 33.
[15]Nakagawa T,Zhu H,Morishima N,et al.caspase-12 mediates endoplasmic reticulum specific apoptosis and cytotoxicity by amyloid-beta[J].Nature,2000,403:98 - 103.

