一株产蓝色素放线菌的筛选及发酵研究
全桂静, 邢继双
(沈阳化工大学环境与生物工程学院,辽宁沈阳110142)
食用色素是指能使食品着色或改善食品色调和色泽的食品添加剂[1].它在食品中的含量非常少,但对食品质量及品质的影响非常大,是食品工业中不可缺少的添加剂之一.天然食用色素色泽自然、种类繁多、安全性高,食用天然色素已被广泛应用于饮料、糖果等食品的着色[2].研究表明,一些食用天然色素对人体的多种疾病还具有非常突出的治疗、预防等药理作用和保健功能,也可用于医疗保健品、化妆品的着色,能更好地模仿天然物的颜色,着色时的色调比较自然[3].利用微生物发酵法生产功能性食用天然色素,因其产率高、不受原料产地制约等优势,逐渐成为当前研究热点.目前我国准许使用的色素中,蓝色素主要是从桅子、螺旋藻、念珠藻、紫甘蓝等原料中提取,并对其性质、稳定性进行了研究,但发酵生产蓝色素却不多见[4].因此,开发和选育出能大量生产天然蓝色素的微生物具有一定意义.本文从土壤中筛选出1株蓝色素高产菌株产量稳定,以期可以丰富食用蓝色素的物种.
1 材料与方法
1.1 材料
1.1.1 样品来源
沈阳化工大学院内土壤.
1.1.2 培养基配方
(1)初筛培养基(g/L)[4-5]
可溶性淀粉 20,KNO31.5,K2HPO40.5,NaCl 0.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,K2Cr2O70.1,琼脂20,pH=7.5,121℃高压蒸汽灭菌30 min.
(2)发酵培养基(g/L)
可溶性淀粉 20,KNO31,K2HPO40.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,NaCl 0.5,pH=7.5,121℃高压蒸汽灭菌30 min.
1.2 实验方法
1.2.1 蓝色素产生菌株的筛选
(1)初筛:采用10倍稀释法对土样进行充分稀释.将初筛培养基倒入无菌培养皿,凝固制成平板.取1 mL稀释液涂布于平板上,30℃恒温培养96 h.
(2)复筛[5]:初筛的菌株转接斜面后,在恒温培养箱内30℃培养5 d,制成108/mL单孢子悬液.取1 mL悬液接种于装有100 mL发酵培养液的250 mL的三角瓶中,30℃、160 r/min条件下培养96 h,测定色素产量.
1.2.2 蓝色素产量的测定方法[5-6]
发酵液采用sigma 2-16P台式高速离心机5 000 r/min离心30 min,取上清液.以空白培养基为对照,利用722型分光光度计在590 nm波长处测A值[5],以表示发酵液中色素的产量.
1.2.3 蓝色素生产条件的研究[5-7]
(1)营养条件的研究:利用常用的糖类及无机、有机含氮化合物分别作为碳源和氮源,250 mL三角瓶中装100 mL液体培养基,按2%比例接种,在30℃,160 r/min的条件下恒温振荡培养96 h,确定适宜的营养条件.
(2)发酵条件的优化:在确定营养条件的基础上,考察温度、发酵时间等因素对色素生产的影响,以优化发酵条件.
(3)正交试验的设计:根据单因素的试验结果,设计4因素3水平的正交试验,结果见表1.
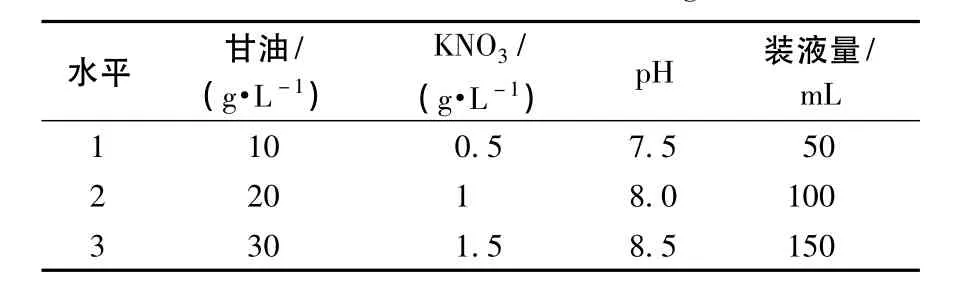
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test
(4)正交试验的验证试验:按以上正交试验结果的最优配比,进行发酵重复试验.
1.2.4 蓝色素的提取与色价测定
(1)色素的提取:向90 mL色素粗溶液中滴加2 mol/L的NaOH溶液10 mL,在50℃恒温水浴锅中作用30 min使色素充分沉淀,采用sigma 2-16P台式高速离心机7 800 r/min离心30 min后,干燥即得色素粗提物.
(2)粗提物色价的测定:按1∶100的比例用pH9.0Tris-HCl缓冲溶液溶解色素粗提物,使色素充分溶解[8-9],用722型可见分光光度计在波长590 nm处测吸光度.按公式
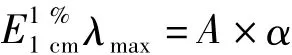
计算色价[10].式中,A为实测试样的吸光度;α为稀释倍数.
2 结果与讨论
2.1 蓝色素生产菌株的筛选
2.1.1 初筛
土样经稀释并在初筛培养基平板上培养后,共筛得7株产水溶性蓝色素的放线菌,见图1.
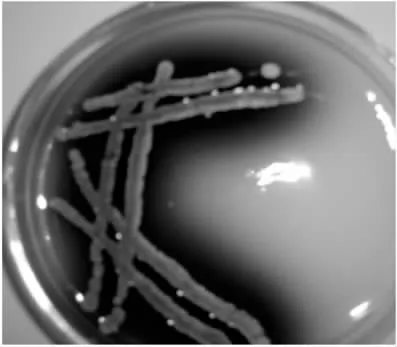
图1 蓝色素产生菌株的菌苔Fig.1 The lawn of blue pigment producing strain
2.1.2 复筛
对初筛得到的7株菌进行液体发酵,发酵液离心后测A590,结果见表2.由表2可知5号菌株发酵液的A590值较高,命名为Cya-5.
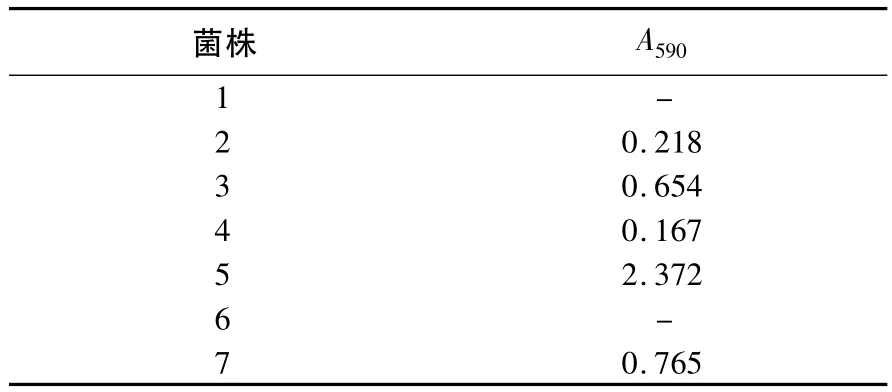
表2 初筛菌株的蓝色素产量Table 2 The blue pigment production of the screening strains
2.2 蓝色素生产条件的研究结果
2.2.1 碳源对蓝色素生产的影响
以20 g/L的蔗糖、甘油、葡萄糖、柠檬酸三钠、可溶性淀粉等作为碳源,1 g/L的KNO3为氮源,研究蓝色素的发酵情况,结果见图2.
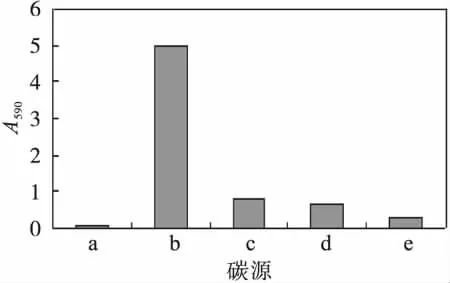
图2 碳源对蓝色素生产的影响Fig.2 The effect of carbon source on the pigment fermentation
由图2结果可知,碳源对蓝色素发酵生产的影响较大,其中以甘油为碳源时,A590最大为5.01,可溶性淀粉次之.因此确定甘油为蓝色素发酵用碳源.
2.2.2 氮源对蓝色素生产的影响
确定碳源为甘油后,以1 g/L蛋白胨,硫酸铵,硝酸钾作为氮源,以及不加氮源,研究蓝色素产量,结果如图3所示.由图3可知,以KNO3为氮源时,A590最大为5.32,可见KNO3有利于蓝色素的生产.
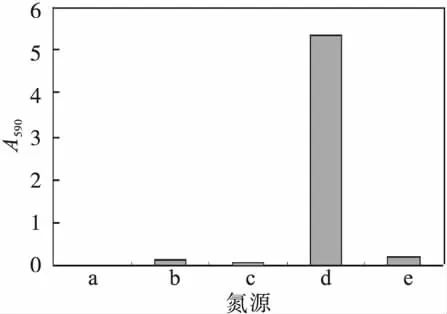
图3 氮源对蓝色素生产的影响Fig.3 The effect of nitrogen source on the pigment fermentation
2.2.3 发酵液初始pH值对蓝色素生产的影响
配制培养基时,调节不同的pH值,研究初始pH对发酵的影响,结果见图4.结果显示,pH对蓝色素生产的影响较大,当pH在8.0左右时,A590最大为5.98.这与放线菌的最适生长pH范围7.5~8.5基本一致.
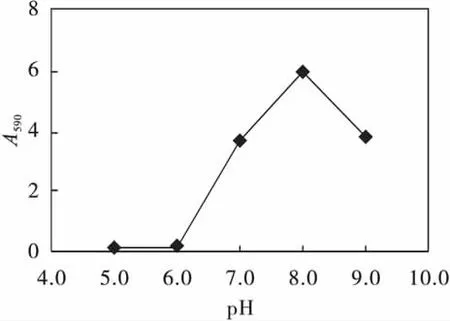
图4 初始pH对蓝色素生产的影响Fig.4 The effect of initial pH on the pigment fermentation
2.2.4 发酵温度对蓝色素生产的影响
在最适碳源、氮源、pH值的条件下,考察发酵温度对蓝色素产量的影响,结果如图5所示.由图5可以看出:当发酵温度为30~35℃时,色素产量和胞外分泌率都是比较好的,但尤以30℃为最佳.当温度大于40℃时,该放线菌基本不产蓝色素.
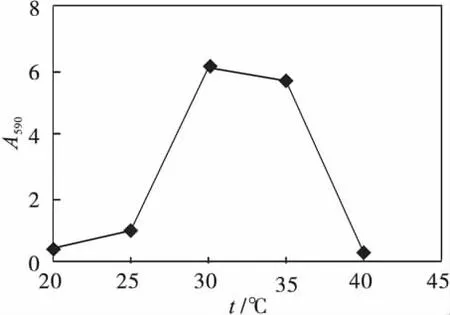
图5 发酵温度对蓝色素生产的影响Fig.5 The effect of temperature on the pigment fermentation
2.2.5 发酵时间对蓝色素生产的影响
在以甘油为碳源,硝酸钾为氮源,pH=8.0,30℃发酵,测量不同发酵时间蓝色素的产量,结果如图6所示.由图6结果可知,发酵96 h时,A590达到最大值为5.96,因此96 h为蓝色素的最佳收获时间.
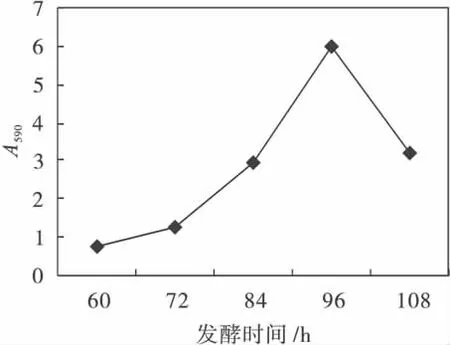
图6 发酵时间对蓝色素生产的影响Fig.6 The effect of fermentation time on the pigment fermentation
2.2.6 正交试验
按4因素3水平的正交实验表进行发酵实验,发酵液预处理后,经过10倍稀释后测定A590,结果及分析见表3.结果显示最佳组合为A2B2C3D2,即最优培养基配方为:甘油20 g/L,KNO31 g/L,pH值为8.5,装液量为100 mL/250 mL三角瓶,总A值可达12.02.数据分析显示,在研究的4个因素中,对发酵影响最大的因素是氮源浓度,其次为碳源浓度.
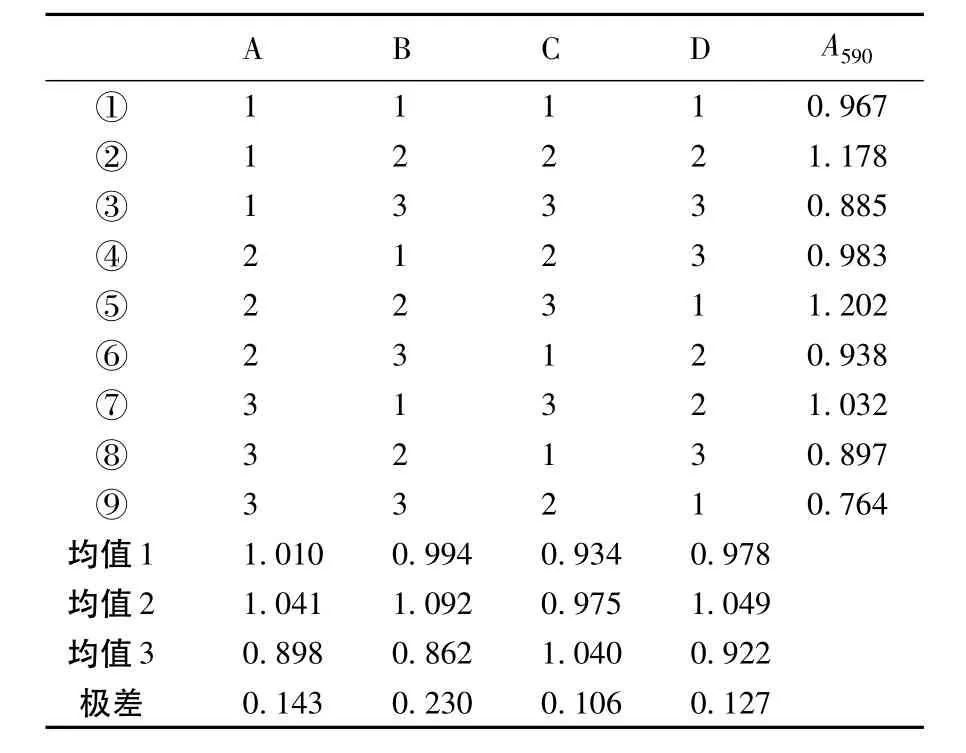
表3 正交实验结果表Table 3 Results of orthogonal experiment
按上述正交实验最优配比,进行验证实验,发酵液经预处理后,稀释10倍后测定A590,发酵中蓝色素产量基本稳定,总A590在12.24左右.
2.3 蓝色素粗提物的性状及色价
用2 mol/L NaOH提取,蓝色素粗提物的平均得率为64.1 g/100 L.粗提物为不均匀的黑蓝色片状颗粒.关于微生物蓝色素的报道中多为粗溶液的研究,仅有报道的蓝色素粗提物为紫红色素粉末[11],本实验提取得到的色素为新物质.
在碱性条件下加热搅拌,促进粗色素溶液中的蛋白质等物质与色素分子结合,并发生沉淀,形成粗提物.将色素粗提物用pH=9.0的缓冲溶液溶解,出现少量的不溶物,溶液在590 nm处测定A值,根据公式计算色价为45.8.
3 结论
利用初筛培养基从土壤中筛选得到7株能产生蓝色素的放线菌,其菌落及周围培养基中扩散有大量水溶性的蓝色素.利用液体发酵法对初筛得到的菌株进行复筛,其中有2株放线菌无色素产生,另有1株放线菌的产量突出,命名为cya-5.
对cya-5的发酵条件进行研究,结果显示蓝色素生产的最优培养基配方为甘油20 g/L、KNO31 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.01 g/L,NaCl 0.5 g/L,初始pH值为8.5,其中氮源浓度和碳源浓度对色素产量影响较大;培养温度为30℃,装液量为100 mL/250 mL,发酵时间为96 h,发酵液的A590值可达12.02,与张和春等研究的分泌色素量相比较,略高.
碱沉发酵液得到不均匀的黑蓝色片状色素物质,该物质比较稳定,溶解于pH=9的水溶液呈现深蓝色.通过测定,该色素粗提物的色价为45.8,较市售的栀子蓝色素的色价低,主要原因为粗提物的纯度不够,在以后的研究工作中应进一步纯化.
[1] 张国文.食用色素的研究现状与前景[J].粮油食品科技,2004,12(6):17-19.
[2] 毛得奖,朱亚玲.我国天然蓝色素研究现状[J].中国食品添加剂,2011,36(10):109-114.
[3] 车双辉,杜琪珍,夏明.天然蓝色素的研究进展[J].食品研究与开发,2003,24(2):18-20.
[4] 赵辉,闫华晓.一株产蓝色素海洋链霉菌及其色素性质的研究[J].食品研究与开发,2009,30(6): 186-188.
[5] 张和春.天蓝色链霉菌产蓝色素的摇瓶发酵优化[J].食品与发酵,1999,25(5):23-27.
[6] 陆玲,孙延涛,唐勇,等.一种放线菌发酵产天然蓝色素的研究[J].微生物学通报,2001,28(4):50-54.
[7] 赵东红,陆玲,秦怀兰.一种微生物发酵产蓝色素的稳定性及毒性研究[J].食品与发酵,1998,24 (5):21-24.
[8] 张和春,陈亮,季文明,等.产蓝色素放线菌的初步鉴定和蓝色素性质研究[J].无锡轻工大学学报,1999,18(3):23-28.
[9] 徐尤智,梁华正,陈贺,等.高色价栀子蓝色素的制备及其稳定性研究[J].现代食品科技,2011,27 (4):440-443.
[10]孙平.食品添加剂[M].北京:中国轻工业出版社,2004:99-100.
[11]李一苇,陈晓琳,张明.一株产蓝色素菌株生物学特性及色素基本性质的研究[J].生物学杂志2007,24(1):41-43.

