含溴丁氧基的手性偶氮苯化合物的合成及其光异构化
赵常礼, 何延胜, 刘 坤
(沈阳化工大学材料科学与工程学院,辽宁沈阳110142)
目前,含有反应性功能基团的手性偶氮苯化合物(如含双键、羟基、卤基和羧酸基等偶氮苯衍生物)可以通过共聚、接枝或大分子化学反应等方法引入高分子链上,合成得到具有光致变色功能的手性偶氮苯聚合物,在全息光存储、非线性光学和液晶显示材料等领域具有潜在的应用[1-5].朱红平[6]等合成了含手性碳原子的偶氮苯生色团,通过酰氯化反应制备了含手性偶氮苯生色团的单体,再将其与丙烯酸酯类单体进行自由基共聚,得到以手性偶氮苯生色团为侧链的高分子.在激光照射下,聚合物中手性偶氮苯基团可形成光致各向异性,具有良好的全光开关效应.Jiang Feng[7]等以4-羧基-4'-羟基偶氮苯为原料,经氯代烷取代反应,羧酸酯化反应制得S(-)-3-甲基-3-{4-[4-(n-辛氧基)苯基偶氮苯基]羰基}氧-1-丙炔,预测可以通过共聚来制备带共轭螺旋结构的聚乙炔.陆子凤[8]等合成得到手性偶氮分子N-[4-(4-十二烷氧基苯基偶氮)苯甲酰]-L-谷氨酸,该化合物掺杂的聚合物薄膜具有响应时间快、可擦重写、耐疲劳度高的特点,可用作实时存储材料.本课题组[9]合成出4-(羧酸-2-甲基丁酯基)-4'-辛氧基偶氮苯,在甲醇溶液中该手性偶氮苯化合物经360 nm和440 nm紫外-可见光交替照射下发生光致变色反应,没有光降解等副反应.但其分子结构中没有反应性基团,不能与高分子链形成化学键,只能通过掺杂分散于高分子薄膜中,易产生相分离.
本文制备出一种新型含溴代烷氧基的手性偶氮苯化合物——4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯(CMB-Azo),并研究其顺反光异构化反应.在偶氮苯分子一端引入手性碳原子以改变其光学性能;在分子另一端引入含有溴代烷氧基反应性功能基团,可用来通过大分子反应将手性偶氮苯分子接入高分子链上.
1 实验部分
1.1 试剂
4-羧基-4'-羟基偶氮苯,实验室制备;氢氧化钠、碳酸钾、碘化钾、丙酮、正己烷、甲醇、乙酸乙酯、二氯甲烷、四氢呋喃等试剂为分析纯,1,4-二溴丁烷为化学纯,硅胶,柱层析用60~100目,以上试剂均由国药集团化学试剂有限公司生产;盐酸,分析纯,北化精细化学品有限公司;S(-)-2-甲基-1-丁醇,分析纯,Aldrich化学工业公司;二环己基碳亚胺(DCC),化学纯,东京仁成工业株式会社;4-二甲氨基吡啶(DMAP),分析纯,梯希爱(上海)化成工业发展有限公司.
1.2 合成路线
含溴代丁氧基手性偶氮苯化合物的合成路线如下:
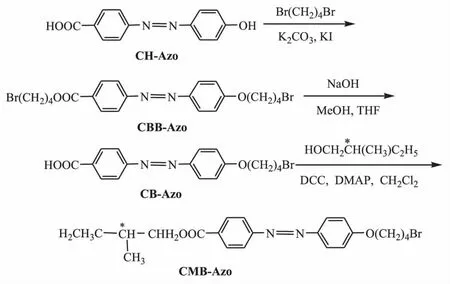
(1)4-羧基-4'-羟基偶氮苯(CH-Azo)的合成
按文献[1]的方法,将对氨基苯甲酸重氮化后与苯酚偶合,得到4-羧基-4'-羟基偶氮苯,用丙酮重结晶3次.产率为85%;m.p.为270~272℃.
(2)4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯(CBB-Azo)的合成
将2.42 g(0.01 mol)4-羧基-4'-羟基偶氮苯、10.9 g(0.05 mol)1,4-二溴丁烷、5 g无水碳酸钾和少量碘化钾溶于70 mL丙酮中,在磁力搅拌下,加热至65℃回流反应24 h.反应物冷却到室温,过滤,除去碳酸钾等无机盐固体,浓缩滤液出现大量沉淀,经抽滤真空干燥后得到黄色晶体,产率为80%.以丙酮/正己烷(体积比1:1)为洗脱剂,经硅胶色谱柱提纯.在丙酮中重结晶3次得黄色晶体.m.p.:75~77℃.
(3)4-羧基-4'-(1-溴丁氧基)偶氮苯(CBAzo)的合成
将2.56 g(0.005 mol)4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯加入到甲醇和四氢呋喃(体积比1:1)的混合液中,待充分溶解后加入含0.56 g(0.01 mol)NaOH的甲醇溶液,在50℃条件下水解反应3 h,反应后用稀盐酸调节溶液的pH值至1~2,得到黄色晶体沉淀为4-羧基-4'-(1-溴丁氧基)偶氮苯.经抽滤、水洗、真空干燥,产率为56%.利用硅胶色谱柱进行提纯[丙酮/正己烷(体积比1∶1)为洗脱剂].在丙酮中重结晶3次得黄色晶体.m.p.:226~228℃.
(4)4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯(CMB-Azo)的合成
将1.38 g(0.003 7 mol)4-羧基-4'-(1-溴丁氧基)偶氮苯、1.14 g(0.005 5 mol)二环己基碳亚胺(DCC)、0.24 g(0.002 mol)4-二甲氨基吡啶(DMAP)和40 mL二氯甲烷加入到三口瓶中,在磁力搅拌下滴加10 mL含0.5 g(0.005 5 mol) S(-)-2-甲基-1-丁醇的二氯甲烷溶液,升温至30℃反应24 h.将反应液倒入分液漏斗中水洗3次,有机层用无水MgSO4干燥,浓缩后得粗品,产率为83%.以乙酸乙酯/正己烷(体积比1∶1)为洗脱剂,经硅胶色谱柱提纯.在丙酮中重结晶3次得黄色晶体.m.p.:52~54℃。
1.3 分析检测
红外光谱分析采用美国热电公司的EXUS-470型傅立叶变换红外光谱仪(KBr压片法).核磁共振采用Varian公司的Mecury-Vx300型核磁共振仪(以氘代DMSO为溶剂).紫外吸收光谱采用Hitachi公司的 U-3310型紫外可见分光光度计.光异构化反应实验采用天津拓普仪器公司生产的GY-10型150 W高压氙灯为照射光源,配有DS-3型波长调节单色仪(波长调节:[(200~800)±0.5]nm).
2 结果与讨论
2.1 红外光谱分析
图1是4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯、4-羧基-4'-(1-溴丁氧基)偶氮苯和4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯的红外光谱图.
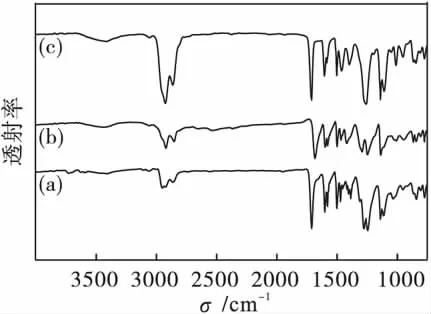
图1 CBB-Azo、CB-Azo和CMB-Azo的红外光谱Fig.1 FT-IR spectra of CBB-Azo、CB-Azo and CMB-Azo
从图1(a)线可以看出:4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯在1 712 cm-1处出现羧酸酯C==O的伸缩振动峰,1 276 cm-1处出现C—O单键的伸缩振动峰,1500cm-1处为N==N的伸缩振动峰;而在1 601、1 471和1 454 cm-1处出现3个峰为苯环骨架上伸缩振动峰,840 cm-1处苯环对位取代C—H面外弯曲振动峰.
图1(b)线是4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯与氢氧化钠反应产物的红外光谱图.由图1(b)可知:1 712 cm-1处羧酸酯的C==O的伸缩振动峰消失,在1 682 cm-1处出现羧基C==O的伸缩振动峰,C—O单键的伸缩振动峰从1 276 cm-1移到1 292 cm-1处,1 500 cm-1处为N==N的伸缩振动峰,苯环骨架以及苯环对位取代的特征峰几乎未变化,证明生成的中间产物为4-羧基-4'-(1-溴丁氧基)偶氮苯.
图1(c)线是4-羧基-4'-(1-溴丁氧基)偶氮苯与S(-)-2-甲基-1-丁醇发生酯化反应产物的红外光谱图.1 682 cm-1处羧基C==O的伸缩振动峰消失,在1 713 cm-1处出现羧酸酯C==O的伸缩振动峰,表明羧酸与醇酯化生成酯类;在1 680 cm-1处无吸收峰,说明产物中无未反应的4-羧基-4'-(1-溴丁氧基)偶氮苯.此外,苯环骨架以及苯环对位取代的特征峰几乎未变化,分别处于1 600、1 460和840 cm-1处,1 501 cm-1处为N= =N的伸缩振动吸收峰,1 257 cm-1处为C—O单键的伸缩振动峰,说明生成产物为4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯.
2.2 1H-NMR图谱分析
图2是4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯(a)、4-羧基-4'-(1-溴丁氧基)偶氮苯(b)和4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯(c)的核磁共振氢谱.化学位移数据对照分子结构与氢谱上的数字标识如下:
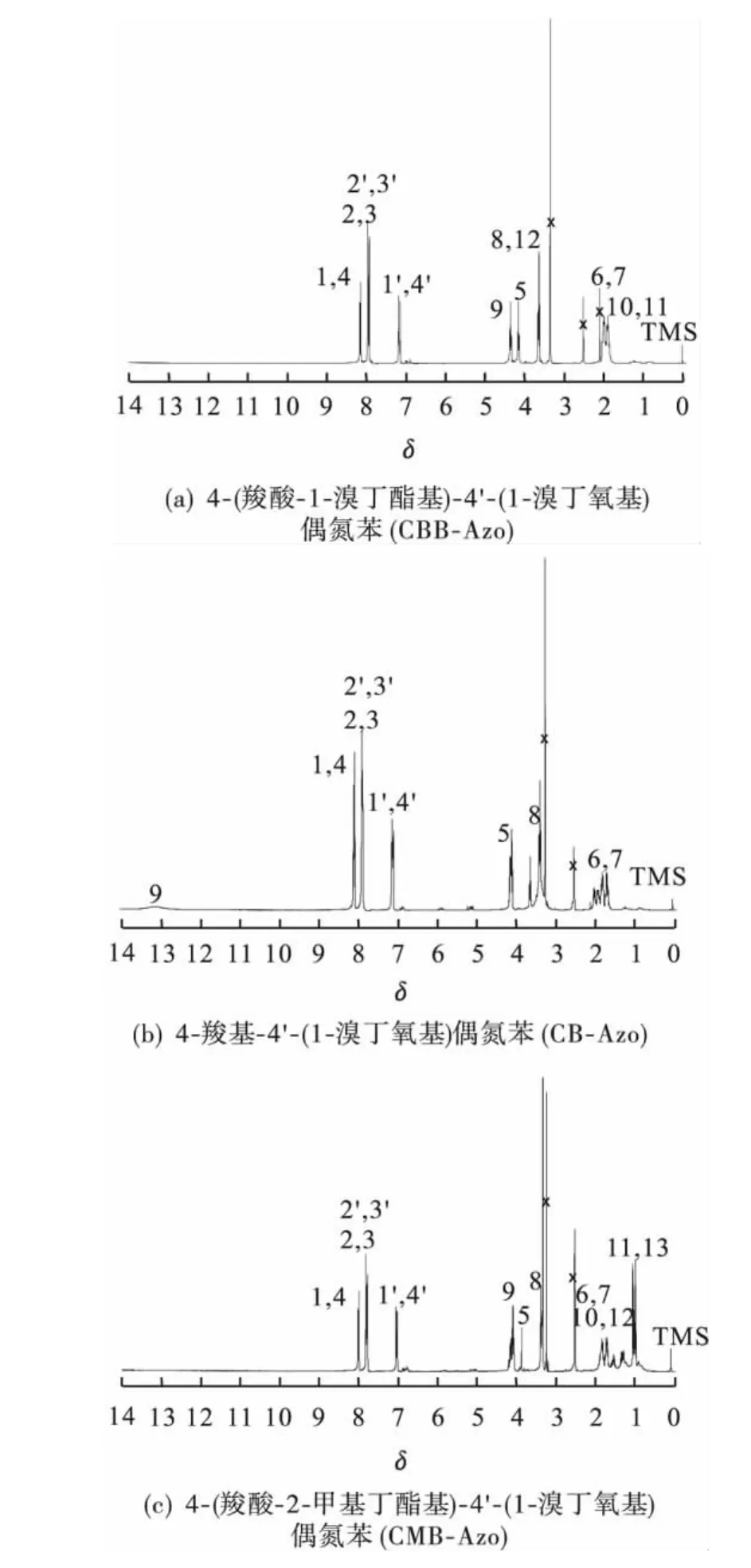
图2 CBB-Azo、CB-Azo和CMB-Azo的核磁共振氢谱Fig.2 1H-NMR spectra of CBB-Azo、CB-Azo and CMB-Azo
图2(a)是氘代DMSO溶剂中4-(羧酸-1-溴丁酯基)-(4'-(1-溴丁氧基))偶氮苯的1H-NMR谱图.苯环上邻接COO(2H)、—N==N—(4H)、O(2H)的化学位移 δ分别在 8.11、7.93和7.16.δ=4.35对应COOCH2(2H)的化学位移,δ=4.16对应OCH2(2H)的化学位移,δ=3.64出现CH2Br(4H)化学位移,δ=1.90~2.10出现CH2CH2(8H)的化学位移.结果表明:1,4-二溴丁烷与4-羧基-4'-羟基偶氮苯的羧基和羟基都发生化学反应,生成产物为4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯.
图2(b)是4-羧基-4'-(1-溴丁氧基)偶氮苯在氘代DMSO溶剂中的1H-NMR谱图.与图2(a)相比,在δ=13.21出现COOH(1H)的化学位移,δ=4.10出现OCH2(2H)的化学位移,δ= 3.30出现CH2Br(2H)化学位移,在δ=1.69~2.01间出现CH2CH2(4H)的化学位移,而在δ= 4.35处未出现COOCH2(2H)的化学位移,表明4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯经过水解反应后产物为4-羧基-4'-(1-溴丁氧基)偶氮苯.
图2(c)是氘代DMSO溶剂中4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯的1H-NMR谱图.在δ=13.21处COOH的化学位移消失,同时在δ=4.31出现羧酸酯COOCH2(2H)的化学位移.3.80、3.30和0.90~1.90分别对应OCH2(2H)、CH2Br(2H)和 CH2CH2、CH3的化学位移,8.11、7.93和7.16分别对应苯环上邻接COO(2H)、—N==N—(4H)、O(2H)的化学位移.结果证明产物为4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯.
2.3 CMB-Azo在甲醇溶液中的光异构化反应
图3是在光照射下4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯(CMB-Azo)的紫外可见吸收光谱变化.从图3(a)可知:358 nm和450 nm的吸收峰分别归属于CMB-Azo中偶氮苯基团的反式结构(π→π*)和顺式结构(n→π*)的电子跃迁.用355 nm紫外光照射,反式结构358 nm吸收峰逐渐降低,且最大吸收波长不断减少至335 nm,即发生了蓝移23 nm.而顺式结构450 nm吸收峰逐渐升高,但增幅较小.当照射90 min后,紫外光谱图不再变化,达到光稳态.在紫外光照射过程中,未出现新的吸收峰,且在315 nm和420 nm处出现良好的等吸收点.结果表明CMB-Azo中偶氮基团发生反式到顺式的光异构化反应.
在紫外光照射达到光稳态后,该溶液经455 nm的可见光照射,发生可逆光化学变化,如图3(b)所示.335 nm处的吸收峰逐渐增加,且红移至最初的358 nm.而450 nm吸收峰逐渐降低.经90 min的照射后,曲线仅恢复到初始状态的60%,且随着照射时间的增加,恢复趋势逐渐降低.表明在可见光照射下CMB-Azo中偶氮苯基团由顺式恢复到反式结构.
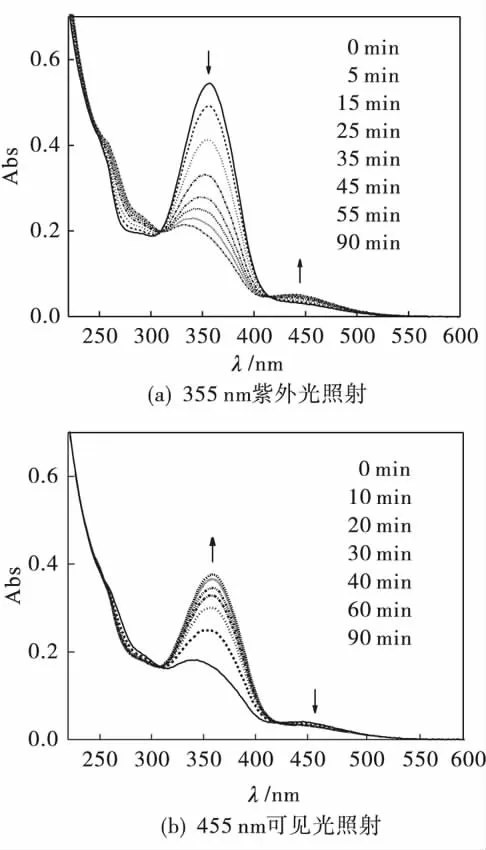
图3 光照射下CMB-Azo的紫外可见吸收光谱变化Fig.3 Changes in UV-Vis spectra of CMB-Azo irradiated by the light
图4是在光照射下4-(羧酸-1-溴丁酯基)-4'-(1-溴丁氧基)偶氮苯(CBB-Azo)的紫外可见吸收光谱变化.由图4(a)可以看出:随着355 nm的紫外光的照射,反式CBB-Azo的358 nm吸收峰逐渐降低,且蓝移至340 nm(即蓝移18 nm),而顺式结构450 nm吸收峰强度缓慢增加.当照射65 min后达到光稳态。在紫外光照射过程中,310 nm和420 nm处出现良好的等吸收点,表明在紫外光照下CBB-Azo中偶氮基团发生反式到顺式的光异构化.
同样,用455 nm可见光对该溶液进行照射,如图4(b)所示.340 nm处的吸收峰逐渐增加,且红移至原来的358 nm,而450 nm可见光区的吸收峰逐渐降低.在90 min可见光照射下,恢复到原来状态的92%.结果表明在可见光照射下CBB-Azo中偶氮苯基团由顺式恢复到反式结构.
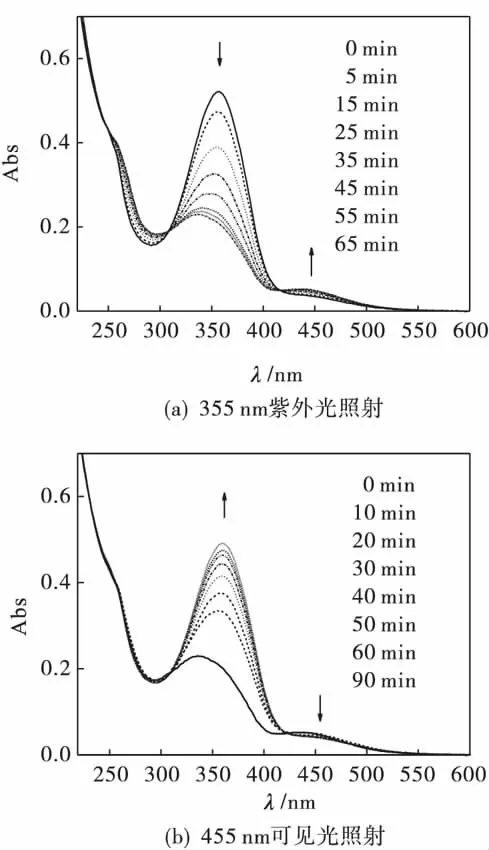
图4 光照射下CBB-Azo的紫外可见吸收光谱变化Fig.4 Changes in UV-Vis spectra of CBB-Azo irradiated by the light
图5是CMB-Azo和CBB-Azo的甲醇溶液在光照射下相对吸收At/A0的时间变化曲线.从图5(a)可知:在355 nm紫外光照射下,CMB-Azo和CBB-Azo均发生反式-顺式的异构化,且光异构化速率基本相同.从图5(b)可知:在455 nm可见光照射下,CMB-Azo和CBB-Azo均发生顺式-反式的光异构化反应.其中顺式CBB-Azo基本能够恢复到原来的反式结构;在455 nm可见光照射90 min时,92%的顺式CBB-Azo恢复到反式结构.但顺式CMB-Azo恢复反式结构较CBB-Azo慢,且即使增加光照射时间,也不能完全恢复到原来的反式结构;当455 nm可见光照射90 min时,仅60%的顺式CMB-Azo恢复到反式结构.这表明引入手性碳原子,CMB-Azo中偶氮苯分子形成不对称结构,可能导致顺式CMB-Azo不能完全恢复原来的反式结构.
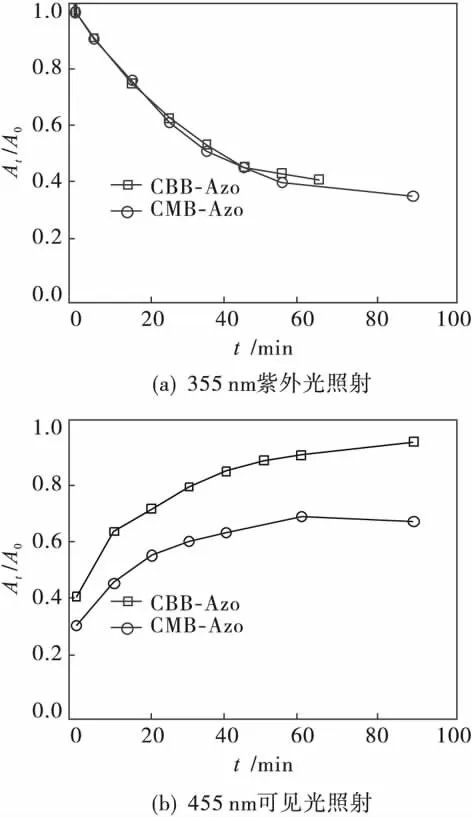
图5 CMB-Azo和CBB-Azo的甲醇溶液在光照射下At/A0的时间变化曲线Fig.5 At/A0curves of CMB-Azo and CBB-Azo in MeOH
3 结论
以4-羧基-4'-羟基偶氮苯为原料,经溴代烷取代、水解反应,再与S(-)-2-甲基-1-丁醇酯化制得含溴丁氧基的手性偶氮苯化合物——4-(羧酸-2-甲基丁酯基)-4'-(1-溴丁氧基)偶氮苯(CMB-Azo).利用FT-IR和1H-NMR对反应中间体及合成产物的结构进行了表征.
通过UV-Vis光谱研究表明:在甲醇溶液中CMB-Azo经355 nm紫外光照射发生反式-顺式的异构化,经455 nm的可见光照射发生顺式-反式的异构化反应.但由于手性碳原子的引入,顺式的CMB-Azo仅60%恢复到原来的反式结构.
[1] 张文泉,施文芳.全偶氮苯官能化树枝状聚合物的合成[J].高等学校化学学报,2007,28(5):1002-1004.
[2] Munakata K,Harada K,Itoh M,et al.A new Holographic Recording Material and Its Diffraction Efficiency Increase Effect:the Use of Photoinduced Surface Deformation in Azo-polymer Film[J].Opt.Commun.,2001,191(1/2):15-19.
[3] Wu L,Tuo X,Cheng H,et al.Synthesis,Photoresponsive Behavior and Self-assembly of Polyacrylic Acid-based Azo Polyelectrolytes[J].Macromolecules,2001,34(23):8005-8013.
[4] 陈思,谢孔泉.含手性碳偶氮苯化合物的合成及其光致变色性能[J].东华大学学报(自然科学版),2009,35(5):554-559.
[5] 彭游,赵志刚,杨祖幸,等.手性偶氮光敏性分子钳的设计与合成[J].有机化学,2005,25(4):462-465.
[6] 朱红平,吴水珠,佘卫龙,等.新型含偶氮苯生色团聚合物的制备和性能[J].材料研究学报,2005,19 (3):282-286.
[7] Jiang F,Ling Y,Qu J,et al.Synthesis and Crystal Structure of a Novel Chiral 1-methylpropargyl Ester Carrying Azobenzene Moiety[J].Chinese J.Struct.Chem.,2010,29(1):146-150.
[8] 陆子凤,张彦杰,吴志发,等.手性偶氮苯衍生物的光致变色和全息存储特性研究[J].中国激光,2005,32(2):265-268.
[9] 李甜,赵常礼,何延胜.含手性碳偶氮苯化合物的合成及光异构化反应[J].沈阳化工大学学报,2011,25(4):310-315.

