结核分枝杆菌低剂量感染小鼠模型的建立与分析
林树柱 董娜 向志光 徐艳峰 占玲俊 马春梅 秦川
目前越来越多的研究表明,BCG作为临床应用的结核病疫苗,仅对幼儿严重的结核病有预防作用,但是对成年人结核病,尤其Mtb潜伏感染与再发,没有效果[1-2]。据估计全世界有大约1/3的人口潜伏感染Mtb,这使得潜伏感染致结核病的再发成为一个严重的问题,潜伏感染结核病再发后,容易出现肺部空洞病变,是结核病传播的重要传染源[2]。但是,目前对于Mtb潜伏感染及再发结核病的机制尚缺乏足够的了解,尚无有效的预防结核病再发的方法。因此,研究潜伏感染状态下细菌的特征与机体的免疫反应,了解细菌与机体的相互作用,开发有效的针对Mtb潜伏感染与结核病再发的疫苗和药物是当务之急。动物模型是进行致病机理研究和开发疫苗、药物不可缺少的工具,而目前Mtb潜伏感染的动物模型普遍存在经药物治疗、或虽未经药物治疗但组织荷菌量较高的问题,因此潜伏感染的动物模型需进一步研究。本研究采用100菌落形成单位(CFU)的 Mtb,通过尾静脉注射的方式感染C57BL/6J型小鼠,制备了低剂量Mtb感染的小鼠模型,并对该模型的荷菌量、组织病理及部分免疫变化进行了分析。以期对Mtb慢性持续感染或潜伏感染的研究提供有用的工具。
材料和方法
1.实验用菌株:小鼠感染用菌株为Mtb标准株H37Rv(CMCC93009),由中国药品生物制品检验检定所提供。实验用菌株的制备参照参考文献[3]。菌株经小鼠体内2次增毒,置于Lowenstein-Jensen固体斜面培养基(美国BD公司)培养,收获斜面培养3周的Mtb,在7H9液体培养基中研磨,经5μm无菌滤器(Millipore公司)过滤,制成单细胞菌悬液,分装、冻存于-80℃冰箱备用。单细胞悬液10倍系列稀释,接种于Lowenstein-Jensen固体斜面培养基斜面,培养3周后计数,制备的单细胞悬液菌浓度为1.5×106CFU/ml。
2.实验动物:实验中使用的小鼠为6~8周龄的雌性C57BL/6J小鼠,体质量17~19 g,SPF(specific pathogen free)级,购自北京华阜康生物科技股份有限公司,合格证编号SCXK(京)2009-0004。小鼠的饲养与实验在中国医学科学院医学实验动物研究所动物生物安全3级实验室进行。实验前1周,小鼠进入动物生物安全3级实验室适应环境。实验动物的使用得到了中国医学科学院医学实验动物研究所实验动物使用和管理委员会的批准(批准号MC-09-2003)。
3.动物的感染:Mtb单细胞悬液,用生理盐水稀释至400 CFU/ml。通过尾静脉注射的方法感染小鼠,感染剂量为100 CFU/只小鼠,共感染小鼠40只。在感染后24周内未出现结核病临床症状,毛色、活动度、饮食均正常,实验期间没有小鼠死亡,按计划分别在感染后1、3、5、8、12、16、20、24周取肺、脾、肝组织,进行组织荷菌量、病理及细胞因子分析,每个时间点取5只小鼠。
4.组织荷菌量分析:无菌操作所取左侧整叶肺组织和1/2脾组织,先后经生理盐水、4%硫酸和生理盐水漂洗,加1 ml生理盐水用玻璃匀浆器研磨,组织悬液经生理盐水按照1∶10进行梯度稀释,取原倍、10-1、10-2、10-34个稀释度的组织匀浆稀释液100μl接种于Lowenstein-Jensen固体斜面培养基斜面,每个稀释度平行接种3支斜面,37℃培养3周后进行菌落计数。取每个斜面上的菌落数在5~50 CFU范围内的稀释度进行组织荷菌量计算。每个时间点的5只小鼠用于荷菌量统计的稀释度相同。荷菌量结果利用Excel软件进行分析。
5.病理分析:剩余的脾、肺及肝脏组织置4%中性甲醛固定液中固定7 d,脾脏组织按长轴横切面进行修块,肺组织沿肺门方向修块。石蜡包埋,切片厚度为4μm,之后进行常规HE染色。由有经验的病理专家统一按照每个切面的病灶类型、病灶大小和数量进行病理学分析和评价。
6.IFN-γ检测:小鼠摘眼球取血,静置后离心得血清,-80℃冰箱保存备用。用ELISA方法分析小鼠感染后血清中IFN-γ的变化情况,ELISA试剂盒购自美国eBioscience公司,敏感度为15 pg/ml,操作按试剂盒说明书进行。
结 果
1.肺、脾组织荷菌量分析:按实验计划分别在感染后的不同时间点检测小鼠的组织荷菌量。肺组织匀浆在感染后3周开始有个别小鼠可以检测到极少量的Mtb,整个实验过程中小鼠肺组织荷菌量持续处于较低的状态,荷菌量在0~103CFU之间,个体差异较大。因肺组织荷菌量在小鼠个体间差异较大,不适合进行统计学分析,具体肺组织荷菌量结果未给出。
脾组织荷菌量结果如图1所示,小鼠感染1周脾脏可以检测到极少量的Mtb,脾脏组织的荷菌量为(2.13±0.75)lg CFU,此后结核分枝杆菌在小鼠体内复制,荷菌量上升,在感染后3周小鼠脾脏荷菌量达到(4.97±0.19)lg CFU。在小鼠感染后5周脾脏荷菌量自然下降至(3.64±0.22)lg CFU,之后在较长一段时间脾脏荷菌量保持在一个较低的水平,感染后8周达到最低的(2.75±0.23)lg CFU,至感染后20周,荷菌量又明显上升,达到(4.49±0.47)lg CFU,之后荷菌量持续缓慢上升。
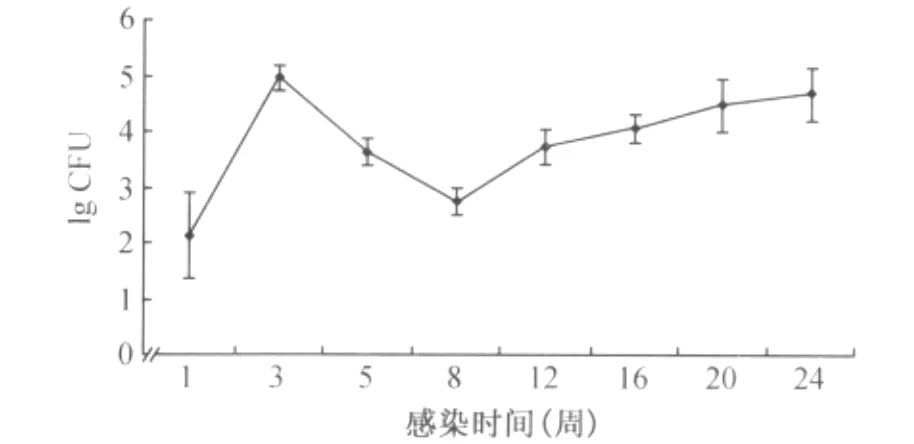
图1 小鼠感染H37Rv后脾脏荷菌量的动态变化
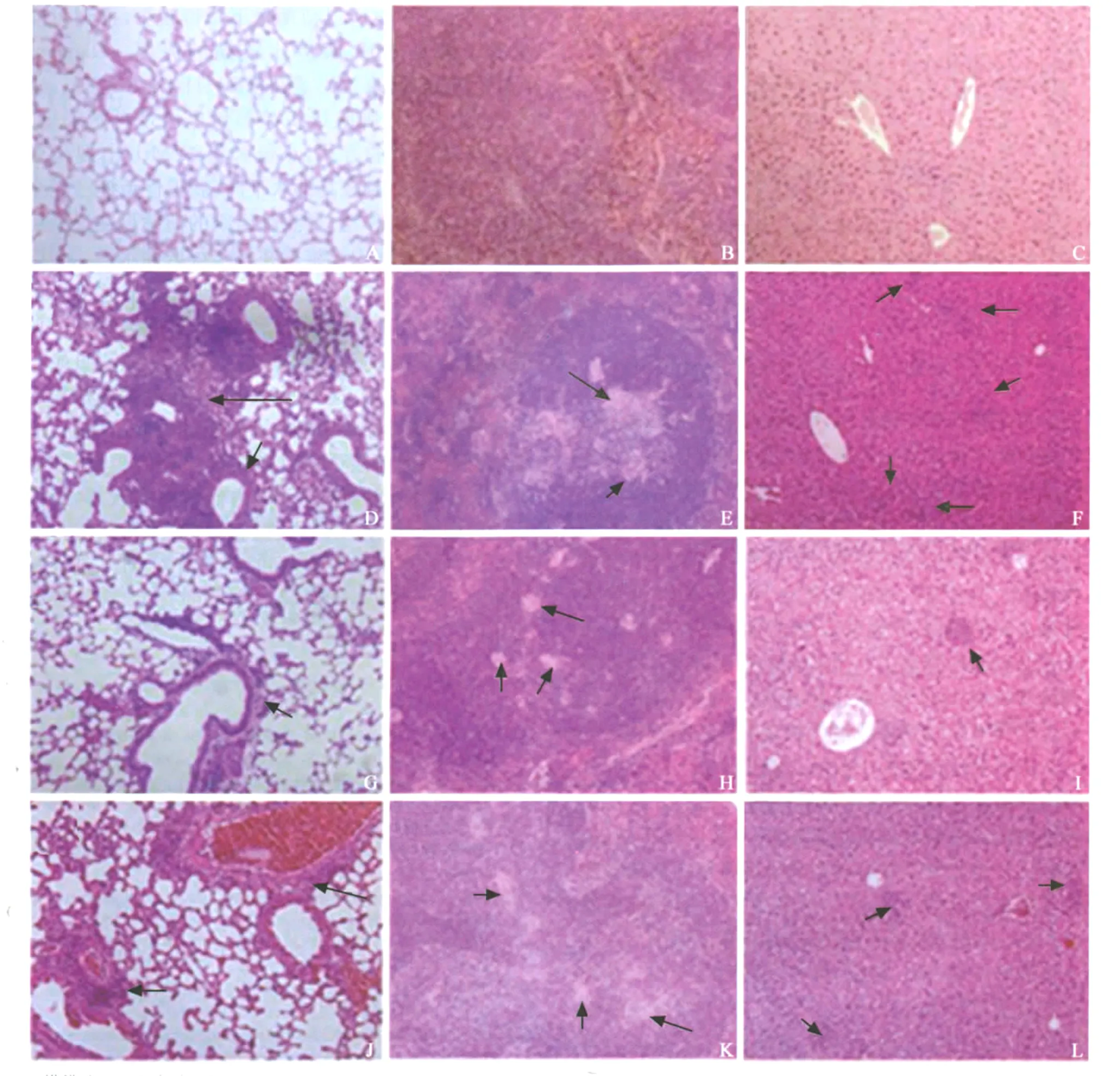
图2 小鼠感染后肺、脾、肝组织的病理变化
2.病理分析:小鼠感染后1周,肝细胞点灶状坏死伴小灶性炎细胞浸润;3周肝脏出现散在的小肉芽肿,脾脏出现肉芽肿,个别肺组织内血管周围少量炎细胞浸润;5周肝、脾肉芽肿大小与数量进一步扩大,肺组织内血管周围炎细胞浸润,偶见肉芽肿;8周病理改变减轻,肝、脾有少数肉芽肿,肺组织内血管周围少量炎细胞浸润,恢复到与3周病理改变相似的程度;12周比8周略有减轻,肝、脾仍有少量肉芽肿;16周病变稍有加重,肝细胞点灶状坏死伴小灶性炎细胞浸润,肝、脾、肺均可见少数小肉芽肿;20周肝组织内有少数小肉芽肿,脾组织肉芽肿,肺组织内血管周围炎细胞浸润、少数肉芽肿;之后肝、脾、肺组织病变进一步加重,肉芽肿大小与数量逐步增加,至24周病变程度与感染后5周近似。部分病理图片如图2所示。
3.IFN-γ检测结果:结果如图3所示,血清中IFN-γ的浓度在小鼠感染后3周出现升高,在感染后5周达到最高水平,此后血清中IFN-γ的浓度下降,至20周又开始上升。
讨 论
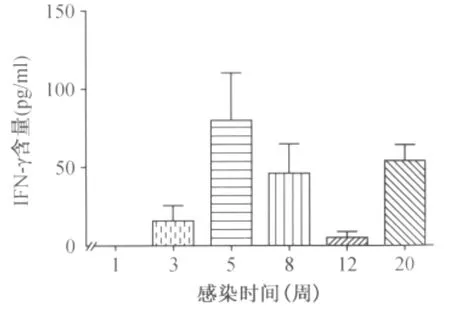
图3 小鼠感染后血清IFN-γ的含量动态变化
Mtb感染小鼠模型是结核病研究中最常用的动物模型之一。和人类一样,小鼠能对Mtb感染产生强烈的免疫反应,而且小鼠相关的免疫试剂非常齐全,有大量的免疫指标可以测定,所以人类对Mtb感染免疫的研究结果大多数都是利用小鼠模型得到的。小鼠结核模型易复制,感染实验室条件易控制,作为新药评价模型也是非常经济有效的[1,4-5]。Mtb感染小鼠模型以模拟急性感染较多,对潜伏感染最著名的是Cornell模型[6],但是此模型中,小鼠感染后经过了抗结核药物治疗,与人类的自然潜伏感染存在较大的差异。本研究建立了一种Mtb低剂量感染小鼠的模型,该模型未经过药物治疗的过程,在较长的时间内维持了一个较低的荷菌水平,并且病理改变也有所减轻,在一定程度上可以模拟人类Mtb的慢性持续感染或潜伏感染的形态和过程。
本研究所选用的小鼠品系C57BL/6J对低剂量Mtb感染具有抗性[7],尾静脉注射的感染方式虽然不如气溶胶感染的方式更能模拟人的自然感染,但是其比气溶胶感染更容易在感染后将组织荷菌量控制在一个较低的水平[2,8]。感染用菌为 Mtb标准株H37Rv,感染菌量为100 CFU/只小鼠。感染后1周小鼠脾脏均有Mtb检出,而且小鼠感染后1~3周脾脏荷菌量升高了2.85 lg CFU,这些结果说明对小鼠的感染是成功的,并且感染所用菌株毒力可靠[9]。小鼠脾脏在感染后最初的3周内,组织荷菌量迅速上升至(4.97±0.19)lg CFU,之后在未经治疗的条件下,脾组织荷菌量被机体自然控制,在感染后5周下降至(3.64±0.22)lg CFU,到感染后8周时更是下降到(2.75±0.23)lg CFU,比3周时下降了2.22 lg CFU。同时小鼠的病理变化也在感染5周之后自然减轻。推测小鼠脾脏荷菌量的显著降低和病理变化的减轻,是由于小鼠对Mtb的获得性免疫在感染后2周启动[10],至感染3周后已经全面建立,机体的免疫反应起到了清除Mtb感染的作用,血清IFN-γ水平的变化也佐证了这一点。
之前已有文献报道,小鼠感染后随着获得性免疫的建立,组织荷菌量也会达到一个稳定的水平,不再升高,说明免疫反应可抑制 Mtb的增殖。Phys等[2]的报道中之所以荷菌量下降得较少,推测可能是由于感染Mtb菌量比较高的原因。Radaeva等[11]用低剂量的 Mtb感染 (B6×I/St)F1小鼠,感染一段时间后,脾脏组织荷菌量也出现自然降低。经尾静脉感染的方式,小鼠肺组织Mtb出现得较晚[3],在尚未达到较高的水平时,获得性免疫已经全面建立,并发挥作用,导致肺组织的荷菌量在感染后较长的一段时间内都维持在一个很低的水平。与以往的报道相比,本研究建立的低剂量Mtb感染小鼠在未用药物处理的情况下,通过机体自身的免疫反应有效地控制了Mtb的感染,组织荷菌量明显下降,病理损伤减轻,这为研究结核感染初期免疫反应对Mtb的控制与清除提供了有效的工具。而且,感染小鼠组织的荷菌量比已有文献报道的更低,并且在较长一段时间内维持了体内低带菌的状态,组织病变较轻,可用于Mtb慢性持续感染或潜伏感染的致病机理与免疫学研究,同时可为针对Mtb慢性持续感染或潜伏感染的药物与疫苗的开发、评价提供有用的工具。
[1]Gupta UD,Katoch VM.Animal models of tuberculosis.Tuberculosis(Edinb),2005,85(5/6):277-293.
[2]Phyu S,Mustafa T,Hofstad T,et al.A mouse model for latent tuberculosis.Scand J Infect Dis,1998,30(1):59-68.
[3]向志光,林树柱,董娜,等.结核分枝杆菌感染小鼠的脾脏和肺脏组织荷菌量与病理变化.中国比较医学杂志,2011,21(8):66-68.
[4]Apt A,Kramnik I.Man and mouse TB:contradictions and solutions.Tuberculosis(Edinb),2009,89(3):195-198.
[5]袁伟,秦川.结核病动物模型研究进展.中国比较医学杂志,2010,20(9):55-59.
[6]黎友伦,王国治,罗永艾.结核分枝杆菌潜伏感染动物模型及评价.中华结核和呼吸杂志,2005,28(8):552-554.
[7]Medina E,North RJ.Resistance ranking of some common inbred mouse strains to Mycobacterium tuberculosis and relationship to major histocompatibility complex haplotype and Nrampl genotype.Immunology,1998,93(2):270-274.
[8]Kelly BP,Furney SK,Jessen MT,et al.Low-dose aerosol infection model for testing drugs for efficacy against Mycobacterium tuberculosis.Antimicrob Agents Chemother,1996,40(12):2809-2812.
[9]Nuermberger E.Using animal models to develop new treatments for tuberculosis.Semin Respir Crit Care Med,2008,29(5):542-551.
[10]Davis JM,Ramakrishnan L.The role of the granuloma in expansion and dissemination of early tuberculous infection.Cell,2009,136(1):37-49.
[11]Radaeva TV,Nikonenko BV,Mischenko VV,et al.Direct comparison of low-dose and Cornell-like models of chronic and reactivation tuberculosis in genetically susceptible I/St and resistant B6 mice.Tuberculosis(Edinb),2005,85(1/2):65-72.

