α干扰素和利巴韦林抗丙型肝炎病毒作用的比较研究
杨猛,何胜菲,任浩,赵兰娟,戚中田
1. 第二军医大学研究生管理大队临床十队,上海 200433; 2. 第二军医大学微生物学教研室,上海市医学生物防护重点实验室,上海 200433
丙型肝炎病毒(hepatitis C virus, HCV)感染可导致慢性肝炎、肝硬化和肝细胞肝癌及一些自身免疫性疾病,感染人数约1.7亿[1]。然而,治疗HCV感染可供选择的药物极其有限。α干扰素(interferon α, IFN-α)联合利巴韦林是临床治疗丙型肝炎的标准方案。IFN-α作为抗病毒感染的第1道防线,在病毒感染人体后迅速发挥抑制病毒复制和增强免疫反应的作用[2]。研究表明,IFN诱导的细胞内信号转导与其抗病毒效应有关。IFN与细胞表面特定受体结合后启动相应信号转导途径,激活Janus激酶/信号转导和转录激活子的经典途径,从而调节一系列干扰素刺激基因(interferon-stimulated gene,ISG)的表达,发挥抗病毒效应[3,4]。利巴韦林是于1970年发现的具有广谱抗病毒活性的鸟嘌呤类似物,通过抑制鸟嘌呤合成,使病毒缺乏合成RNA所需的鸟嘌呤而无法复制。
由于高效体外细胞培养系统和合适小动物模型的长期缺乏,阻碍了对HCV致病机制的深入了解及抗病毒药物和疫苗的研制。近年来,感染性细胞培养产生的HCV(cell culture-derived HCV, HCVcc)的建立极大地推动了HCV致病机制研究、药物筛选和疫苗研制工作[5-7]。本研究采用体外培养的感染性病毒HCVcc为研究对象,比较IFN-α和利巴韦林对HCV复制的影响,以及对干扰素调节因子9(interferon regulatory factor 9, IRF9)和ISG15等抗病毒基因的调节能力。
1 材料和方法
1.1 主要材料
重组人IFN α-2a 和利巴韦林分别为PBL和Merck产品。DMEM 和胎牛血清为HyClone产品。HCV NS3鼠单克隆抗体(简称单抗)和β-actin抗体分别购自Abcam和Cell Signaling Technology公司。HCV E2鼠单抗由Chiron公司Dr. Houghton提供。辣根过氧化物酶(horseradish peroxidase,HRP)-羊抗兔或抗鼠抗体和TRIzol试剂购自Invitrogen公司。增强化学发光(enhanced chemiluminescence,ECL)试剂为Millipore产品。莫洛尼鼠白血病病毒(Moloney murine leukemia virus,M-MLV)反转录酶为Promega公司产品。SYBR Green PCR Kit 购自百泰克公司。Huh7.5.1细胞和HCVcc(J6/JFH1,基因型2a)由本实验室提供,其中HCV 2a J6/JFH株全长基因组质粒FL-J6/JFH1由美国洛克菲勒大学HCV研究中心Dr. Rice教授惠赠。HCVcc的制备及效价测定参见文献[8]。
1.2 方法
1.2.1细胞培养Huh7.5.1细胞在含10%胎牛血清的DMEM培养液中于37 ℃、5% CO2饱和湿度的培养箱中培养。细胞培养液中添加2 mmol/LL-谷氨酰胺、0.1 mmol/L非必需氨基酸、100 μg/ml链霉素和100 u/ml青霉素。
1.2.2IFN和利巴韦林处理细胞Huh7.5.1细胞种植于24孔板内培养过夜,吸弃培养液,用磷酸缓冲液(phosphate buffered saline,PBS)洗1次;将1×105FFU/ml HCVcc以30 μl/孔于37 ℃培养2 h,吸弃病毒液,用PBS洗1次。将含不同浓度IFN-α(0、100、200、400、800、1 000 u/ml用于检测HCV RNA,5、10、20、40、80、100 u/ml用于检测抗病毒基因水平)和利巴韦林(0、1、20、100 μg/ml用于检测HCV RNA水平和蛋白表达,1、5 μg/ml用于检测抗病毒基因水平)的10%胎牛血清DMEM培养基加入孔内,继续培养72 h或96 h。细胞经PBS洗涤后分别制备RNA和蛋白样品,用于实时聚合酶链反应(polymerase chain reaction, PCR)和蛋白免疫印迹检测。
1.2.3引物合成HCV 5′非编码区上游引物:5′-CTTCACGCAGAAAGCGTCTA-3′;下游引物:5′-CAAGCACCCTATCAGGCAGT-3′。内参GAPDH上游引物:5′-TGGGCTACACTGAGCACCAG-3′;下游引物:5′-AAGTGGTCGTTGAGGGCAAT-3′。IRF9上游引物:5′-CCACCGAAGTTCCAGGTA-ACAC-3′;下游引物:5′-AGTCTGCTCCAGCAA-GTATCGG-3′。ISG15上游引物:5′-CTCTGA-GCATCCTGGTGAGGAA-3′;下游引物:5′-AA-GGTCAGCCAGAACAGGTCGT-3′。上述引物委托上海英骏生物技术公司合成。
1.2.4实时PCR用TRIzol试剂提取细胞总RNA。反转录反应体系及条件:1 μg RNA,DEPC水补至10 μl,与100 μmol/L随机引物 1 μl混匀,于70 ℃水浴5 min,立即冰浴2 min;然后加入5×M-MLV Buffer 5 μl、10 mmol/L dNTP 1.5 μl、M-MLV 1 μl,DEPC水补至25 μl,混匀于37 ℃水浴1 h以合成cDNA。以上述cDNA作为模板,分别扩增HCV、IRF9、ISG15和GAPDH。反应体系和条件:cDNA模板 2 μl、2×SYBR Green I 10 μl、上游引物(10 μmol/L)0.4 μl、下游引物(10 μmol/L)0.4 μl、双蒸水7.2 μl,混匀后用Rotor-Gene 3000荧光定量PCR仪进行扩增。扩增条件:95 ℃ 2 min;95 ℃ 10 s、55 ℃ 10 s、72 ℃ 25 s,共40个循环。选定未处理组细胞样品作为对照,经内参GAPDH均一化处理,用DeltaDelta CT Relative Quantitation进行相对定量分析。所用软件为Rotor-Gene Real-Time Analysis Software 6.1。
1.2.5蛋白免疫印迹法蛋白样品制备参见文献[9]。样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离,转移至硝酸纤维素膜,5% 脱脂奶粉封闭1 h;膜与HCV NS3鼠单抗(1∶1 000)、HCV E2鼠单抗(1∶500)或β-actin抗体(1∶1 000)于4 ℃过夜,与1∶1 000稀释的HRP-羊抗兔或抗鼠抗体于室温孵育1 h。ECL试剂显影,并用GeneGnome HR image capture获取图像。所用软件为GeneTools from SynGene。
1.3 统计学分析
采用t检验进行分析,P<0.05为有显著性差异。
2 结果
2.1 不同剂量IFN-α对HCV RNA水平的影响
首先评估IFN-α对HCVcc在Huh7.5.1细胞内复制的影响。将HCVcc感染的Huh7.5.1细胞用含不同浓度IFN-α(0、100、200、400、800、1 000 u/ml)的培养液培养72 h,并抽提细胞RNA;然后采用实时PCR检测HCV RNA。图1表明,100 u/ml IFN-α可显著降低HCV RNA水平(P<0.05)。
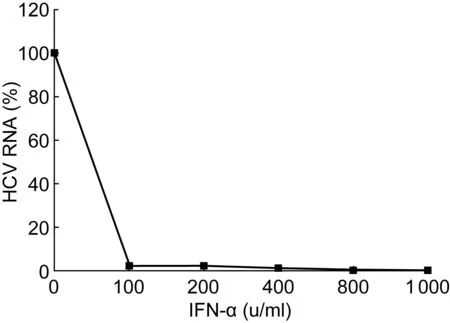
Huh7.5.1 cells infected with HCVcc were cultured in the media containing IFN-α at the indicated doses. Real-time PCR was performed on the extracted RNA. HCV RNA levels are shown as relative percentages of the IFN-α-untreated control. The data are expressed as the mean value and the standard deviation of triplicate experiments.
2.2 利巴韦林和IFN-α对HCV RNA水平及蛋白表达的影响
将HCVcc感染的Huh7.5.1细胞用含不同浓度利巴韦林(0、1、20、100 μg/ml)的培养液培养96 h,采用实时PCR检测细胞RNA 中HCV RNA水平。图2A显示,利巴韦林剂量依赖性抑制HCV复制,1 μg/ml利巴韦林可显著降低HCV RNA水平(P<0.05);且100 u/ml IFN-α联合利巴韦林对HCV的复制具有协同抑制作用,表现为HCV RNA水平显著降低(P<0.05)。进一步采用蛋白免疫印迹法检测HCV蛋白在上述处理条件下的表达情况。结果显示,HCV NS3和E2在HCVcc感染的Huh7.5.1 细胞中均表达,而在未感染细胞中无表达;利巴韦林对NS3和E2表达的抑制亦呈剂量依赖性,100 μg/ml利巴韦林或其与100 u/ml IFN-α联合应用可完全抑制NS3和E2表达(图2B)。

A: Huh7.5.1 cells infected with HCVcc were cultured in the media containing various doses of ribavirin or in combination with 100 u/ml IFN-α. Real-time PCR was performed on the extracted RNA. HCV RNA levels are shown as relative percentages of the HCVcc-untreated control. The data are expressed as the mean value and the standard deviation of triplicate experiments. *P<0.05 compared with the untreated control. B: Western blot analysis of HCV NS3 and E2 protein expressions was carried out on protein extracts from the Huh7.5.1 cells treated with ribavirin or IFN-α. β-actin is shown as a loading control. One representative experiment out of two is shown.
2.3 不同剂量IFN-α诱导IRF9和ISG15水平的比较
将检测IRF9和ISG15水平作为衡量IFN诱生抗病毒基因能力的指标。HCVcc感染的Huh7.5.1细胞用含低剂量IFN-α的培养液培养72 h后,抽提细胞RNA。实时PCR检测结果显示,在HCVcc感染的Huh7.5.1细胞,5~80 u/ml IFN-α可剂量依赖性诱生IRF9(图3A)。与IRF9相似,ISG15也被5~80 u/ml IFN-α剂量依赖性促进诱生,且ISG15水平增加明显高于IRF9(图3B)。有趣的是,100 u/ml IFN-α却导致IRF9和ISG15水平开始降低。
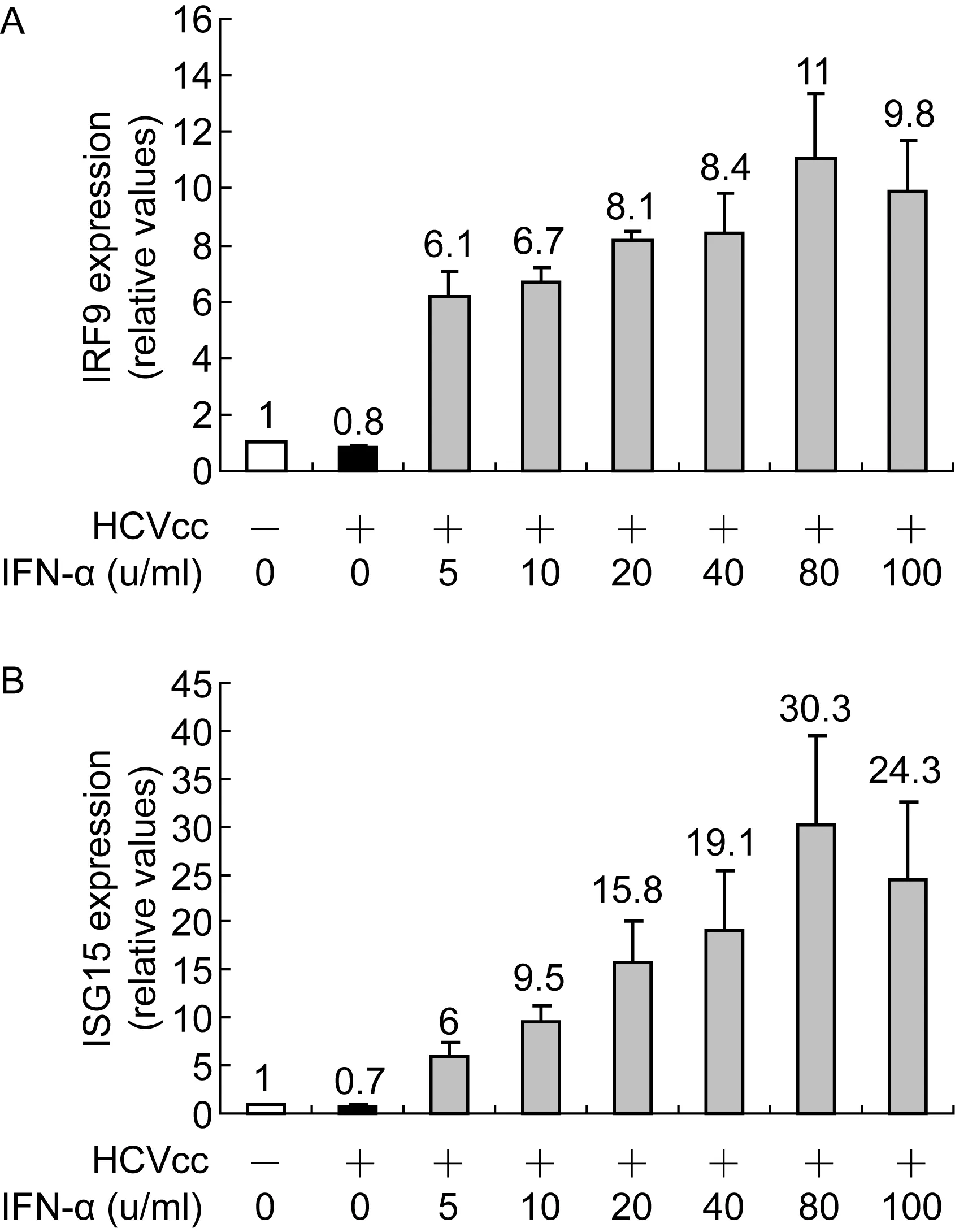
Huh7.5.1 cells infected with HCVcc were cultured in the media containing various doses of IFN-α. Real-time PCR was performed on the extracted RNA. mRNA levels of IRF9 (A) and ISG15 (B) after 72 h treatment with IFN-α in cells with and without HCVcc infection were detected. The data are expressed as the mean value and the standard deviation of triplicate experiments.
2.4 不同剂量利巴韦林联合IFN-α诱导IRF9和ISG15水平的比较
继续研究利巴韦林单独及联合IFN-α对IRF9和ISG15的影响。结果如图4所示,在HCVcc感染的Huh7.5.1细胞,用1和5 μg/ml利巴韦林孵育96 h并不促进IRF9和ISG15水平升高;用20 u/ml IFN-α孵育则明显促进IRF9和ISG15水平升高;而利巴韦林联合IFN-α对IRF9和ISG15诱生无促进作用。

Huh7.5.1 cells infected with HCVcc were cultured in the media containing various doses of ribavirin and IFN-α. Real-time PCR was performed on the extracted RNA. mRNA levels of IRF9 (A) and ISG15 (B) after 96 h treatment with ribavirin in cells with and without HCVcc infection were detected. The data are expressed as the mean value and the standard deviation of triplicate experiments.
3 讨论
目前,主要采用IFN联合利巴韦林治疗HCV感染。慢性HCV感染患者对该方案的持续病毒应答率平均为47%~54%,其中HCV基因1型约为40%,而基因2型为85%~90%,表现出较好的临床效应[10,11]。为进一步比较IFN-α和利巴韦林的抗病毒效应,本研究采用可模拟病毒天然感染的体外培养HCVcc为研究对象,探讨IFN-α、利巴韦林单独或联合应用对HCV RNA水平、蛋白表达及抗病毒基因的影响。实验结果表明,IFN-α和利巴韦林剂量依赖性抑制HCV复制,且IFN-α联合利巴韦林对HCV RNA水平及HCV NS3和E2蛋白表达具有协同抑制作用。此外,IFN-α可诱生IRF9和ISG15,而利巴韦林并不提高两者的水平。
IFN联合利巴韦林治疗HCV感染表现出较强的抗病毒效应,阐明两者的抗病毒分子机制对提高疗效具有重要意义。Rice等利用含全长HCV 1b复制子的细胞作为实验材料,比较IFN-α和IFN-λ对HCV复制的影响。结果发现,两者剂量依赖性抑制HCV复制[12]。有临床资料表明,对于感染HCV基因1型的患者,利巴韦林剂量为1 000 mg/d(体重≤75 kg)或1 200 mg/d(体重>75 kg);对于感染其他基因型的绝大多数患者,利巴韦林剂量为800 mg/d即可维持满意的持续病毒应答率[13]。本实验则进一步研究IFN-α和(或)利巴韦林对感染性病毒HCVcc复制的影响。结果显示,100 u/ml IFN-α可显著降低HCV RNA水平。利巴韦林不仅剂量依赖性降低HCV RNA水平,还对NS3和E2蛋白的表达呈剂量依赖性抑制。此外,IFN-α联合利巴韦林对HCV RNA水平和蛋白表达均有协同抑制作用。本实验结果不仅与相关报道一致,还深入探讨了IFN-α、利巴韦林体外抗病毒作用的量-效关系。
IFN-α通过诱导一系列具有抗病毒作用的效应蛋白表达,在细胞内建立抗病毒状态,抑制病毒复制,从而发挥抗病毒效应[14]。因此,了解抗病毒基因在IFN治疗前后的变化,有助于从分子水平阐明IFN治疗HCV的机制。IFN-α持续作用时间与某些相关基因之间的关系也令人感兴趣。聚乙二醇IFN-α治疗前后慢性丙型肝炎患者肝脏切片的研究表明,对IFN-α治疗敏感的患者,IFN-α诱导ISG表达强烈上调;对其无效的患者,治疗前ISG已高水平表达,IFN-α处理并不能使其表达进一步增高[15]。本研究选择IRF9和ISG15作为评价IFN-α抗病毒效应的指标。结果显示,在HCVcc感染的Huh7.5.1细胞中,IFN-α在一定范围内剂量依赖性促进IRF9和ISG15 mRNA水平升高,且ISG15水平上升高于IRF9;而低剂量利巴韦林并不促进两者mRNA水平上升。此结果与最近的一篇报道一致[16],但对IRF9和ISG15蛋白表达水平的影响仍有待研究。此外,100 u/ml IFN-α导致IRF9和ISG15水平开始降低的机制尚需进一步探讨。在前期实验中,我们发现1和5 μg/ml利巴韦林联合20 u/ml IFN-α对HCVcc复制具有协同抑制作用。本文在两者协同抑制HCVcc复制的基础上,继续研究低剂量利巴韦林和IFN-α对ISG表达的影响(图4)。结果表明,利巴韦林联合IFN-α对IRF9和ISG15诱生无促进作用。因此,IFN-α联合利巴韦林对HCV复制具有协同抑制作用,但两者具有不同调节抗病毒基因表达的能力。
综上所述,本研究初步揭示了IFN-α、利巴韦林体外抗病毒作用的量-效关系及两者诱导抗病毒基因的差异。作为大多数病毒的通用策略,HCV干预IFN介导的信号转导,抑制其诱导的抗病毒效应,允许病毒逃逸宿主免疫应答,从而建立感染。HCV可能拥有数种机制以拮抗IFN或利巴韦林的抗病毒效应。HCV与抗病毒药物相互作用的过程涉及多种病毒、宿主、信号分子和抗病毒基因产物的综合作用,深入理解HCV与抗病毒药物相互作用的分子机制将提高以IFN为基础治疗方案的疗效,形成新的治疗措施。
[1] Rehermann B, Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection [J]. Nature, 2005, 5 (3):215-229.
[2] Capobianchi MR, Abbate I, Cappiello G, Solmone M. HCV and interferon: viral strategies for evading innate defence mechanisms in the virus-host battle [J]. Cell Death Differ, 2003, 10(Suppl 1): S22-S24.
[3] Darnell JE Jr, Kerr IM, Stark GR. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins [J]. Science, 1994, 264 (5164):1415-1421.
[4] Stark GR, Kerr IM, Williams BR, Silverman RH, Schreiber RD. How cells respond to interferons [J]. Annu Rev Biochem, 1998, 67: 227-264.
[5] Kato T, Furusaka A, Miyamoto M, Date T, Yasui K, Hiramoto J,Nagayama K, Tanaka T, Wakita T. Sequence analysis of hepatitis C virus isolated from a fulminant hepatitis patient [J]. J Med Virol, 2001, 64 (3):334-339.
[6] Date T, Kato T, Miyamoto M, Zhao Z, Yasui K, Mizokami M, Wakita T. Genotype 2a hepatitis C virus subgenomic replicon can replicate in HepG2 and IMY-N9 cells [J]. J Biol Chem, 2004, 279 (21): 22371-22376.
[7] Kato T, Date T, Murayama A, Morikawa K, Akazawa D, Wakita T. Cell culture and infection system for hepatitis C virus [J]. Nat Protoc, 2006, 1(5):2334-2339.
[8] Tong Y, Zhu Y, Xia X, Liu Y, Feng Y, Hua X, Chen Z, Ding H, Gao L, Wang Y, Feitelson MA, Zhao P, Qi ZT. Tupaia CD81, SR-BI, claudin-1, and occludin support hepatitis C virus infection [J]. J Virol, 2011, 85 (6):2793-2802.
[9] Zhao LJ, Hua X, He SF, Ren H, Qi ZT. Interferon alpha regulates MAPK and STAT1 pathways in human hepatoma cells [J]. Virol J, 2011, 8:157.
[10] Younossi ZM, Baranova A, Afendy A, Collantes R, Stepanova M, Manyam G, Bakshi A, Sigua CL, Chan JP, Iverson AA, Santini CD, Chang SYP. Early gene expression profiles of patients with chronic hepatitis C treated with pegylated interferon-alfa and ribavirin [J]. Hepatology, 2009, 49 (3):763-774.
[11] Gotto J, Dusheiko GM. Hepatitis C and treatment with pegylated interferon and ribavirin [J]. Int J Biochem Cell Biol, 2004, 36 (10):1874-1877.
[12] Marcello T, Grakoui A, Barba-Spaeth G, Machlin ES, Kotenko SV, MacDonald MR, Rice CM. Interferons alpha and lambda inhibit hepatitis C virus replication with distinct signal transduction and gene regulation kinetics [J]. Gastroenterology, 2006, 131 (6):1887-1898.
[13] Reddy KR, Nelson DR, Zeuzem S. Ribavirin: current role in the optimal clinical management of chronic hepatitis C [J]. J Hepatol, 2009, 50 (2):402-411.
[14] Gale M Jr, Foy EM. Evasion of intracellular host defence by hepatitis C virus [J]. Nature, 2005, 436 (7053): 939-945.
[15] Sarasin-Filipowicz M, Oakeley EJ, Duong FH, Christen V, Terracciano L, Filipowicz W, Heim MH. Interferon signaling and treatment outcome in chronic hepatitis C [J]. Proc Natl Acad Sci USA, 2008, 105 (19):7034-7039.
[16] Thomas E, Feld JJ, Li Q, Hu Z, Fried MW, Liang TJ. Ribavirin potentiates interferon action by augmenting interferon-stimulated gene induction in hepatitis C virus cell culture models [J]. Hepatology, 2011, 53 (1):32-41.

