Transwell技术模拟人类免疫缺陷病毒感染黏膜及其他屏障系统的应用
林光正,裘佳寅,刘叔文,李琳
1. 南方医科大学第一临床医学院,广州 510515; 2. 南方医科大学药学院,广州 510515
性传播是目前人类免疫缺陷病毒(human immunodeficiency virus,HIV)传播的最主要方式,而生殖道及直肠黏膜感染是HIV性传播的主要途径。生殖道及直肠黏膜是机体抵抗HIV感染的第1道屏障,此外尚有许多其他屏障系统可抵御HIV在机体内播散,如血-脑屏障及血-视网膜屏障等。但目前HIV感染黏膜及穿透机体自身屏障系统的具体机制尚不明确,HIV黏膜及屏障系统感染的模拟性实验研究也存在许多局限性。Transwell技术可在体外模拟HIV感染机体黏膜及生物屏障系统,使HIV感染机制的研究能深入展开,在某种程度上能解决上述难题,也为HIV黏膜保护疫苗和药物的研发寻找新的作用靶点。
1 Transwell技术概述
Transwell技术是目前细胞生物学中常用的实验方法之一,在生物医学研究领域有着极其广泛的应用。Transwell小室(Transwell insert)底部是一张具有通透性的膜,一般为聚碳酸酯膜(polycarbonate member),孔径为0.1~12.0 μm,该膜体系能满足细胞在膜内正常生长、繁殖(图1)。通常将Transwell小室放入细胞培养板中,小室内称上室(apical chamber),培养板内称下室(basolateral chamber)。应用不同孔径和不同处理的聚碳酸酯膜,可进行细胞共培养、细胞趋化、细胞迁移、细胞侵袭等多方面的研究。Transwell技术主要是根据不同实验需求模拟机体生物屏障,以简单、经济的手段模拟生物体内膜转运系统,在免疫学、药理学、药剂学等领域均发挥重要作用,尤其是在抗肿瘤研究中起非常重要的作用。目前,研究较多且相对较成熟的生物屏障模拟系统包括血-脑屏障、肠黏膜屏障、血-视网膜屏障、胎盘屏障和腹膜透析屏障等。
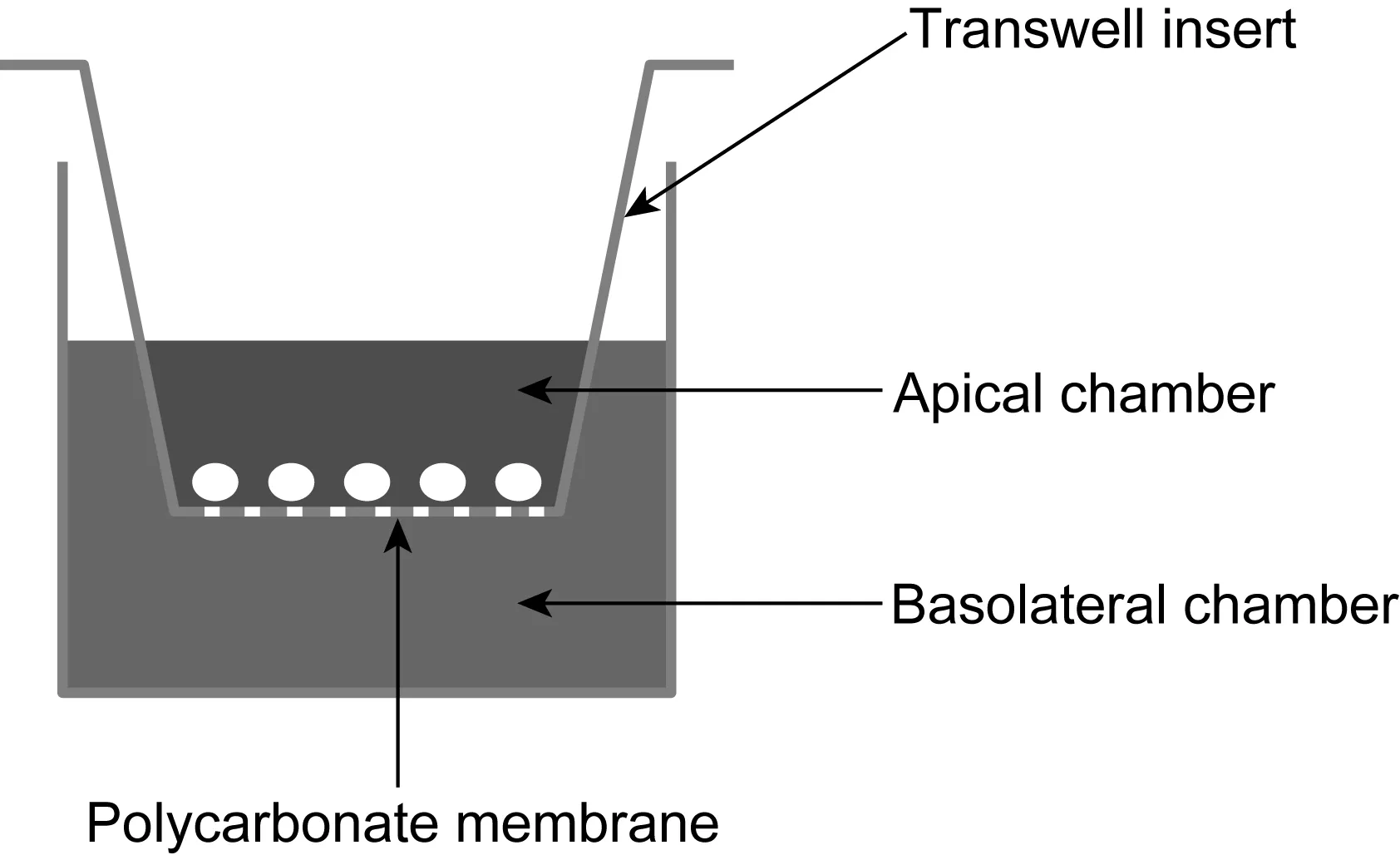
图1 Transwell小室示意图Fig.1 Transwell insert
2 Transwell技术模拟HIV黏膜感染模型的建立
目前,性传播已成为HIV传播的最主要途径。在性交过程中,HIV感染者体液中的病毒极易透过生殖器黏膜屏障或直肠屏障进入未感染的性伴侣体内,从而造成HIV在体内广泛传播。经生殖道黏膜和直肠黏膜感染HIV是目前HIV黏膜感染最主要的2种途径,90%以上HIV感染者均是通过黏膜感染病毒的[1]。有报道指出,HIV从生殖道部位入侵到宿主体内并导致机体系统感染的周期为3~4 d[2,3]。但HIV如何透过黏膜表面进而感染靶细胞?其中又有哪些细胞或因子参与到整个感染过程?很多问题尚待深入研究。因此,研究HIV黏膜感染的作用特点及机制至关重要。
灵长类动物模型无疑是最直观、有效的研究体系,其在组织结构、免疫和生理等方面均与人类高度相似,能系统、直观地再现HIV的类似病毒——猴免疫缺陷病毒(simian immunodeficiency virus, SIV)感染宿主的全过程,为临床研究提供了很大的参考价值。但其价格昂贵,进行深入的基础性研究存在困难;且SIV与HIV存在明显差别,宿主不会出现获得性免疫缺陷综合征(acquired immunodeficiency syndrom,AIDS),不能完全模拟临床HIV感染患者的情况,也不适合用来研究发病机制和评价抗病毒药物和疫苗。此外,不同地域的灵长类动物,如非洲猴及亚洲猴,感染不同的免疫缺陷病毒株后,其免疫反应、临床症状和发病情况都存在较大差异,实验室之间无法将结果进行比较,重现性较低。
采用Transwell技术建立人生殖道黏膜、直肠组织黏膜和细胞模型,体外模拟HIV在生物体内的黏膜感染过程,是目前HIV黏膜感染研究的热点之一。该模型具有成本低、简单、易于操作和重现性强等特点,能较为客观地反映病毒透过黏膜组织或细胞进而感染机体的过程,更容易观察特定区域内细胞及相关因子在HIV感染前后的变化,从而客观分析HIV感染机制的研究,是促进HIV感染机制研究较为有效的手段之一。但是该模型也存在一定的缺点,如黏膜组织和黏膜细胞均属于离体状态,不能完全再现机体病毒感染的复杂全过程。研究表明,Transwell模型在模拟女性生殖道黏膜感染中存在缺陷,因为该模型中HIV可能通过其他方式透过上皮细胞,对其严谨性提出质疑[4,5]。虽然Transwell技术在组织及细胞模型中的应用仍存在一定的缺陷和争议,但不可否认其对HIV作用机制的深入研究可提供帮助。
目前,采用Transwell技术模拟生殖道黏膜及其他屏障系统主要有以下几种方式。Collins等[6]将人宫颈复层鳞状上皮组织黏膜置入上室滤膜,采用琼脂糖凝胶灌注封闭,并留空中心1圈,将病毒与未封闭的黏膜表面接触来研究其与黏膜组织的相互作用。Shen等[7]则将黏膜组织置入上室,在黏膜面上放置聚丙烯小桶,以外科手术用凝胶将小桶四周封闭。常用细胞模型主要选用原代培养细胞或可永生化传代的细胞系。如Nazli等[8]利用女性生殖道原代上皮细胞和T84肠道细胞系,建立了生殖道黏膜及肠黏膜Transwell模型,研究了HIV-1对黏膜屏障的损伤作用。Bai等[9]选用人D407视网膜色素上皮细胞系建立血-视网膜屏障模型,研究HIV-1 Tat蛋白对HIV感染黏膜细胞的影响。这些Transwell模型具有各自的优缺点,都有一定的应用,但均需进一步完善。
3 Transwell技术在研究HIV黏膜感染中的应用
宿主黏膜基底层中存在大量表面带有CD4受体的淋巴细胞和巨噬细胞,这些正是HIV作用的靶细胞。有研究表明[10,11],HIV黏膜感染主要通过黏膜上皮层中的朗格汉斯细胞(Langerhans cell, LC)、树突细胞(dendritic cell, DC)及M细胞(microfold cell)等,经跨膜转运方式将病毒转运至基底层的HIV靶细胞。以上研究大多是在动物模型中进行的。Hanley等[12]从血液中分离出DC和T细胞,并对核受体家族中的过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor, PPARγ)和肝X受体(liver X receptor,LXR)在HIV传播中的活性作用进行验证。结果发现,能激活PPARγ和LXR的药物可抑制DC捕捉HIV及将HIV传递给T细胞的能力。因此,Transwell技术对深入研究HIV经黏膜转运进入机体靶细胞的机制有较大的应用价值。
3.1 生殖道及直肠黏膜上皮细胞
性传播主要包括异性性传播及同性性传播。异性性传播感染的途径主要是透过生殖道黏膜屏障,包括子宫颈及阴道黏膜屏障。而透过直肠黏膜屏障是同性性传播感染的最主要方式。Nazli等[8]用女性生殖道原代上皮细胞和T84肠道细胞系建立生殖道黏膜及肠黏膜的Transwell模型,研究HIV-1破坏黏膜功能的机制。结果发现,黏膜暴露于HIV颗粒24 h后,Transwell模型的膜跨上皮电阻(transepithelial resistance, TER)降低了30%~60%,生殖道及肠黏膜屏障的通透性增加。进一步研究表明,肠黏膜上皮直接应答于HIV-1包膜糖蛋白,上调炎性细胞因子表达而使屏障功能受损。这一机制可能对研究HIV-1黏膜传播和免疫激活有帮助。
3.2 滤泡树突细胞
滤泡树突细胞(follicular dendritic cell, FDC)存在于二级淋巴组织的生发中心[13],与T细胞和B细胞紧密接触,对免疫记忆的维持,B细胞的分化、成熟及记忆B细胞的形成均具有极其重要的作用[14,15]。研究发现[16],FDC细胞是HIV感染的第1道防线。机体感染HIV后,FDC通过细胞表面的DC特异性细胞间黏附分子3结合非整合素因子(dendritic cell-specific intercellular adhesion molecule-3-grabbing nonintegrin,DC-SIGN)吸附大量病毒颗粒,但其本身不被HIV感染,即使在高浓度中和抗体存在下,其吸附的HIV-抗体免疫复合物依然具有很高的感染性[17-20]。另有研究表明,FDC可捕捉HIV,藏于胞内,且在不复制的情况下长期保持活性,条件适宜时病毒又可大量复制[21]。
目前,采用Transwell技术研究FDC对HIV的作用也是研究热点。姜拥军等[22]将1×106个淋巴细胞置于Transwell上室,将2×106个FDC置于下室,进行趋化实验。结果表明,FDC对淋巴细胞有明显的趋化作用。该实验还同时评估了FDC对HIV结合及进入淋巴细胞的影响。结果表明,FDC可增强HIV在淋巴细胞内的感染[23,24],可能原因是其能促进HIV复制。另有研究表明,FDC可延长HIV的体外存活时间[25]。
3.3 T细胞
HIV经黏膜上皮细胞转运到达黏膜下层后,需与靶细胞(即T细胞)特异性结合,进而进入宿主体内。白细胞介素7(interleukin 7,IL-7)是维持外周成熟T细胞稳态的重要调节因子,在病毒感染后的免疫应答及病毒特异性CD4+和CD8+记忆性T细胞库的产生及维持过程中发挥重要作用[26]。对IL-7的特异性应答主要通过CD127表达调控,Vranjkovic等[27]将感染HIV的外周血单核细胞(peripheral blood mononuclear cell,PBMC)在Transwell小室中培养,之后将CD8+T细胞暴露于Transwell小室中,结果CD8+T细胞表面CD127表达下降。Lang等则发现,HIV感染的CD4+T细胞分泌Tat蛋白,通过旁分泌可特异性下调CD127在各型CD8+T细胞中的表达,且这种下调作用是可逆的。效应性CD8+T细胞表面CD127表达下调可促进效应性CD8+T细胞凋亡,记忆性CD8+T细胞耗尽,导致病毒持续感染[28]。此外,HIV还可对CD4+T细胞表面的CD127表达产生影响。最近研究表明,在HIV感染早期,由于免疫系统活化水平提高及CD4+T细胞凋亡增加,CD4+T细胞表面CD127表达水平降低[29]。CD127在CD4+T细胞表达缺失引起的细胞凋亡及CD127记忆性CD4+T细胞因感染HIV而死亡,是HIV感染中CD4+T细胞缺失的重要原因之一[30]。探究CD127与HIV的关系,为HIV的防治提供了新途径。
4 Transwell技术在HIV穿透机体其他屏障系统中的应用
4.1 血-脑屏障
血-脑屏障是维持脑内环境稳定和避免有害物质入侵的必需结构,是机体参与天然免疫的内部屏障之一,可保护大脑不被血液中的微生物和毒素伤害[31]。研究表明,20%的AIDS患者感染HIV-1后,HIV-1包膜蛋白gp120可改变血-脑屏障的完整性[32],病毒会透过血-脑屏障进入大脑,在脑内繁殖并破坏大脑组织,从而产生HIV痴呆症或其他认知障碍。对HIV穿透血-脑屏障导致功能障碍的机制,目前尚无定论。建立体外血-脑屏障模型对该问题的解决具有重要意义。
Chaudhuri等[33]将感染HIV-1的单核-巨噬细胞和脑微血管内皮细胞在Transwell小室中共培养,观察HIV基因变化。结果发现,HIV-1损坏血-脑屏障的机制与脑微血管内皮细胞中的炎症、细胞因子及干扰素信号有关。Eugenin等[34]研究表明,少数感染HIV的星状胶质细胞在中枢神经损伤中起重要作用,该毒性机制对研究中枢神经损伤和控制HIV导致的认知障碍有较大贡献。另有研究发现,来源于肠道细菌细胞壁的化学成分脂多糖(lipopolysaccharide, LPS)可协助HIV透过血-脑屏障进入大脑,而HIV感染者血液中LPS含量极高。此外,CD40和CD40配体在HIV透过血-脑屏障过程中也有促进作用[35],该研究成果为防御HIV侵入大脑提供了实验依据。
4.2 血-视网膜屏障
HIV-1 Tat蛋白是HIV基因组编码的重要调控蛋白之一,为HIV转录和复制所必需;且其中蛋白转导结构域(protein transduction domain,PTD)具有信号肽作用,能有效引导多肽片段或蛋白进入细胞,具有蛋白传送功能,是目前生物制品中加在蛋白或多肽前促进多肽跨膜转运的主要序列之一。Bai等[9]选用人D407视网膜色素上皮细胞系建立血-视网膜屏障Transwell模型,用以研究HIV-1 Tat蛋白对其的影响。结果显示,HIV-1 Tat蛋白能显著提高视网膜色素上皮细胞膜的通透性,改变某些与致密连接相关蛋白的表达,这一效应可能与某些炎症因子的激活有关。2011年,李太生等研究发现[36],长期接受抗HIV药物治疗的AIDS患者虽然血液中病毒检测已呈阴性,但其泪液中仍有较高病毒载量,泪腺、泪液及相关组织和器官很可能是HIV的新“据点”,这也为HIV与血-视网膜屏障的相互作用提供了新的研究方向。
5 结语
随着全球HIV/AIDS感染人群持续增长,对HIV感染的防治日益引起人们的重视。目前,性传播尤其是异性间无保护的性传播已成为HIV传播的最主要方式。人体自身存在着一些生理屏障系统,能天然抵抗外来病毒的入侵,如人生殖道及直肠黏膜,这些屏障系统的存在也大大降低了HIV及其他性传播疾病病原体的感染性。据报道,天然黏膜屏障系统损伤或炎症感染患者中,HIV感染率很高。迄今为止,科学家一直致力研究HIV黏膜感染及病毒穿透机体屏障系统的具体机制,但尚未阐释清楚。HIV直接感染人黏膜及其他屏障系统的相关研究很难操作,其模拟性实验也存在很多问题。理论上,预防HIV感染的最好手段是开发成功的HIV疫苗。在目前缺乏有效疫苗且研发成功的疫苗尚需很长一段时间的情况下,开发能有效抑制HIV传播的杀微生物制剂也是有效途径之一,但灵长类动物模型的缺陷部分限制了疫苗及药物的研发。采用Transwell技术在一定程度上为解决这些难题提供了一种方案,可在体外模拟HIV感染机体的黏膜及屏障系统,从而使HIV感染机制及疫苗和抗病毒药物的研究能深入展开。目前Transwell技术也的确推进了HIV感染机制的研究,如HIV-1对黏膜屏障的损伤作用、FDC对HIV复制的促进作用等。此外,研究人员还发现,阴道而非肠道巨噬细胞允许HIV复制[37]和包皮环切术能降低HIV感染率[38]等,这些均是Transwell技术研究成果的体现,为深入研究HIV感染机制、HIV黏膜保护疫苗的开发以及新药物作用靶点的寻找和确认提供了良好的技术平台。
[1] UNAIDS. 2010 Report on the global AIDS epidemic [R]. http://www.unaids.org/ globalreport/Global_report.htm.
[2] Miller CJ, Li Q, Abel K, Kim EY, Ma ZM, Wietgrefe S, La Franco-Scheuch L, Compton L, Duan L, Shore MD, Zupancic M, Busch M, Carlis J, Wolinsky S, Haase AT. Propagation and dissemination of infection after vaginal transmission of simian immunodeficiency virus [J]. J Virol, 2005, 79(14): 9217-9227.
[3] 杨瑜, 张晓燕. 人体黏膜活组织模型在HIV-1性传播途径感染中的应用[J]. 生物工程学报, 2011, 27(2): 172-179.
[4] Shattock RJ, Griffin GE, Gorodeski GI. In vitro models of mucosal HIV transmission [J]. Nat Med, 2000, 6(6): 607-608.
[5] Gupta P, Collins K, Patterson B, Naus G, Landers D. Reply to ‘In vitro models of mucosal HIV transmission’ [J]. Nat Med, 2000, 6(6): 607-608.
[6] Collins KB, Patterson BK, Naus GJ, Landers DV, Gupta P. Development of an in vitro organ culture model to study transmission of HIV-1 in the female genital tract [J]. Nat Med, 2000, 6(4):475-479.
[7] Shen R, Drelichman ER, Bimczok D, Ochsenbauer C, Kappes JC, Cannon JA, Tudor D, Bomsel M, Smythies LE, Smith PD. GP41-specific antibody blocks cell-free HIV type 1 transcytosis through human rectal mucosa and model colonic epithelium [J]. J Immunol, 2010, 184(7): 3648-3655.
[8] Nazli A, Chan O, Dobson-Belaire WN, Ouellet M, Tremblay MJ, Gray-Owen SD, Arsenault AL,Kaushic C. Exposure to HIV-1 directly impairs mucosal epithelial barrier integrity allowing microbial translocation [J]. PLoS Pathog, 2010, 6(4): e1000852.
[9] Bai L, Zhang Z, Zhang H, Li X, Yu Q, Lin H, Yang W. HIV-1 Tat protein alter the tight junction integrity and function of retinal pigment epithelium: an in vitro study [J]. BMC Infect Dis, 2008, 8: 77.
[10] Sivard P, Berlier W, Picard B, Sabido O, Genin C, Misery L. HIV-1 infection of Langerhans cells in a reconstructed vaginal mucosa [J]. J Infect Dis, 2004, 190(2): 227-235.
[11] Amerongen HM, Weltzin R, Farnet CM, Michetti P, Haseltine WA, Neutra MR. Transepithelial transport of HIV-1 by intestinal M cells: a mechanism for transmission of AIDS [J]. J Acquir Immune Defic Syndr, 1991, 4(8): 760-765.
[12] Hanley TM, Blay Puryear W, Gummuluru S, Viglianti GA. PPARgamma and LXR signaling inhibit dendritic cell-mediated HIV-1 capture and trans-infection [J]. PLoS Pathog, 2010, 6: e1000981.
[14] Sukumar S, Conrad DH, Szakal AK, Tew JG. Differential T cell-mediated regulation of CD23 (Fc epsilonRII) in B cells and follicular dendritic cells [J]. J Immunol, 2006, 176(8): 4811-4817.
[15] El Shikh ME, El Sayed R, Szakal AK, Tew JG.Follicular dendritic cell (FDC)-FcgammaRIIB engagement via immune complexes induces the activated FDC phenotype associated with secondary follicle development [J]. Eur J Immunol, 2006, 36(10): 2715-2724.
[16] Lekkerkerker AN, van Kooyk Y, Geijtenbeek TB. Viral piracy: HIV-1 targets dendritic cells for transmission [J]. Curr HIV Res, 2006, 4(2): 169-176.
[17] Tew JG, Wu J, Fakher M, Szakal AK, Qin D. Follicular dendritic cells: beyond the necessity of T-cell help [J]. Trends Immunol, 2001, 22(7): 361-367.
[18] Mellman I, Steinman RM. Dendritic cells: specialized and regulated antigen processing machines [J]. Cell, 2001, 106(3): 255-258.
[19] Smith-Franklin BA, Keele BF, Tew JG, Gartner S, Szakal AK, Estes JD, Thacker TC, Burton GF. Follicular dendritic cells and the persistence of HIV infectivity: the role of antibodies and Fcgamma receptors [J]. J Immunol, 2002, 168(5): 2408-2414.
[20] Schacker T, Little S, Connick E, Gebhard-Mitchell K, Zhang ZQ, Krieger J, Pryor J, Havlir D, Wong JK, Richman D, Corey L, Haase AT. Rapid accumulation of human immunodeficiency virus (HIV) in lymphatic tissue reservoirs during acute and early HIV infection: implications for timing of antiretroviral therapy [J]. J Infect Dis, 2000, 181(1): 354-357.
[21] Burton GF, Masuda A, Heath SL, Smith BA, Tew JG, Szakal AK. Follicular dendritic cells (FDC) in retroviral infection: host/pathogen perspectives [J]. Immunol Rev, 1997, 156:185-197.
[22] 潘莹, 陈欢, 崔华露, 姜拥军. 滤泡树突状细胞增强HIV感染机制的体外研究[J]. 中国医科大学学报, 2007, 36(4): 377-379.
[23] 姜拥军,尚红,王亚男. 人类滤泡树突状细胞增强HIV的感染[J]. 中国免疫学杂志, 2001, 17(8): 438-441.
[24] Taruishi M, Terashima K, Dewan Z, Yamamoto N, Ikeda S, Kobayashi D, Eishi Y, Yamazaki M, Furusaka T, Sugimoto M, Ishii M, Kitamura K, Yamamoto N. Role of follicular dendritic cells in the early HIV-1 infection: in vitro model without specific antibody [J]. Microbiol Immunol, 2004, 48(9): 693-702.
[25] Smith BA, Gartner S, Liu Y, Perelson AS, Stilianakis NI, Keele BF, Kerkering TM, Ferreira-Gonzalez A, Szakal AK, Tew JG, Burton GF. Persistence of infectious HIV on follicular dendritic cells [J]. J Immunol, 2001, 166(1): 690-696.
[26] Kondrack RM, Harbertson J, Tan JT, Mcbreen ME, Surh CD, Bradley LM. Interleukin 7 regulates the survival and generation of memory CD4 cells [J]. J Exp Med, 2003, 198(12): 1797-1806.
[27] Vranjkovic A, Crawley AM, Angel JB. In vitro HIV type 1 infection indirectly alters CD127 expression on CD8+T cells [J]. AIDS Res Hum Retroviruses, 2012, 28(3):295-298.
[28] Lang KS, Recher M, Navarini AA, Harris NL, Löhning M, Junt T, Probst HC, Hengartner H, Zinkernagel RM. Inverse correlation between IL-7 receptor expression and CD8 T cell exhaustion during persistent antigen stimulation [J]. Eur J Immunol, 2005, 35(3): 738-745.
[29] Koesters SA, Alimonti JB, Wachihi C, Matu L, Anzala O, Kimani J, Embree JE, Plummer FA, Fowke KR. IL-7-Ralpha expression on CD4+T lymphocytes decreases with HIV disease progression and inversely correlates with immune activation [J]. Eur J Immunol, 2006, 36(2): 336-344.
[30] Zaunders JJ, Ip S, Munier ML, Kaufmann DE, Suzuki K, Brereton C, Sasson SC, Seddiki N, Koelsch K, Landay A, Grey P, Finlayson R, Kaldor J, Rosenberg ES, Walker BD, Fazekas de St Groth B, Cooper DA, Kelleher AD. Infection of CD127+(interleukin-7 receptor+) CD4+cells and overexpression of CTLA-4 are linked to loss of antigen-specific CD4 T cells during primary human immunodeficiency virus type 1 infection [J]. J Virol, 2006, 80(20): 10162-10172.
[31] Kim KS. Microbial translocation of the blood-brain barrier [J]. Int J Parasitol, 2006, 36(5): 607-614.
[32] Louboutin JP, Agrawal L, Reyes BA, Van Bockstaele EJ, Strayer DS. HIV-1 gp120-induced injury to the blood-brain barrier: role of metalloproteinases 2 and 9 and relationship to oxidative stress [J]. J Neuropathol Exp Neurol ,2010, 69(8): 801-816.
[33] Chaudhuri A, Duan F, Morsey B, Persidsky Y, Kanmogne GD. HIV-1 activates proinflammatory and interferon-inducible genes in human brain microvascular endothelial cells: putative mechanisms of blood-brain barrier dysfunction [J]. J Cereb Blood Flow Metab, 2008, 28(4): 697-711.
[34] Eugenin EA, Clements JE, Zink MC, Berman JW. Human immunodeficiency virus infection of human astrocytes disrupts blood-brain barrier integrity by a gap junction-dependent mechanism [J]. J Neurosci, 2011, 31(26): 9456-9465.
[35] Ramirez SH, Fan S, Dykstra H, Reichenbach N, Del Valle L, Potula R, Phipps RP, Maggirwar SB, Persidsky Y. Dyad of CD40/CD40 ligand fosters neuroinflammation at the blood-brain barrier and is regulated via JNK signaling: implications for HIV-1 encephalitis [J]. J Neurosci, 2010, 30(28): 9454-9464.
[36] Han Y, Wu N, Zhu W, Li Y, Zuo L, Ye J, Qiu Z, Xie J, Li T. Detection of HIV-1 viruses in tears of patients even under long-term HAART [J]. AIDS, 2011, 25(15): 1925-1927.
[37] Shen R, Richter HE, Clements RH, Novak L, Huff K, Bimczok D, Sankaran-Walters S, Dandekar S, Clapham PR, Smythies LE, Smith PD. Macrophages in vaginal but not intestinal mucosa are monocyte-like and permissive to human immunodeficiency virus type 1 infection [J]. J Virol, 2009, 83(7): 3258-3267.
[38] Bailey RC, Moses S, Parker CB, Agot K, Maclean I, Krieger JN, Williams CF, Campbell RT, Ndinya-Achola JO. Male circumcision for HIV prevention in young men in Kisumu, Kenya: a randomised controlled trial [J]. Lancet, 2007, 369(9562): 643-656.

