新肠道病毒71型病毒样颗粒的制备
李晓楠 曹明慧 李培锋 (辽宁省动物疫病预防控制中心,沈阳110164)
近年来,手足口病(Hand,foot and mouth disease,HFMD)的暴发在亚洲呈上升趋势[1],我国手足口病也呈局部暴发趋势,2008年5月2日,中国卫生部将该病列为丙类传染病。HFMD是由肠道病毒感染引起的一种病毒性疾病,临床表现为口腔黏膜、手和足等多部位疱疹,可引起心肌炎、肺水肿和无菌性脑膜炎等神经系统并发症,潜伏期2~7天,患者主要为学龄前儿童,尤以≤3岁年龄组发病率最高[2]。引起HFMD 的肠道病毒有 20 多种[3],主要为小 RNA 病毒属的柯萨奇 A 组的 4、5、7、9、10、16型,柯萨奇B组的2、3、5型,埃可病毒的某些血清型[4]以及新肠道病毒,其中最常见的病原体为新肠道病毒71型(Enterovirus 71,EV71)和柯萨奇 A16型(Coxsackie A16,CA16)[5],感染 CA16 引起的临床症状较温和,而感染EV71常引起中枢神经系统疾病[6,7],严重时可造成感染者死亡,这给公共卫生安全造成严重的威胁。
现阶段疫苗仍是防控EV71病毒传播的最有效手段,VLPs疫苗是体外表达病毒的若干结构蛋白自动组装成形态结构上类似于真正病毒的空心颗粒状物质,具有不含病毒核酸,不具有致病性,抗原表位全面等优点,同时其与病毒感染途径相同并可呈递给免疫细胞,可诱导机体的免疫系统产生有效免疫保护应答。因此,探索利用昆虫细胞偏爱密码子、Bac-to-Bac表达系统和蔗糖密度梯度离心等方法制备和纯化EV71 VLPs,具有显著的应用价值,可为EV71手足口疫苗的研究制备提供有力参考。
1 材料与方法
1.1 主要试剂及质粒 限制性内切酶购自宝生物工程(大连)有限公司;EV71 VP1鼠抗单克隆抗体购自艾美捷科技有限公司;辣根过氧化物酶标记IgG购自北京鼎国生物技术公司;Wave波浪反应器购自Gerneral Electric公司;CellfectionⓇReagent脂质体转染试剂盒、Sf900Ⅲ昆虫细胞培养基和pFast-Bac Dual穿梭质粒购自Invitrogen公司;荧光标记羊抗鼠IgG二抗由本实验室保存。
1.2 细胞 Sf9昆虫细胞系购自Invitrogen公司。
1.3 EV71 P1-3CD Bacmid质粒的构建
1.3.1 引物设计与合成 依据昆虫细胞偏爱密码子优化并合成 EV71 P1和EV71 3CD,利用 DNAMAN软件设计基因引物,并由Invitrogen公司合成,扩增P1和3CD基因的上下游引物如下:P1上游引物:5'-ATAGCGCGCATGGATCCCAGGTGTCCACTCAG-3'酶切位点:BssHⅡ;P1下游引物:5'-CGCAAGCTTTTACAGAGTAGTGATAGCAGTTCT-3'酶切位点:HindⅢ。3CD上游引物:5'-ACGCTCGA GGGACCTTCCCTGGACTTCGCT-3'酶切位点:XhoⅠ;3CD 下游引物:5'-ACGGCATGCCTAGGACCTTCCCTGGACTTCGCT-3'酶切位点:SphⅠ。
1.3.2 EV71 P1-3CD Bacmid重组 将扩增的EV71 P1和3CD片段连接到FastBac Dual载体多角体蛋白启动子pPh和pP10上,构建重组pFastBac Dual EV71 P1-3CD质粒,进一步转化DH10 BacTME.coli感受态细胞,与Bacmid发生转座作用,培养72小时后,利用通用引物M13-M4/RV对所获得的EV71 P1-3CD Bacmid DNA重组质粒进行鉴定。
1.4 EV71 P1-3CD Bacmid DNA重组质粒的转染及鉴定
1.4.1 重组质粒EV71 P1-3CD Bacmid DNA转染昆虫细胞Sf9 按Bac-to-BacⓇBaculovirus Expression System CellfectionⓇReagent(Invitrogen)操作说明书,将EV71 P1-3CD Bacmid DNA重组质粒转染Sf9,72小时收集细胞上清,观察昆虫细胞Sf9病变。
1.4.2 重组EV71 P1-3CD杆状病毒DNA PCR鉴定应用TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.3.0试剂盒提取杆状病毒的DNA,利用P1和3CD基因的上下游引物扩增P1、3CD片段,并测序。1.4.3 间接免疫荧光检测(IFA) EV71 P1-3CD Bacmid DNA质粒转染昆虫细胞Sf9 72小时后,吹散Sf9细胞,1 000 r/min离心5分钟,用3%多聚甲醛固定,PBS洗 2次,10%FBS封闭,3%BSA稀释EV71-VP1鼠抗单克隆一抗,室温孵育1小时;PBS洗3次,再加入1∶200稀释FITC标记的羊抗鼠二抗,37℃作用45分钟,PBS洗3次,晾干载玻片,加入缓冲甘油,盖上盖玻片,置荧光显微镜下观察。
1.4.4 Bac-EV71 P1-3CD病毒毒力的测定 6孔板每孔加入2 ml细胞悬液,Sf-900ⅢSFM将病毒液做10倍系列稀释(10-3~10-8);弃去6孔板Sf9细胞上清,取系列稀释病毒各1 ml分别加入到对应每孔内,对照孔加入新鲜培养基;细胞与病毒液27℃作用1小时;当细胞与病毒液27℃作用第二个1小时后,移去病毒液,每孔加入2 ml空斑覆盖液;27℃培养细胞7~10天,每天观察6孔板直至空斑计数易于辨认并连续两天不变,每一孔最佳计数范围为3~9个空斑测定接种效价。用下述公式计算效价(pfu/ml):pfu/ml(原始母株)=1/稀释倍数×空斑数×1/(接种量ml/平板)。
1.5 EV71 VLPs的纯化及鉴定
1.5.1 蔗糖密度梯度离心纯化EV71 VLPs 收集杆状病毒感染的Sf9细胞,-80℃反复冻融3次,6 000 r/min离心20分钟,上清经孔径为30 kD膜包浓缩。超速离心机再次进行浓缩,浓缩产物通过蔗糖密度梯度离心纯化,蔗糖密度依次为15%、30%和45%,每个蔗糖密度各 3 ml,VLPs上样 3 ml,27 000 r/min,4℃离心过夜,15%与30%蔗糖层出现蛋白带,收取蛋白混合物500 μl。
1.5.2 SDS-PAGE及Western blot免疫印迹法检测目的蛋白表达 纯化EV71 VLPs分别行SDS-PAGE和Western blot鉴定,检测按常规方法进行,样品跑SDS-PAGE电泳,考马斯亮蓝染色;同时将PAGE胶上相应分子量处的目的蛋白转于硝酸纤维膜上,用脱脂奶封闭37℃1小时,一抗(1∶3 000)4℃封闭过夜;次日再用HRP标记羊抗鼠二抗(1∶25 000)封闭37℃1小时,最后用DAB显色系统显色。
1.5.3 透射电镜观察 Bac-EV71 P1-3CD杆状病毒感染昆虫细胞(1×107)12 000 r/min,10分钟,弃上清,4℃固定液固定1小时,PBS洗2次,每次5分钟,4℃ 1%锇酸固定2小时,丙酮脱水,每次3分钟,丙酮:Epon812(1∶1)混合包埋室温浸泡30分钟,Epon812包埋37℃ 12小时,60℃聚合48小时,超薄切片机切片,放置铜网上,进行1%醋酸双氧铀、柠檬酸铅双染色,冲洗后干燥,利用透射电镜上观察昆虫细胞内重组杆状病毒及EV71 VLPs形态进行观察。
2 结果
2.1 EV71 P1-3CD的P1和3CD基因PCR鉴定EV71 P1-3CD的P1和3CD基因经PCR后,经1%琼脂糖凝胶电泳扩增片段的大小分别为2 586 bp和1 935 bp(图1),与合成EV71 P1和EV71 3CD基因大小相符。
2.2 EV71 P1-3CD BacmidDNA重组质粒PCR鉴定及电泳 将重组pFastBac Dual-EV71 P1-3CD质粒转化到含有Bacmid及辅助质粒的DH10感受态细胞中,37℃培养24小时,通用引物M13 M4/RV对其菌液进行菌落PCR鉴定,阳性质粒约7 081 bp(图2),大小与预期结果一致,说明EV71 P1-3CD基因成功转座到Bacmid。
2.3 EV71 P1-3CD Bacmid DNA电泳 按Invitrogen公司 PureLinkTMHiPure Plasmid Midiprep Kit产品说明书提取EV71 P1-3CD Bacmid DNA,经0.5%琼脂糖电泳鉴定,由图3可见,片段大小与预期的一致,这进一步证实pFastBac Dual-EV71 P1-3CD与Bacmid成功同源重组。
2.4 EV71 P1-3CD Bacmid DNA转染昆虫细胞Sf9
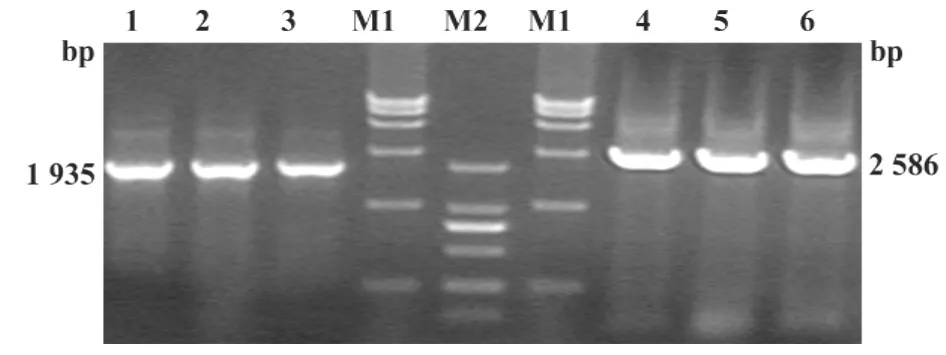
图1 EV71 P1和EV71 3CD基因PCR鉴定图Fig.1 Identified target genes of EV71 P1 and EV71 3CD by PCR
按照 Bac-to-BacⓇBaculovirus Expression System CellfectionⓇReagent(Invitrogen)的说明书,EV71 P1-3CD Bacmid DNA转染Sf9,转染48小时后,由图4可见,转染的昆虫细胞Sf9变大,折光性增强,贴壁能力差,细胞间隙大,感染96小时,细胞有少量溶解破碎。
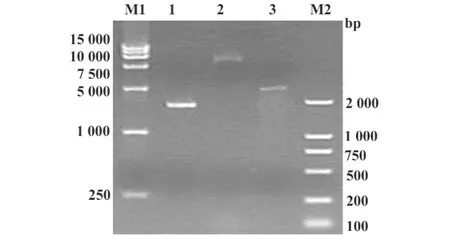
图2 重组EV71 P1-3CD Bacmid DNA鉴定图Fig.2 Identification of recombinant pFastBac Dual-EV71 P1-3CD Bacmid DNA

图3 重组EV71 P1-3CD杆粒DNA电泳鉴定图Fig.3 Analysis of recombinant EV71 P1-3CD Bacmid DNA by agarose gel electrophoresis

图4 重组EV71 P1-3CD杆状病毒感染昆虫细胞Sf9病变图(×200)Fig.4 CPE of the Sf9 cells infected by recombinant EV71 P1-3CD Baculovirus( ×200)
2.5 重组EV71 P1-3CD杆状病毒DNA PCR鉴定
将盲传4代的EV71 P1-3CD杆状病毒提取DNA,分别利用特异引物及通用引物进行PCR鉴定,特异引物鉴定,可见约在1 935及2 586 bp处有特异性条带,大小与合成基因大小相符,通用引物鉴定在7 081 bp处有条带(图5),与预期目的大小也一致,证明杆状病毒为EV71 P1-3CD杆状病毒。
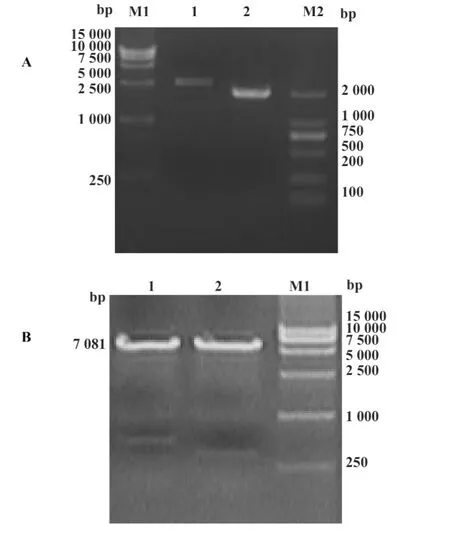
图5 传4代重组EV71 P1-3CD杆状病毒基因组PCR鉴定图Fig.5 Identification of recombinant EV71 P1-3CD Baculovirus genome DNA after 4 blind passages
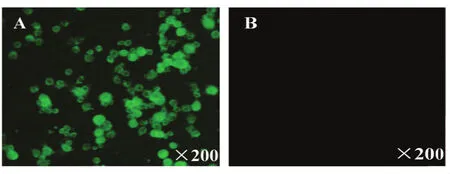
图6 昆虫细胞Sf9表达EV71 P1-3CD蛋白的间接免疫荧光检测Fig.6 Indirect immunofluorescence analysis of recombinant EV71 P1-3CD protein in Sf9 cells
2.6 IFA检测重组EV71 P1-3CD蛋白 将感染EV71 P1-3CD杆状病毒的昆虫细胞Sf9,经3%多聚甲醛固定后,利用EV71 VP1鼠抗单克隆抗体和荧光标记二抗进行IFA检测,VLPs蛋白可以与单克隆抗体发生反应,其感染细胞可检测到FITC荧光,而空白Sf9细胞无FITC信号(图6),证明VLPs蛋白成功表达。
2.7 重组EV71 P1-3CD杆状病毒空斑试验 EV71 P1-3CD杆状病毒做空斑试验,经肉眼观察,重组EV71 P1-3CD杆状病毒产生很淡的牛奶灰色空斑(图7),经计算重组EV71 P1-3CD杆状病毒原始母株效价约为2×106pfu/ml。
2.8 EV71 VLPs纯化 收集感染EV71 P1-3CD杆状病毒的Sf9细胞,-80℃反复冻融3次,超速离心浓缩,由图8可见,在15%与30%蔗糖层出现一条分离带,回收分离带。

图7 重组EV71 P1-3CD杆状病毒空斑实验结果Fig.7 Viral plaque assay of recombinant EV71 P1-3CD

图8 蔗糖密度梯度离心法纯化重组EV71 VLPsFig.8 Sucrose density gradient centrifugation purification of EV71 VLPs
2.9 EV71 VLPs的SDS-PAGE分析及Western blot检测 回收15%与30%蔗糖之间分离带并用PBS脱糖2次,12.5%SDS-PAGE电泳,由图9可以清晰看到 VP0(约39 kD)、VP1(约34 kD)和 VP3(约27 kD),经Western blot检测有VP1特异条带。
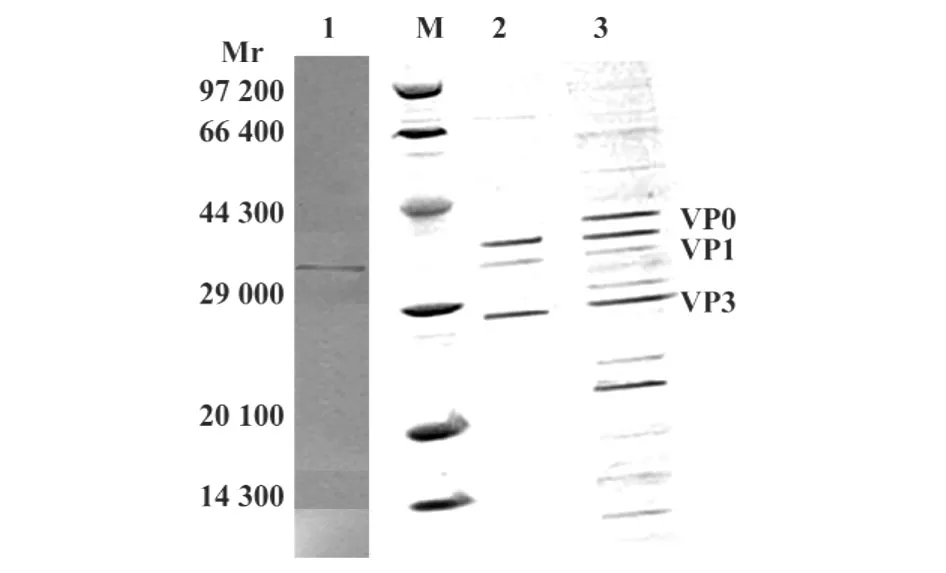
图9 SDS-PAGE分析及Western blot检测EV71 VLPsFig.9 SDS-PAGE analysis and Western blot detection of recombinant EV71 VLPs
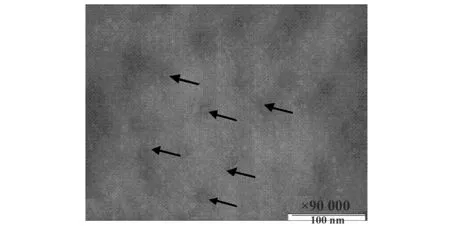
图10 纯化EV71 VLPs电镜观察Fig.10 Electron micrograph of purified EV71 VLPs
2.10 透射电镜观察EV71 VLPs 利用透射电镜观察纯化EV71 VLPs,由图10可见,病毒样颗粒分布均匀,形状规则,测定病毒样颗粒直径约为23~33 nm,形态和大小与肠道病毒EV71一致。
3 讨论
HFMD作为国家丙类传染病,在全国各地引起多次暴发,累及地域广、患病人口多,受到人们广泛关注。EV71是手足口病的主要病原,病人感染EV71易出现麻痹、无菌性脑膜炎和脑膜脑炎等并发症[8,9]。自 1998 年台湾地区 HFMD 大流行以来,EV71疫苗的研究受到广泛关注,但到目前为止有关疫苗的研究均处于一期临床或临床前研究阶段。VLPs疫苗在形态结构上与天然病毒颗粒相似,它作为免疫原保留全面的抗原表位,具有很强的免疫原性和生物学活性,产生免疫保护反应比灭活全病毒疫苗更全面[10],并且不含有病毒遗传物质,不具感染性,不发生基因恢复性突变重组,安全性方面优于灭活和减毒病毒疫苗,因此,成为近年来的研究热点。
据报道利用Bac-to-Bac表达的HPV VLPs已进入临床研究,轮状病毒和细小病毒等VLPs进入临床前研究,这些表明VLPs疫苗发展前景广阔[11]。本实验首先经昆虫密码子优化的EV71 P1和EV71 3CD基因,后期对病毒空斑试验和感染收获时间等方面均进行优化,提高EV71 VLPs的表达量。目前VLPs纯化的方法有:蔗糖密度梯度离心、CsCl密度梯度离心、分子筛、磁珠纯化和凝胶层析技术纯化等。CsCl密度梯度离心纯化的纯度较高,但其会破坏病毒的构象且后期需要将VLPs中的CsCl除去,对纯化VLPs损失较大;分子筛纯化需要较多体积的病毒浓缩液,凝胶层析技术纯化分离操作较慢,有时还有非特异吸附现象;蔗糖密度梯度离心法根据沉降系数不同而达到分离纯化目的,优点在于样品回收率较高,实验结果表明应用蔗糖密度梯度离心纯化VLPs可行的,对VLPs形成破坏性较小,且能较好的保护病毒颗粒的形态。
本实验成功制备了EV71 VLPs,并利用蛋白浓度检测BCA法检测EV71 VLPs表达量为0.817 mg/ml,高效液相色谱法检测纯度大于90%。Chung等[12]已用杆状病毒表达系统表达EV71 P1和3CD蛋白,利用3CD将P1切割VP1、VP3和 VP0三个蛋白并装配成EV71 VLPs,这于本文结果一致,Chung等[13]进一步利用EV71 VLPs免疫小鼠可诱发Th1/Th2免疫应答,免疫母鼠后攻击新生鼠可产生保护作用。Chung等[14]利用 CMV和 IE-1启动子构建Bac-P1-C3CD和Bac-P1-I3CD,经过宿主细胞,细胞密度,培养模式和溶解氧(DO)等方面优化有效提高了VLPs的表达量,为64.3 mg/L,比传统方法提高了约43倍,而且在小鼠模型产生的抗体能较好的中和EV71型同源和异源毒株,比本文的表达量高出约78倍,这为本实验继续研究获得较高纯度、浓度和形态完整的VLPs和进行免疫学评价提供了借鉴依据。
1 Xu W,Liu C F,Yan L et al.Distribution of enteroviruses in hospitalized children with hand,foot and mouth disease and relationship between pathogens and nervous system complications[J].Virol J,2012;doi:10.1186/1743-422X-9-8.
2 Lee T C,Guo H R,Su H J et al.Diseases caused by enterovirud 71 infection[J].Pediatr Infect Dis,2009;28(10):904-910.
3 Cabral L A,Almeida J D,Oliveira M L et al.Foot and mouth disease:a case report[J].Quintessence Int,1998;29(3) :194-196.
4 吴海波,郭潮潭.手足口病疫苗研究进展[J].中国儿童保健杂志,2009;17(1):66-68.
5 Yan J J,Su I J,Chen P F et al.Complete genome analysis of enterovirus71 isolated from an outbreak in Taiwan and rapid identification of enterovirus 71 and coxackievirus A16 by RT-PCR [J].J Med Virol,2001;65(2):331-339.
6 Wang S M,Liu C C,Tseng H W et al.Clinical spectrum of enterovirus 71 infection in children insouthern Taiwan with an emphasis on neurological complications[J].Clin Infect Dis,1999;29(1):184-
190.
7 Jia C S,Liu J N,Li W B et al.The cross-reactivity of the enterovirus 71 to human brain tissue and identification of the cross-reactivity related fragments[J].Virol J,2010;7(1):47-56.
8 Phuektes P,Chua B H,Sanders S et al.Mapping genetic determinants of the cell-culture growth phenotype of enterovirus 71[J].J Gen Virol,2011;92(Pt 6):1380-1390.
9 Solomon T,Lewthwaite P,Perera D et al.Virology,epidemiology,pathogenesis,and control of enterovirus 71 [J].Lancet Infect Dis,2010;10(11):778-790.
10 Garcea R L,Gissmann L.Virus-like particles as vaccines and vessels for the delivery of small molecules[J].Curr Opin Biotechnol,2004;15(6):513-517.
11 Tacket C O,Sztein M B,Losonsky G A et al.Humoral,mucosal,and cellular immune responses to oral Norwalk virus-like particles in volunteers[J].Clin Immunol,2003;108(3):241-247.
12 Chung Y C,Huang J H Lai C W et al.Expression,purification and characterization of enterovirus-71 virus-like particles[J].World J Gastroenterol,2006;12(6):921-927.
13 Chung Y C,Ho M S,Wu J C et al.Immunization with virus-like particles of enterovirus 71 elicits potent immune responses and protects mice against lethal challenge[J].Vaccine ,2008;26(15):1855-1862.
14 Chung C Y,Chen C Y,Lin S Y et al.Enterovirus 71 virus-like particle vaccine:Improved production conditions for enhanced yield[J].Vaccine,2010;28(43):6951-6957.

