NADPH-d染色法术中快速诊断先天性巨结肠
朱利斌,张普,黄婷,王永彪
(温州医学院附属育英儿童医院,浙江 温州 325027,1.儿外科;2.病理科)
先天性巨结肠(Hirschprung’s disease,HD)手术治疗效果如何,依赖术中是否准确切除病变肠管,但仅凭术者经验,过多切除正常的肠管,则正常肠管总长度减少,患儿易患营养不良、慢性腹泻等疾病,而且增加手术时间及手术风险;反之切除肠管过少,病变段肠管未完全切除,患儿仍有持续便秘,需再次手术,增加患儿的痛苦及经济上的压力。因此,在手术中急需一个行之有效、快速、规范、易操控的、客观的诊断方法。以往的术中快速诊断方法有:冰冻切片HE染色、乙酰胆碱脂酶(AchE)染色、乳酸脱氢酶(LDH)染色法等,对肠神经节细胞的有效识别率不高,操作流程繁琐,并且诊断依赖于病理科医师的主观经验,均不甚理想。本研究改进了一种基于NADPH-d的快速组织学染色方法,供手术当中快速诊断HD,确定肠管切除范围,介绍如下。
1 材料和方法
1.1 标本及分组 本研究所用标本均取自手术中切除肠管,并经我院伦理委员会批准。自2008至2011年37例HD患儿术中切除的结肠,其中男27例,女10例,年龄5~19个月,平均11.6个月。分扩张段、移形段、狭窄段,制片后分批超低温冰箱保存,以非HD结肠造瘘切除标本作为阳性对照。分NADPH-d快速染色法组、冰冻切片HE染色法组。
1.2 制片 标本常规冰冻连续切片,片厚4μm,多聚赖氨酸载玻片贴片,取奇数切片做NADPH-d的快速组织学染色,偶数切片做冰冻切片HE染色。
1.3 NADPH-d的快速组织学染色方法 反应液组成:1 mL 0.1 mol/L PB(pH 8.0)液中加入0.5 mg NADPH-d(Sigma)、0.6 mg NBT(Sigma)、10μL二甲基亚砜(苏州正兴化工研究院)、3μL Triton X-100(北京拜尔迪生物公司)。滴加反应液后载玻片置于37 ℃水浴箱中10 min,观察反应液由黄色变微紫色后取出,光镜下观察神经节细胞显示清晰后PBS冲洗终止反应,水性封片剂封片。阴性对照:反应液中不加入NADPH-d。阳性对照:已知阳性组织(结肠造瘘切除标本)同时进行染色。
1.4 冰冻切片HE染色方法 冰冻切片切好后,室温下干燥。4%多聚甲醛固定5 min,蒸馏水洗2 min,苏木素染(37 ℃)1 min,自来水冲洗5 min,95%乙醇5 s,伊红染液20~30 s,70%乙醇洗2次,95%酒精30 s,100%酒精30 s,95%酒精2道每次30 s,100%酒精2道每次30 s,100%二甲苯2道,第一道10 min,第二道5 min,中性树胶封片后镜下观察。
1.5 双重染色 NADPH-d的快速组织学染色完成后,自来水冲洗5 min,采集图像后再行冰冻切片HE染色,完成后相同条件下再次采集图像,存档后观察比较。
1.6 观察指标 光镜下观察:①扩张段肌间神经丛着色情况,神经节细胞是否可轻易识别,与背景有无强烈反差。②移行段结果:神经丛、神经节细胞在数量、大小、分布范围与扩张段相比如何。③狭窄段有无阳性神经节细胞分布,背景着色情况。
1.7 统计学处理方法 全部数据采用SPSS for windows 13.0软件进行统计学处理,两种不同处理组间比较采用配对x2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 扩张段 扩张段经冰冻切片HE染色后,30 min内出结果,镜下肌间神经丛、神经节细胞隐约可见,背景组织细胞极多,故反差不大,若无丰富的经验积累,即使病理科医师也较难在短时间内分辨出神经节细胞,准确判断术中结肠切缘是否已达正常肠段(见图1)。与此相反的是NADPH-d的快速组织学染色,滴加反应液后10 min内出结果,背景清晰;低倍镜下可见环肌和纵肌之间丰富的神经丛呈串珠状分布(见图2),高倍镜下可见大量神经节细胞,其胞浆着紫色,胞核空白无着色(见图3)为判断神经丛所处位置及与冰冻切片HE染色结果进行比对,故对原先NADPH-d处理的切片采集图像后再进行快速HE染色,结果证实原先串珠状分布的紫色组织,即为肌间神经丛(见图4);高倍镜下可清楚分辨核大、深染、胞质略呈嗜碱性的神经节细胞(见图5)。
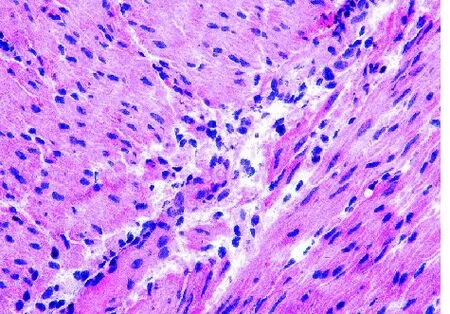
图1 冰冻切片HE染色显示肌间神经丛(×400)
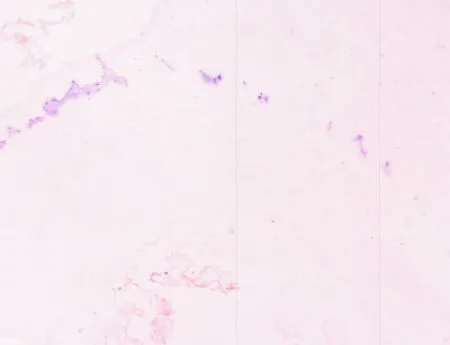
图2 扩张段NADPH-d的快速组织学染色(×100)
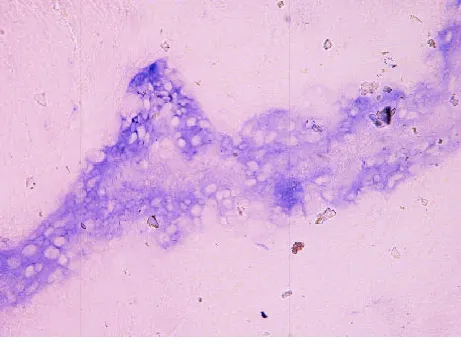
图3 扩张段肌间神经丛及神经节细胞(×400)
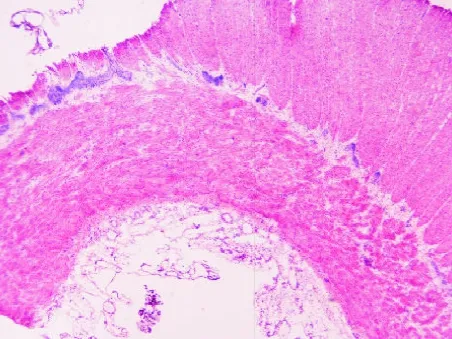
图4 双重染色后扩张段肌间神经丛及神经节细胞(×100)
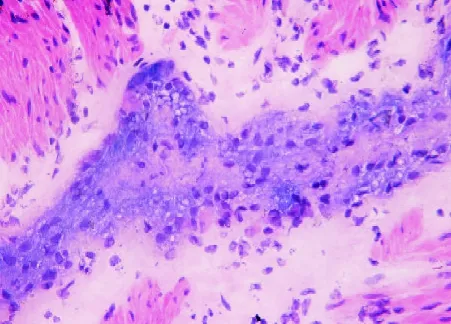
图5 双重染色后扩张段肌间神经丛及神经节细胞(×400)

图6 移行段NADPH-d的快速组织学染色,见神经丛分布稀疏(×100)
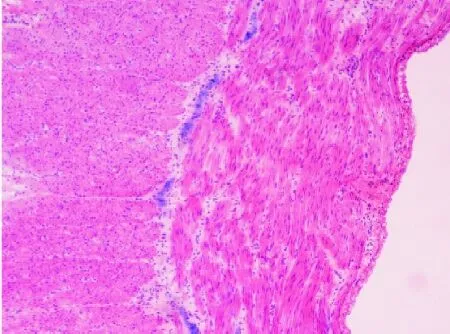
图7 移行段双重染色,见神经丛分布稀疏(×100)
2.2 移行段 低倍镜下可见少数着色神经丛,神经丛之间距离较大,分布较扩张段明显稀疏(见图6),高倍镜下神经节细胞可清楚分辨,但每个神经丛内节细胞数量及大小远不如扩张段。移行段双重染色后可证实沿肌间分布的神经丛,与单用NADPH-d快速染色结果相符(见图7)。
2.3 狭窄段 狭窄段NADPH-d的快速组织学染色,镜下见背景清晰,无任何着色,未见神经丛及阳性神经节细胞(见图8)。快速HE染色,可见肌间杂乱分布的肥大神经纤维束,无任何阳性神经节细胞(见图9),背景组织细胞繁多,不易判断结果。
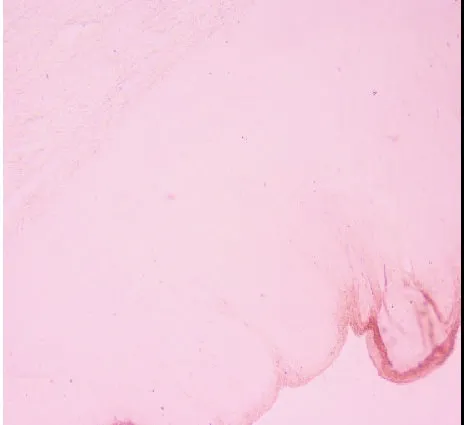
图8 狭窄段NADPH-d的快速组织学染色,未见阳性神经节细胞(×100)
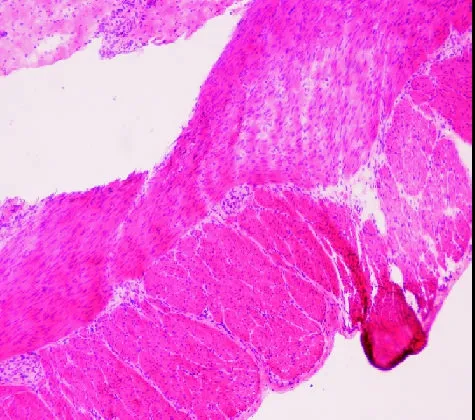
图9 狭窄段快速HE染色,无阳性神经节细胞(×100)
2.4 两种方法诊断结果比较 快速NADPH-d法和HE法配对比较37例(见表1),结果NADPH-d法2例阴性,HE法有3例阴性,经统计学分析,两种方法阳性率差异无统计学意义(P>0.05)。

表1 快速NADPH-d法和HE法结果比较(n=37)
3 讨论
HD是一种儿童常见的消化道发育畸形,可以引起婴儿肠梗阻和慢性便秘,在我国的发病率约为1:5000,为小儿外科最常见的先天性畸形之一。临床上常见的诊断方法如钡剂灌肠造影、肛门直肠测压、直肠黏膜活检术,很难准确判断病变的范围,准确性和敏感性很难达到临床要求。即使手术前行直肠黏膜活检术,依靠HE染色镜检,也只能从镜下观察神经节细胞的有无去判定巨结肠诊断是否成立,而无法确定病变肠管的范围。一般而言,在手术中根据术者经验及肠管的大体观察去判断病变段肠段范围,如术中行快速冰冻切片HE染色,遇到不典型病例或病理科医师经验不足,明显会影响肠管切除范围的判定,导致手术效果不佳,部分患儿还有反复的便秘或大便失禁,需再次手术切除剩余部分病变肠管,严重影响患儿的生活质量[1-2]。
目前研究较多的术中快速诊断方法有:冰冻切片HE染色法、AchE染色、LDH染色法,但都不甚理想。如前所述,HE染色法可以观察肠壁有无神经节细胞的存在,神经纤维有无异常增生,如果全部切片都未见神经节细胞,则可诊断为HD。但小儿的神经节细胞发育是一个逐渐成熟的过程,尤其在新生儿时期,发育更是不成熟,故HE染色对于识别发育未成熟、结构不典型的神经节细胞有一定难度,因此经验在诊断上特别重要,直接影响诊断的准确率。与此相反,NADPH-d的快速染色法对于神经节细胞具有高识别性,Montedonico等[3]认为特别适合诊断新生儿期HD。另外HE染色流程中需固定、脱水等较多步骤,耗时长。在HD病变段肠管中,AchE活性异常升高,通过AchE染色显色反应可看到胆碱能神经纤维大量增生,过去该流程要花费数小时,影响术中快速诊断的应用。Kobayashi等[4]改进了新方法,使染色时间缩短到6 min,使术中快速诊断成为可能。但AchE既存在于胆碱能神经元也存在于非胆碱能神经元,假阳性率高,且在新生儿中易出现假阴性,所以目前较少单纯用AchE染色来诊断HD。有报道称HE法和AchE染色两者结合可以更好诊断HD,但增加了大量操作步骤及时间[5],不利于术中快速诊断。至于LDH染色法,因能在神经节细胞中形成蓝紫色颗粒状沉淀物,有时候也能判断出无神经节细胞肠段的范围[6],但这种酶对神经节细胞及神经纤维缺乏特异性,而且一般要联合应用AchE染色,故不建议用于巨结肠的诊断[5]。
本研究中扩张段肠管经NADPH-d的快速染色,可见环肌和纵肌之间丰富的神经丛,呈串珠状分布,高倍镜下可见大量阳性神经节细胞,背景无着色。与HE法配对比较HD 37例,结果NADPH-d法2例阴性,其中1例经证实为全结肠型巨结肠。HE法有3例阴性,其中有2例再经NADPH-d法检测证实为阳性,考虑肠神经元发育不良,神经节细胞形态不典型,故无法识别;另外1例全结肠型巨结肠,因取材因素,无阳性结果。
综上所述,本研究建立了一种以NADPH-d酶组织化学方法为基础的肠神经节细胞快速染色方法,用于术中快速诊断先天性巨结肠,确定肠管切除范围。经过双重染色证实,NADPH-d法显示的阳性神经丛与神经节细胞与HE法完全相符,且染色背景清晰,无干扰,说明该方法切实可行。在前期实验中,课题组摸索了各种反应条件、流程,发现该反应液配置简单,易掌握,切片不需事先固定,也不同于其他染色方法,无需水化、脱水、染色等流程,避免接触二甲苯等致癌物质[7-8],而仅需在37 ℃条件下滴加反应液,10 min左右即出结果。该方法新颖,诊断快速,较冰冻切片HE染色法具有一定优越性。但目前仅是一个初步研究结果,样本均为典型HD病例,对于HD类缘病诊断结果如何,尚需进一步研究。
[1] Shayan K, Smith C, Langer JC. Reliability of intraoperative frozen sections in the management of Hirschsprung’s disease[J]. J Pediatr Surg,2004,39(9):1345-1348.
[2] Chumpitazi BP, Nurko S. Defecation disorders in children after surgery for Hirschsprung disease[J]. J Pediatr Gastroenterol Nutr,2011,53(1):75-79.
[3] Montedonico S, Piotrowska AP, Rolle U, et al. Histochemical staining of rectal suction biopsies as the first investigation in patients with chronic constipation[J]. Pediatr Surg Int,2008,24(7):785-792.
[4] Kobayashi H, Miyahara K, Kusafuka J, et al. A new rapid acetylcholinesterase staining kit for diagnosing Hirschsprung’s disease[J]. Pediatr Surg Int, 2007,23(5):505-508.
[5] 周峻,魏明发,冯杰雄,等. 先天性巨结肠的一种术中快速诊断方法[J]. 临床小儿外科杂志,2004,3(1):5-8.
[6] 向磊,柴成伟,吴晓娟,等. 快速乳酸脱氢酶染色在先天性巨结肠及肠神经元发育异常术中诊断的应用[J]. 实用儿科临床杂志,2009,24(3):227-229.
[7] 朱利斌,李仲荣,雷亚宁,等. 大鼠食管下端括约肌氮能神经元发育的铺片研究[J]. 中华小儿外科杂志,2006,27(9):484-486.
[8] 钱旭,雷亚宁,任艳华,等. 糖尿病大鼠十二指肠肌间神经丛内氮能神经和Cajal间质细胞的变化[J]. 温州医学院学报,2006,35(2):122-124.

