以SRY为靶基因建立免疫耐受嵌合的定量检测方法
瞿永华,方 成
(武汉工业学院医学技术与护理学院,湖北武汉430023)
器官移植是器官功能衰竭的最终治疗手段,免疫抑制剂的应用对解决抑制排斥反应、延长患者生存时间起到了重要作用。但是,免疫抑制剂的终生使用,除了经济负担外,药物使用的副作用也给移植患者带来十分不利的影响[1]。器官移植最理想的状态是针对供体移植物建立特异性免疫耐受,受体在不使用免疫抑制剂的条件下不产生对移植物的排斥反应。而诱导和维持免疫耐受的机制之一就是在受体体内建立嵌合体。
本实验室试图研究供体造血干细胞在受体内增殖的条件,实现嵌合,达成免疫耐受。我们设计以雄性大鼠为供体,雌性大鼠为受体,以性别决定因子Y(SRY)作为检测指标[2],利用实时荧光定量聚合链反应(RT-PCR)技术[3],建立大鼠的同种异体移植血细胞嵌合率的检测方法,从而监测受体免疫耐受的状态。
1 材料和方法
1.1 材料
雄性近交系Lewis大鼠(北京维通利华公司)与雌性DA大鼠(哈尔滨医科大学第二附属医院实验动物中心)的新鲜血样。
1.2 仪器
Stepone荧光定量PCR仪(美国ABI公司),分光光度计DNA定量(EPPENDORF公司),DNA电泳(北京六一)。
1.3 试剂
1.3.1 DNA提取试剂盒(TOYOBO公司),SYBR Green I染料(TOYOBO公司)。
1.3.2 引物序列:①上游引物:5'-ATACTGGCTCTG CTCCTACC-3';②下游引物:5'-CCCCTCTCCCAC CTCCCACTTTAGC-3'[4]。均由上海英俊公司合成。
1.4 实验方法
1.4.1 标准品的建立
取雄性大鼠心脏新鲜血样,按DNA提取试剂盒标准程序抽提 DNA,获取DNA溶液500 μL。测定样品起始DNA浓度为4.00×103μg/L,分别稀释至100,10-0.5,10-1,10-1.5,10-2,10-2.5,10-3倍数建立阳性质控标准样品。即所含阳性拷贝数是原始浓度的100%,31.6%,10%,3.2%,1%,0.3%,0.1%,浓度依次为4.00×103μg/L,1.26×103μg/L,4.00×102μg/L,1.26 ×102μg/L,4.00 ×101μg/L,1.26×101μg/L,4.00×100μg/L。阴性标准品即雌性大鼠血样DNA测定样品浓度为1.8×103μg/L。
1.4.2 实时荧光定量PCR
在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。荧光信号的累积与PCR产物形成完全同步,荧光信号被荧光监测系统接收,当信号增强到设定的荧光阈值,即时的PCR循环次数(Cycle)即Ct值。每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系[5],起始拷贝数越多,Ct值越小。利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代表Ct值。对待测样品只要用定量PCR仪测得Ct值,利用标准曲线即可得到该样品的起始拷贝数。10 μL的PCR反应体系包括:DNA样本 1 μL;ddH2O 3 μL; 混合引物1 μL;SYBR Green PCR Master mix 5 μL。PCR 反应条件:95 ℃ 60s—95℃ 15s—60℃ 15s—72℃ 45s(40个循环)。收集PCR产物1.5%琼脂糖凝胶电泳,紫外灯下观测目的条带显色情况。
1.4.3 定量结果分析方法
以样品稀释率的负对数值为横坐标,Ct值为纵坐标,则得到嵌合率曲线。用定量PCR仪测得未知样品的Ct值,利用标准曲线即可计算出该样品的稀释率。
2 结果与分析
2.1 雌性和雄性大白鼠血细胞DNA的提取
雄性大鼠SRY序列作引物,分别以雌性和雄性大白鼠全血提取的DNA为模板的PCR产物在1.5%琼脂糖凝胶上电泳。电泳结果显示以雄性大鼠DNA为模板的PCR产物获得阳性条带,以雌性大鼠DNA为模板的PCR产物未见阳性条带(图1),证实提取的DNA具有引物特异性。

图1 以雌性和雄性大鼠DNA为模板的PCR产物电泳
2.2 实时荧光定量PCR结果
根据Stepone PCR仪实时荧光定量PCR动力学曲线获Ct值,以样品起始浓度拷贝数的对数为横坐标,Ct值为纵坐标,可以得到一条严格的直线型标准曲线图2。

图2 SRY起始拷贝数定量标准曲线
2.3 嵌合率标准曲线
根据起始拷贝数与样品稀释率的一一对应关系,以样品稀释率的负对数值为横坐标,Ct值为纵坐标,可以得到一条严格的直线型标准曲线,线性相关系数r>0.99,检测最小值达10-3,即0.1%(图3) 。
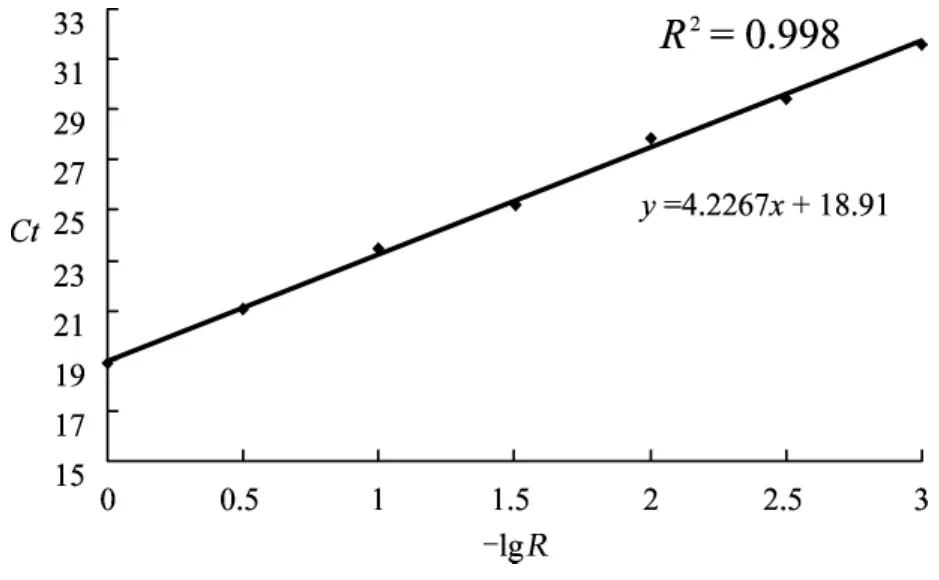
图3 嵌合率定量标准曲线
3 讨论
嵌合是指受体在接受异体或异种移植物后,其体内存在着供体细胞,而在移植物内存在着受体细胞。这种供、受体细胞相互移行共存的现象称为嵌合现象[6]。Bllingham等人于1953年发现了这一现象,提出此现象与获得性免疫耐受有关。1969年Starzl等对一例接受男性供肝的女性肝移植患者进行细胞分型中发现,男性供肝的所有网状内皮细胞被女性细胞所代替。随后,在许多成功的肝、肺、心、肾移植中均发现了嵌合现象[7]。因此Starzl等提出嵌合现象与成功的器官移植有关,嵌合是移植物存活的基础。PING[8]等证实嵌合可以诱导特异性耐受。
一般来说,应用流式细胞计数仪检测嵌合体的敏感性为0.5%(即200个受体细胞中检测出1个供体细胞),而聚合酶链反应(PCR)的方法可在105个细胞中检测出1个供体细胞。微嵌合体是指在实质器官移植患者的外周组织中,应用PCR方法可检测,而应用流式细胞计数仪则不能检测到供体细胞水平[9]。
4 结论
本实验为实现监测器官移植免耐受状态的目的,设计了对血细胞嵌合率进行定量检测的方法。由于实验模型设计供体采用雄性动物,受体采用雌性动物,因此选用SRY作为检测指标。SRY基因存在于Y染色体上,其序列具有高度保守性[10],本实验中,SRY基因作为标记显示供体即雄性大白鼠血细胞的存在,检测指标具有特异性,其拷贝数用来定量。
通过设计的实验步骤建立的标准品,经实时荧光定量PCR检测,得到一条准确反映标准品数量关系的标准曲线,线性相关系数r>0.99,敏感度可达0.1%,符合技术要求。标准曲线的建立证明本实验程序标准可靠,而且有动物模型显示1%的供体血细胞嵌合率足以诱导有效的供体特异性耐受[11]。因此,本实验所建立的标准品及标准曲线可用来对未知样品进行血细胞嵌合率检测,可以有效监测器官移植免疫耐受状态。
[1] Roozbeh J,Mehdizadeh A R,Izadfar M A,et al.Comparison of spousal with other donor groups:study of a single center[J].Transplant Proc,2006,38(2):562-563.
[2] Sinclair A H,Berta P,Palmer M S,et al.A gene from the human sex-de ter mining region encodes a protein with homology to a conserved DNA-binding motif[J].Nature,1990,346:240-244.
[3] Heid C A,Smves J,Livak K J,et al.Real time quantitative PCR[J].Genome Res.1996.6:986-944.
[4] 赵洪雯,余荣杰等.大鼠Y染色体探针的制备与鉴定.现代生物医学进展[J],2008,8(5):832-835.
[5] Higuchi R,Dollinger G,walsh P S,et al.Stimutaneous amplification and detection of specific DNA Sequences[J].Biotechnology.1992,10:413-417.
[6] Starzl T E.Cell migration and chimerism after whole-organ transplantation:the basis of graft acceptance[J].Hepatology.1993.17(6):1127-1152.
[7] Reinsmoen N L,Jackson A,McSherry C,et al.Organ-specific patterns of donor antigen-specific hyporeactivity and peripheral blood allogeneic microchimerism in lung,kidney,and liver transplant recipients[J].Transplantation,1995,60(12).
[8] Ping Y,SI D X,Qiu Z H,et al.Induction of allogeneic mixed chimerism by immature dendritic cells and bone marrow transplantation leads to prolonged tolerance to major histocompatibilitycomplex disparate allografts[J].Immunology,2009,127(4),500-511.
[9] 陶绍富,李济宇.嵌合诱导移植耐受的研究进展[J].广东医学,2011,32(2):250-252.
[10] Sundaresan S,Trulock E P,Mohanakumar T,et al.Prevalence and outcime of bronchiolitis obliterans syndrome after lung transplantation.Washington University Lung Transplant Group[J].Ann Thorac Surg,1995,60(5).
[11] Ildstad S T,Wren S M,Bluestone J A,et al.Effect of selectivel cell depletion of host and/or donor bone marrow on lymphopoietic repopulation,tolrance,and graft-vs-host disease in mixed allogenetic chimeras(B10+B10.D2-B10)[J].J Immu nol,1986,136:28-33.

