黑暗条件下干露对孔石莼生理生化指标的影响
杨帆,李世国,佟少明,侯和胜
(辽宁师范大学 生命科学学院;辽宁省植物生物技术重点实验室:辽宁 大连116081)
黑暗条件下干露对孔石莼生理生化指标的影响
杨帆,李世国,佟少明,侯和胜*
(辽宁师范大学 生命科学学院;辽宁省植物生物技术重点实验室:辽宁 大连116081)
在黑暗条件下干露胁迫处理孔石莼的叶状体,测定其叶绿素a、脯氨酸、可溶性糖、丙二醛的含量以及过氧化物酶(POD)的活性随不同处理时间段(0、0.5、1、2、4、6 h)的变化.实验结果显示:孔石莼的各项生理指标与对照组(未经干露处理)相比,除叶绿素a的含量逐渐下降外,其余各项生理指标均出现上升的趋势,其中脯氨酸的含量和POD活性均在4 h后急剧升高;经6 h胁迫后复水,各指标均有不同程度的恢复.这说明孔石莼对黑暗条件下的干露有一定的适应性,该结果可为孔石莼干露适应的生理机制提供参考.
孔石莼;黑暗;干旱胁迫;生理指标
0 引言
孔石莼(Ulvapertusa)属于大型底栖海洋绿藻,其结构较为简单,由2层细胞组成,广泛生长在太平洋沿岸海域的中、低潮带的岩石和石沼上,具有食用、药用和工业生产等多种应用价值[1-2].干露下的孔石莼是组成海岸带生态系统中的重要海藻物种,它对于涨潮时的海水淹没和退潮时的水面露出具有很强的适应性,同时也是开展海藻抗逆机理研究的理想实验材料.由于潮间带大型海藻同时受盐度、温度、各种离子浓度及光照等因素的影响,因此,它们干露下的响应机制较为复杂.目前,关于羊栖菜(Sargassumfusiforme)、石莼(Ulvalactuca)、坛紫菜(Porphyrahaitanensis)等海藻在干露状态下的生长、发育、光合作用等生理生化的研究已有报道[3-5],而在干露条件下关于孔石莼的生理生化指标变化的报道较少.刘力等[6]对石莼和孔石莼在干露失水条件下的光合速率及呼吸速率进行了测定,发现藻体随晾干时间的增加其光合速率逐步下降,且不同程度的晾干失水对藻体的呼吸均有一定的促进作用;吴倩倩等[7]以光照条件下的干露胁迫对孔石莼的生理影响进行了初步研究,发现其各种生理指标也有不同程度的上升和下降.研究发现,黑暗条件对藻类的生理也具有重要影响.蔡卓平等[8]发现,黑暗环境明显抑制了三角褐指藻体内生化物质的合成与积累,其叶绿素a和可溶性糖的含量与对照组相比分别降低了约89%和87%,说明三角褐指藻在黑暗环境中具有一定的适应忍耐力;李杰等[9]在对微囊藻衰亡的生理机制的研究中发现,在黑暗条件下叶绿素a的含量呈下降趋势,而其抗氧化酶系统的一些相关生理指标则呈显著上升的趋势.本研究以孔石莼的叶状体为材料,将其在黑暗条件下干露胁迫处理(不同时间段),测定其藻体的叶绿素a、脯氨酸、丙二醛、可溶性糖的含量和POD活性的变化,探讨黑暗与光照下的干露胁迫对孔石莼某些生理、生化指标的影响,为深入研究孔石莼适应干露胁迫的生理机制提供理论依据.
1 材料与方法
1.1 孔石莼的采集、预培养及胁迫处理
孔石莼于大潮时采集自大连付家庄海域的礁石上.采集时取个体完整并淹没于海水中的藻体,采集后立即盛于采集箱中运至实验室.采集地点的海水表面温度为(5±1)℃,盐度为(35±1)mg/L.按照下述培养条件在光照培养箱中预培养10 d,即光照强度为100μmol/m2·s,温度为(5±1)℃,盐度初始值为(35±1)mg/L,光周期为12∶12(L∶D),然后用灭菌的海水通气保存备用,且每天全量更换海水.实验时用灭菌的海水清洗藻体表面以去除杂质,然后将其平铺在直径为90 mm的灭菌培养皿中,置于光照培养箱(暗箱)中进行黑暗条件下的干露胁迫处理,温度为(15±1)℃,光周期为12∶12.
孔石莼在自然条件下平均每天暴露于空气中的时间大约在6 h左右[10],所以以黑暗条件下经干露处理0、0.5、1、2、4、6 h为收集材料时间点.以新鲜藻体作为未处理的对照组(未经干露处理),并且每个处理组和对照组都设置3个平行实验,以此最终测定各项生理指标的变化.按照上述方法在光照培养箱中将干露处理6 h后的藻体放入海水中恢复,然后每隔0.5 h测定各生理指标(共5次),最后以各指标的含量来判断恢复的程度.
1.2 生理指标的测定方法
依据文献[11],叶绿素a的含量测定采用乙醇法,脯氨酸的含量测定采用酸性茚三酮法,可溶性糖和丙二醛的含量测定采用三氯乙酸一硫代巴比妥酸法,过氧化物酶(POD)的活性测定采用愈创木酚法.
2 实验结果
2.1 叶绿素a含量的变化
如图1所示,与对照组相比,在同样的温度(15℃)条件下,处理时间为0.5 h和1 h时,孔石莼中叶绿素a的含量略有下降,变化并不显著;当处理时间为2 h时,叶绿素a含量的下降程度较之前稍有明显;当处理时间为4 h时,叶绿素a的含量下降显著,与对照组相比呈显著差异(0.01<P<0.05);当处理6 h后,叶绿素a的含量下降呈极显著差异(P<0.01).
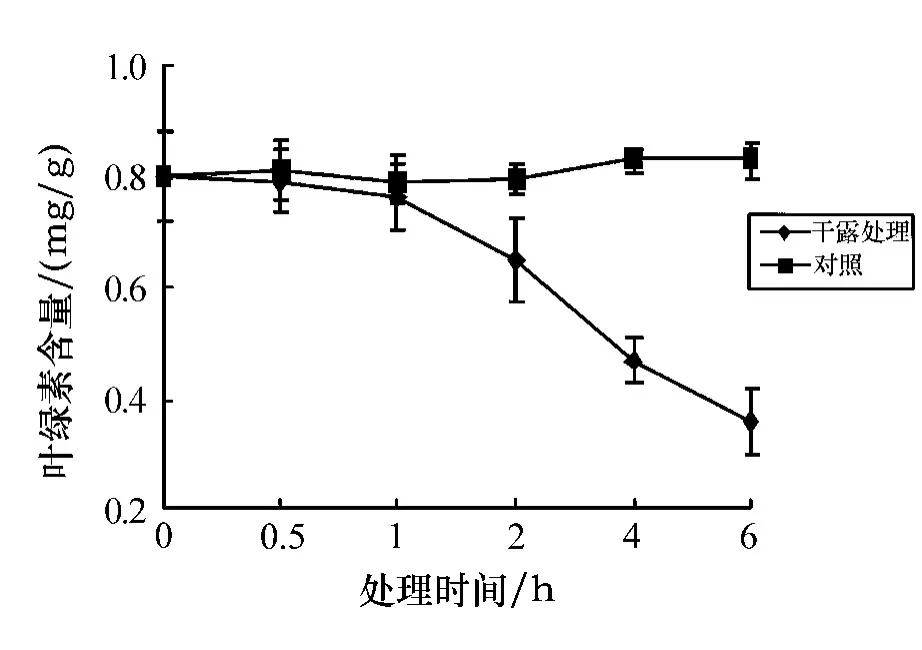
图1 叶绿素a含量随不同干露时间的变化
把经过6 h胁迫处理后的孔石莼放入海水中做恢复实验,实验结果如图2所示.由图2可以看出,叶绿素a的含量随恢复时间略呈上升趋势,但并不明显,在3 h时恢复得最多(58.1%).可见,在黑暗条件下,随着干露处理时间的延长,孔石莼中叶绿素a的含量呈逐渐下降的趋势,并且时间越长,下降趋势越显著;经胁迫后的补水恢复实验仍未达到对照组的程度,说明孔石莼中的叶绿素a受胁迫影响较大.
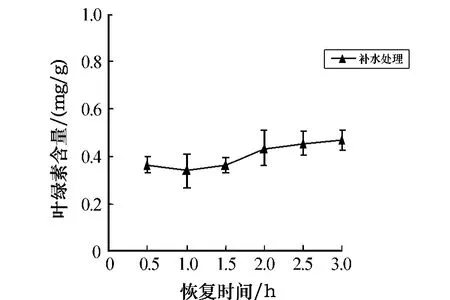
图2 胁迫6 h后叶绿素a含量随不同恢复时间的变化
2.2 脯氨酸含量的变化
孔石莼中脯氨酸含量的变化如图3所示.由图3可以看出,随着胁迫处理时间的延长,脯氨酸的含量呈明显的上升趋势;当处理时间为1 h时,脯氨酸含量呈极显著差异(P<0.01);当处理时间为2 h时呈显著差异(0.01<P<0.05);当处理时间为4 h和6 h时呈极显著差异(P<0.01).胁迫6 h后的补水恢复实验结果如图4所示.由图4可以看出,在1.5 h时脯氨酸的含量呈明显下降趋势,在3 h时其含量为对照组含量的324%.此结果表明,当胁迫处理4 h后,脯氨酸的含量开始急剧上升,再经补水恢复其含量呈下降趋势,由此可推断脯氨酸可能是参与孔石莼渗透调节的主要物质之一.

图3 脯氨酸含量随不同干露时间的变化

图4 胁迫6 h后脯氨酸含量随不同恢复时间的变化
2.3 可溶性糖含量的变化
孔石莼中可溶性糖含量的变化如图5所示.与对照组相比,黑暗条件下经干露处理后可溶性糖的含量均呈逐渐上升趋势,其中处理时间在2~6 h时,可溶性糖的含量均呈明显的上升趋势,且均呈极显著差异(P<0.01).图6为胁迫6 h后可溶性糖含量随不同恢复时间的变化.图6显示,恢复时间为0.5 h时,可溶性糖的含量呈现缓慢下降的趋势,在3 h时达到对照组含量的1.24%.这表明,随着胁迫时间的延长,可溶性糖的含量大量积累,这与体内脯氨酸含量的变化趋势相似.从随后的补水恢复实验可以看出,可溶性糖的含量有缓慢恢复的趋势,这表明可溶性糖也可能是参与藻体内渗透调节的主要物质之一.
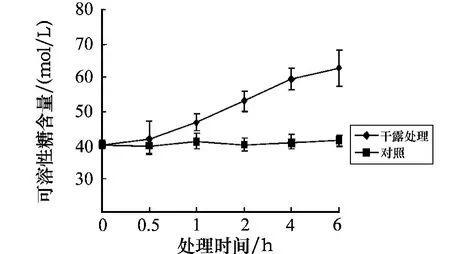
图5 可溶性糖含量随不同干露时间的变化
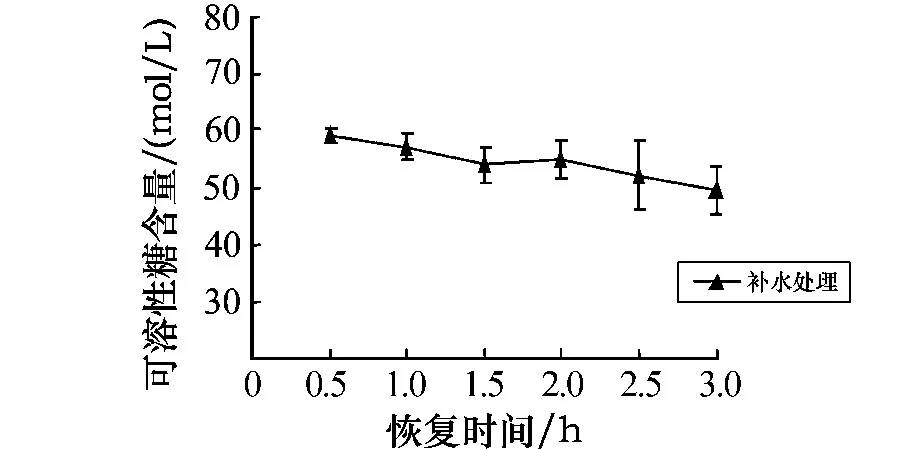
图6 胁迫6 h后可溶性糖含量随不同恢复时间的变化
2.4 丙二醛(MDA)含量的变化
从图7可看出,黑暗条件下的干露胁迫会导致孔石莼体内MDA含量的逐渐上升,且随着处理时间的延长,MDA的积累量不断增加.与对照组相比,随着胁迫时间的延长及膜质过氧化的出现,使得在处理时间为0.5 h时MDA的含量呈极显著差异(P<0.01);在处理时间为2 h和4 h时呈显著差异(0.01<P<0.05);在处理时间为6 h时其含量达到最大值,而且呈极显著差异(P<0.01).胁迫6 h后的补水恢复实验结果如图8所示.图8显示,当恢复时间为1 h时MDA的含量呈显著下降趋势,在2 h时达到最低点,此时MDA的含量为对照组的104%.

图7 丙二醛含量随不同干露时间的变化
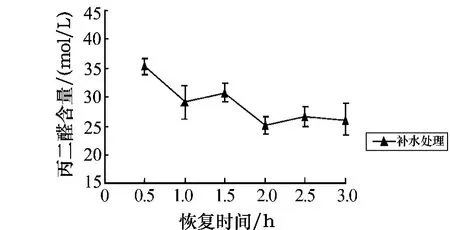
图8 胁迫6 h后丙二醛含量随不同恢复时间的变化
2.5 POD活性的变化
由图9可以看出,随着干露胁迫时间的延长,孔石莼的POD活性呈上升趋势.与对照组相比,在处理时间为0~1 h时,POD活性呈缓慢上升,差异并不显著;当处理时间超过2 h后,POD活性呈明显上升趋势,呈极显著差异(P<0.01).胁迫处理6 h后的补水恢复实验结果如图10所示.由图10可以看出,随着恢复时间的延长,POD活性呈下降趋势,在3h时达到最低,此时POD活性为对照组的415%.

图9 POD活性随不同干露时间的变化
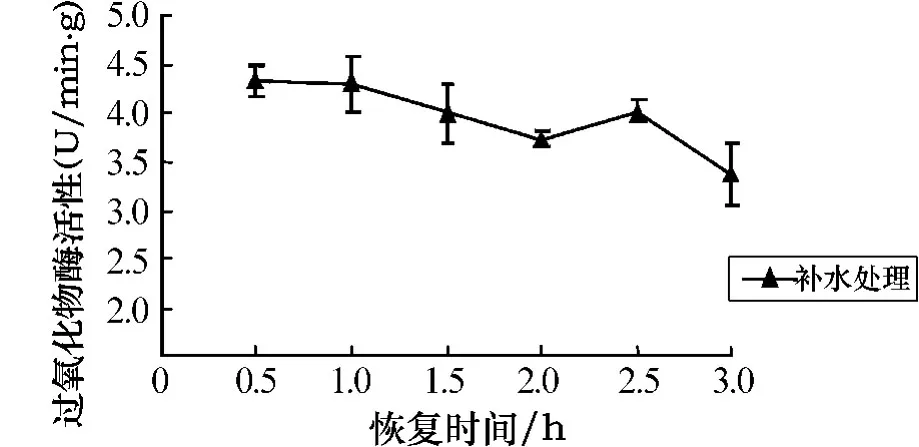
图10 胁迫6 h后POD活性随不同恢复时间的变化
3 讨论
叶绿素是光合作用中最重要和最有效的色素,它能影响植物的生长,其含量在一定程度上能反映植物同化物质的能力[12].在黑暗条件下干露胁迫处理孔石莼并测定其叶绿素a的含量发现,随着胁迫处理时间的延长,叶绿素a的含量随之下降,这主要是由于缺水而造成的[13]:一方面,随着胁迫时间的延长,叶绿素a的破坏程度逐渐增加;另一方面,在黑暗环境下,叶绿素a的合成受阻,这也会导致叶绿素a含量低于对照组,而且随时间的延长其差异越显著.
在干露缺水条件下,增强细胞渗透调节能力的关键是需要主动积累细胞中渗透调节的物质,脯氨酸和可溶性糖是植物中理想的渗透调节物质[14-15].在黑暗条件下经干露胁迫处理后的孔石莼,其脯氨酸和可溶性糖的含量均呈上升趋势,这与赵素达等[16]报道的盐胁迫对孔石莼中脯氨酸含量的影响相似.细胞内渗透势的大小取决于溶质的浓度,脯氨酸和可溶性糖的变化有利于对藻体细胞的渗透调节,从而可以使藻类适应潮间带环境的剧烈变化.
MDA是膜脂过氧化的产物,其含量的高低可反映细胞膜脂过氧化的程度[17].有研究[18]表明,MDA含量会随着干露处理程度的加深而升高,在胁迫初期其含量的上升较慢,但达到一定程度后就会迅速上升.本研究中,MDA含量在处理前期时上升较为缓慢,但处理2 h后呈现显著的上升趋势,这说明经胁迫处理后的孔石莼,其藻体细胞膜可能会遭到不同程度的伤害,并且随着处理时间的延长其伤害会越大;但经复水处理后,可以缓解由胁迫造成的膜的伤害与膜脂过氧化作用的影响,从而使 MDA积累量降低[19].当植物体受到水分胁迫时,可诱导体内POD活性增加,从而起到保护生物膜的作用[20];尽管POD活性显著增加,但在逆境条件下藻体内生成的活性氧仍超过POD等抗氧化酶系的清除能力,使得部分未能清除的活性氧引起膜脂过氧化,表现为MDA含量增加,从而导致一定程度膜系统受到伤害[21].有研究[22]报道,高等植物中 POD 活性在黑暗条件下出现下降,但关于其在藻类中的变化规律及其生理机制还有待进一步研究.
本研究中的孔石莼具有很强的渗透调节能力,在干露胁迫条件下,其藻体细胞内发生了一系列适应生理机制的变化,使其能够降低由胁迫所带来的伤害,从而适应潮间带剧烈的环境变化;各指标在复水后均有不同程度的恢复,但都高于对照组,这可能是因为一定的胁迫会对细胞造成部分不可逆的伤害,即使正常的复水条件也不能完全恢复.在直接光照[9]和黑暗处理的两种不同环境条件下,即使是同样的胁迫处理程度,孔石莼体内的生理变化也表现出一定的差异,但各指标的上升和下降趋势都基本一致,其中黑暗条件所产生的变化更加明显,这对于继续探明潮间带藻类适宜各种环境的生理机制具有重要的意义.
[1]嵇嘉民,马家海,李宇航.孔石莼的同行世代交替[J].渔业现代化,2008,35(2):32-35.
[2]曾呈奎.中国黄渤海海藻[M].北京:科学出版社,2009:395.
[3]邹定辉,阮祚禧,陈伟洲.干出状态下羊栖菜的光合作用特性[J].海洋通报,2004,23(5):33-39.
[4]姜红霞,高坤山.干出和紫外辐射对坛紫菜光合作用的影响[J].自然科学进展,2009,19(8):835-840.
[5]邹定辉,高坤山.低潮干出状态下石莼的光合作用特性[J].植物生理学通讯,2001,37(0):503-506.
[6]刘力,高尚德.失水干燥对紫菜等海藻光合作用、呼吸作用及生长的影响[J].水产学报,1987,11(3):233-240.
[7]吴倩倩,佟少明,侯和胜.干出胁迫对孔石莼生长及生理影响[J].海洋渔业,2011,33(4):472-475.
[8]蔡卓平,危蔚,段舜山.三角褐指藻对黑暗胁迫的生理响应[J].生态科学,2008,27(1):6-11.
[9]李杰,欧丹云,宋立荣.微囊藻衰亡过程研究:四种模拟胁迫条件下微囊藻的衰亡生理[J].湖泊科学,2008,20(5):549-555.
[10]李世国,杨帆,吴倩倩,等.孔石莼在干出胁迫下上调表达基因消减cDNA文库的构建[J].海洋渔业,2011,33(2):172-181.
[11]张志良,瞿伟菁.植物生理学实验指导[M].3版.北京:高等教育出版社,2003:67-70,123-124,258-260,274-276.
[12]姜卫兵,高光林,俞开锦,等.水分胁迫对果树光合光合作用及同化代谢的影响研究进展[J].果树学报,2002,19(6):416-420.
[13]陈少裕,刘杰.干旱胁迫对甘蔗叶片线粒体膜脂流动性及其膜脂过氧化的关系[J].西北农业大学学报,1991,19(1):79-83.
[14]赵雅静,翁伯琦,王义祥,等.植物对干旱胁迫的生理生态响应及其研究进展[J].福建稻麦科技,2009,27(2):45-50.
[15]孙存华,李杨,贺鸿雁,等.藜对干旱胁迫的生理生化反应[J].生态学报,2005,25(10):2556-2561.
[16]赵素达,董树刚,吴以平,等.盐胁迫对孔石莼的生理生化影响[J].海洋科学,2000,24(7):53-55.
[17]夏含嫣,丁明,别蓓蓓,等.黑暗对矮牵牛幼苗叶片抗氧化生理指标的影响[J].上海交通大学学报:农业科学版,2008,26(1):1-4.
[18]Fu J,Huang B.Involvement of antioxidants and lipid peroxidation in the adaptation of two coolseason grass to localized drought stess[J].Exper Bot,2001,45(2):105-114.
[19]刘娟,董宽虎.干旱胁迫及复水处理对白羊草抗旱生理特性的影响[J].草原与草坪,2011,31(2):74-78.
[20]Bowler C,Van Montagu M,Inze D.Superoxide dismutase and stress tolerance[J].Annual Revie wof Plant Physiology & Plant Molecular Biology,1992,43:83-116.
[21]严美玲,李向东,林英杰,等.苗期干旱胁迫对不同抗旱花生品种生理特性、产量和品质的影响[J].作物学报,2007,33(1):113-119.
[22]徐娜,董晓红,关旸,等.低温胁迫下不同光照条件对锦熟黄杨抗氧化酶活性的影响[J].植物研究,2007,27(5):574-577.
Effects of drought exposure on the physiology index of Ulva pertusa in the dark
YANG Fan,LI Shi-guo,TONG Shao-ming,HOU He-sheng*
(CollegeofLifeSciences,LiaoningNormalUniversity;KeyLaboratoryofPlantBiotechnologyof LiaoningProvince,Dalian116081,China)
Some physiological indices including the contents of chlorophyll a,proline,soluble sugar,MDA and the activity of POD ofUlvapertusain the dark under drought exposure stress at different times(0,0.5,1,2,4,6 h)are measured and recorded.The results showed that all the physiological indices measured ascended except for the chlorophyll a by contrast with controling untreatedUlvapertusa,the content of proline and the activity of POD are both ascended sharply after 4 hours treatment among them;all the indexes are recovered in different degrees after stress for 6 hours recovering.It shows that the algae has an ability to adapt drought exposure stress in the dark physiologically and biochemically,and the results provid some references for researchers who study the mechanism of drought exposure resistance.
Ulvapertusa;dark;drought stress;physiological indice
Q954.78
A
1004-4353(2012)01-0054-05
2011-12-17*通信作者:侯和胜(1955—),男,教授,研究方向为海藻发育与分子生物学.
中国科学院实验海洋生物学重点实验室开放基金资助项目(kf-2008023)

