异硒氰酸酯参与合成2-亚胺基-1,3-硒唑-4-酮类化合物的研究
杨 萍 谢媛媛
(浙江工业大学 药学院,浙江 杭州 310014)
硒是人体必需的微量元素,由瑞典化学家Berzeliu于1818年首次发现[1]。有机硒化合物如含硒杂环、硒醚、硒氰等具有抗氧化、抗炎、防癌、抗癌等作用[2],其中依布硒啉、硒唑呋喃和苯基氨乙基硒已用于临床研究,并取得了很好的疗效[3]。此外,硒作为O,S的同主族元素,在药物设计中是O,S的生物电子等排体,含氧及硫元素药物的硒类似物可作为有机硒药物的一大来源。
近年来,由于硒杂环化合物表现出广泛的生物活性,其合成研究受到越来越多的关注[4],开发出了各种硒杂环化合物的合成方法,包括以无机硒及其化合物、硒代酰胺、硒脲、异硒氰酸酯、硒代醛等作为硒的来源,为筛选具有生物活性的有机硒化合物提供了丰富的候选物。
虽然文献报道的含硒杂环化合物丰富多样,但目前只有少数文献报导过硒唑酮的合成方法[5-6],只有两篇文献报导过2-亚胺基-1,3-硒唑-4酮化合物的合成[7-8]。
异硒氰酸酯是在20世纪中期被开发出来的,具有合成简便、低毒、安全、相对稳定、反应性高等优点[9],已广泛应用于硒唑、硒嗪、硒唑酮、硒嗪酮、环噁硒烷等硒氮、硒氧杂环化合物的合成。本文以异硒氰酸酯、苄胺、氯乙酰氯为原料,三乙胺作缚酸剂来合成2-亚胺基-1,3-硒唑-4-酮类化合物(3a~3j,Scheme 1),反应条件温和,只需在室温下搅拌,而且反应后处理简单。在此采用一锅法反应,避免了活泼中间体硒脲的分离,简化了反应操作,提高了反应收率。
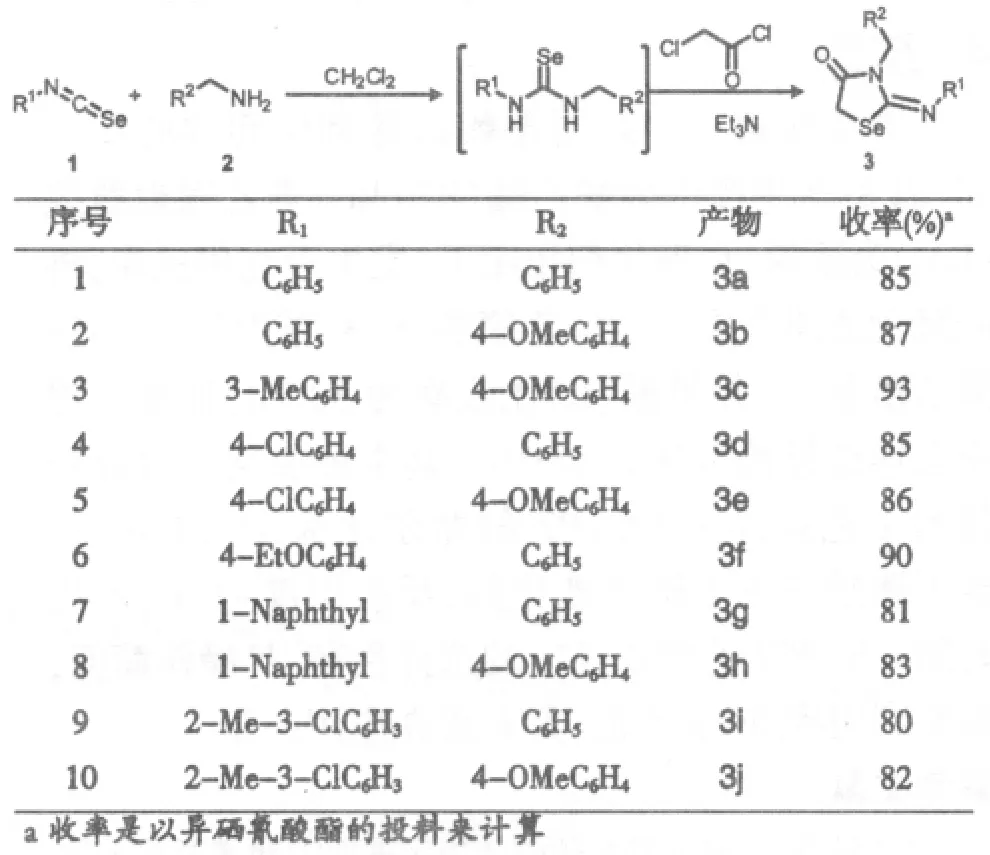
Scheme 1
1 实验部分
1.1 仪器与试剂
仪器为Varian-400 Mercury Plus(400MHz)核磁共振仪,Thermo Finnigan LCQ Advantage(ESI)质谱仪,Nicolet Aviatar-370红外分光光度计,Büchi B-540熔点仪。
原料异硒氰酸酯按文献10制备,其它所用试剂均为市售化学纯。
1.2 合成部分
1.2.1 2-亚胺基-1,3-硒唑-4-酮的合成(以3a为例):
苯基异硒氰酸酯0.182g(1mmol)加入到50mL两口反应瓶中,加入20mL二氯甲烷,开启磁力搅拌,然后加入苄胺0.107g(1mmol),继续搅拌,生成中间体硒脲。TLC监测反应,待原料反应完后,向反应体系中加入三乙胺0.252g(2.5mmol),氯乙酰氯0.112g(1mmol),室温下搅拌反应,TLC监测反应进程。反应结束后,硅胶柱层析纯化(石油醚:乙酸乙酯=4:1),得白色固体3a 0.28g,收率85%。
用类似方法合成3b~3j。
3a:白色固体;收率:85%,M.p.101.1℃~101.9℃;IR(KBr):vmax=2950,1702,1636,1592,1375,1149,1078,756,694cm-1;1H NMR(400MHz,CDCl3):δ=7.49(d,J=6.8Hz,2H,ArH),7.34~7.27(m,5H,ArH),7.13(t,J=7.2Hz,1H,ArH),6.91(d,J=7.6Hz,2H,ArH),5.05(s,2H,CH2),3.83(s,2H,CH2);13CNMR(100MHz,CDCl3):δ=172.8,149.9,149.0,135.9,129.2(CH×2),128.8(CH×2),128.2(CH×2),127.6,124.7,120.3(CH×2),47.7,25.2;ESI-MS:m/z(%)=329(40),331(100,M++1),332(23),333(15).
3b:白色固体;收率:87%,M.p.119.2℃~119.9℃;IR(KBr):vmax=2944,1702,1639,1511,1425,1376,1247,1161,1027,804,693cm-1;1H NMR(400MHz,CDCl3):δ=7.46(d,J=8.4Hz,2H,ArH),7.33(t,J=7.6Hz,2H,ArH),7.14(t,J=7.6Hz,1H,ArH),6.92(d,J=7.2Hz,2H,ArH),6.83(d,J=8.8Hz,2H,ArH),4.98(s,2H,CH2),3.82(s,2H,CH2),3.78(s,3H,OCH3);13CNMR(100MHz,CDCl3):δ=172.8,158.9,149.9,149.0,130.4(CH×2),129.1(CH×2),128.3,124.6,120.3(CH×2),113.5(CH×2),55.2,47.1,25.2;ESI-MS:m/z(%)=359(37),361(100,M++1),363(25),363(10).
3c:白色固体;收率:93%,M.p.85.2℃~86.1℃;IR(KBr):vmax=2946,1704,1640,1613,1512,1374,1318,1250,1173,1033,854,779,697cm-1;1H NMR(400MHz,DMSO-d6):δ=7.31(d,J=8.0Hz,2H,ArH),7.23(t,J=7.6Hz,1H,ArH),6.95(d,J=7.6Hz,1H,ArH),6.89(d,J=8.0Hz,2H,ArH),6.69(d,J=9.2Hz,2H,ArH),4.86(s,2H,CH2),4.07(s,2H,CH2),3.73(s,3H,OCH3),2.29(s,3H,CH3);13CNMR(100MHz,DMSO-d6):δ=172.9,158.3,151.0,148.9,138.5,129.2(CH×2),129.0,128.2,125.0,120.8,117.0,113.5(CH×2),55.0,46.1,25.7,21.0;ESI-MS:m/z(%)=373(50),375(100,M++1),376(20),377(22).
3d:白色固体;收率:85%,M.p.98.8℃~99.7℃;IR(KBr):vmax=2947,1698,1626,1485,1377,1152,1094,833,698cm-1;1H NMR(400MHz,DMSO-d6):δ=7.40(d,J=8.8Hz,2H,ArH),7.33(d,J=4.4Hz,4H,ArH),7.29~7.24(m,1H,ArH),6.90(d,J=8.4Hz,2H,ArH),4.94(s,2H,CH2),4.14(s,2H,CH2);13CNMR(100MHz,DMSO-d6):δ=173.0,152.4,147.7,136.0,129.1(CH×2),128.5,128.1(CH×2),127.4(CH×2),127.1,122.0(CH×2),46.7,26.1;ESI-MS:m/z(%)=363(37),365(100,M++1),367(29,M++3).
3e:白色固体;收率:86%,M.p.160.9℃~162.2℃;IR(KBr):vmax=2943,1705,1636,1511,1375,1248,1160,1029,832cm-1;1H NMR(400MHz,CDCl3):δ=7.44(d,J=8.8Hz,2H,ArH),7.29(d,J=8.8Hz,2H,ArH),6.86(d,J=8.8Hz,2H,ArH),6.83(d,J=8.8Hz,2H,ArH),4.96(s,2H,CH2),3.84(s,2H,CH2),3.78(s,3H,OCH3);13CNMR(100MHz,CDCl3):δ=172.8,159.0,150.8,147.6,130.5(CH×2),130.0,129.3(CH×2),128.1,121.8(CH×2),113.6(CH×2),55.3.47.2,25.4;ESI-MS:m/z(%)=393(41),395(100,M++1),397(37,M++3).
3f:黄色固体;收率:90%,M.p.105.0℃~105.6℃;IR(KBr):vmax=2950,1705,1630,1505,1373,1241,1154,837,700cm-1;1HNMR(400MHz,DMSO-d6):δ=7.33~7.23(m,5H,ArH),6.89(d,J=8.8Hz,2H,ArH),6.81(d,J=8.8Hz,2H,ArH),4.94(s,2H,CH2),4.09(s,2H,CH2),4.01~3.95(m,2H,CH2),1.31(t,J=6.8Hz,3H,CH3);13CNMR(100MHz,DMSO-d6):δ=173.0,155.4,150.8,141.8,136.2,128.1(CH×2),127.4(CH×2),127.1,121.2(CH×2),114.8(CH×2),63.1,46.7,25.7,14.7;ESI-MS:m/z(%)=373(45),375(100,M++1),376(20),377(30).
3g:白色固体;收率:81%,M.p.118.5℃~119.7℃;IR(KBr):vmax=2944,1703,1636,1375,1309,1176,1079,775,702,666cm-1;1H NMR(400MHz,CDCl3):δ=7.79(d,J=8.0Hz,1H,ArH),7.62(d,J=8.0Hz,1H,ArH),7.57~7.53(m,3H,ArH),7.45(t,J=7.2Hz,1H,ArH),7.40~7.29(m,5H,ArH),6.97(d,J=7.2Hz,1H,ArH),5.19(s,2H,CH2),3.86(s,2H,CH2);13CNMR(100MHz,CDCl3):δ=173.0,150.2,145.5,136.0,134.1,128.7(CH×2),128.4(CH×2),127.7(CH×2),127.2,126.3,125.5(CH×2),124.9,123.2,114.0,48.0,25.2;ESI-MS:m/z(%)=377(57),379(65),381(100,M++1),382(24),383(25).
3h:白色固体;收率:83%,M.p.157.2℃~158.0℃;IR(KBr):vmax=2943,1702,1640,1515,1376,1299,1250,1150,1036,800,775,667cm-1;1H NMR(400MHz,CDCl3):δ=7.81(d,J=8.4Hz,1H,ArH),7.65(dd,J1=8.8Hz,J2=11.2Hz,2H,ArH),7.52(d,J=8.4Hz,2H,ArH),7.47(t,J=7.2Hz,1H,ArH),7.41~7.33(m,2H,ArH),6.98(d,J=6.8Hz,1H,ArH),6.88(d,J=8.4Hz,2H,ArH),5.13(s,2H,CH2),3.85(s,2H,CH2),3.82(s,3H,OCH3);13CNMR(100MHz,CDCl3):δ=173.1,159.1,150.4,145.7,134.2,130.5(CH×2),128.3,127.7,127.2,126.3,125.5(CH×2),124.9,123.3,114.2,113.7(CH×2),55.3,47.5,25.3;ESI-MS:m/z(%)=409(40),411(100,M++1),412(25),413(20).
3i:白色固体;收率:80%,M.p.68.8℃~70.1℃;IR(KBr):vmax=2944,1704,1636,1560,1372,1150,1011,755,715,698cm-1;1H NMR(400MHz,CDCl3):δ=7.44(d,J=6.4Hz,2H,ArH),7.32~7.23(m,3H,ArH),7.14(d,J=8.0Hz,1H,ArH),7.05(t,J=8.0Hz,1H,ArH),6.70(d,J=7.6Hz,1H,ArH),5.05(s,2H,CH2),3.87(s,2H,CH2),2.04(s,3H,CH3);13C NMR(100MHz,CDCl3):δ=172.7,150.4,148.9,135.7,135.1,128.5(CH×2),128.2(CH×3),127.6,126.8,125.4,117.5,61.3,47.7,25.4;ESI-MS:m/z(%)=377(32),379(100,M++1),381(30,M++3).
3j:白色固体;收率:82%,M.p.129.5℃~130.2℃;IR(KBr):vmax=2946,1706,1640,1515,1372,1296,1252,1151,1032,819,784cm-1;1H NMR(400MHz,CDCl3):δ=7.43(d,J=8.8Hz,2H,ArH),7.15(d,J=8.0Hz,1H,ArH),7.06(t,J=8.0Hz,1H,ArH),6.83(d,J=8.8Hz,2H,ArH),6.71(d,J=7.6Hz,1H,ArH),4.99(s,2H,CH2),3.86(s,2H,CH2),3.79(s,3H,OCH3),2.10(s,3H,CH3);13CNMR(100MHz,CDCl3):δ=172.8,159.0,150.6,149.0,135.1,130.2(CH×2),128.1,128.0,126.8,125.4,117.6,113.6(CH×2),55.2,47.2,25.5,14.8;ESI-MS:m/z(%)=405(45),407(100,M--1),409(41,M-+2).
2 结果与讨论
在研究2-亚胺基-1,3-硒唑-4-酮的合成路线时,以苯基异硒氰酸酯为原料,与苄胺在室温下反应生成中间体硒脲,然后与氯乙酰氯反应生成目标化合物,首先考察乙酸乙酯、甲醇、乙醇、丙酮、四氢呋喃(THF)、乙腈、二氯甲烷、氯仿等溶剂以及反应温度、反应时间对反应收率的影响,其结果如表1所示。
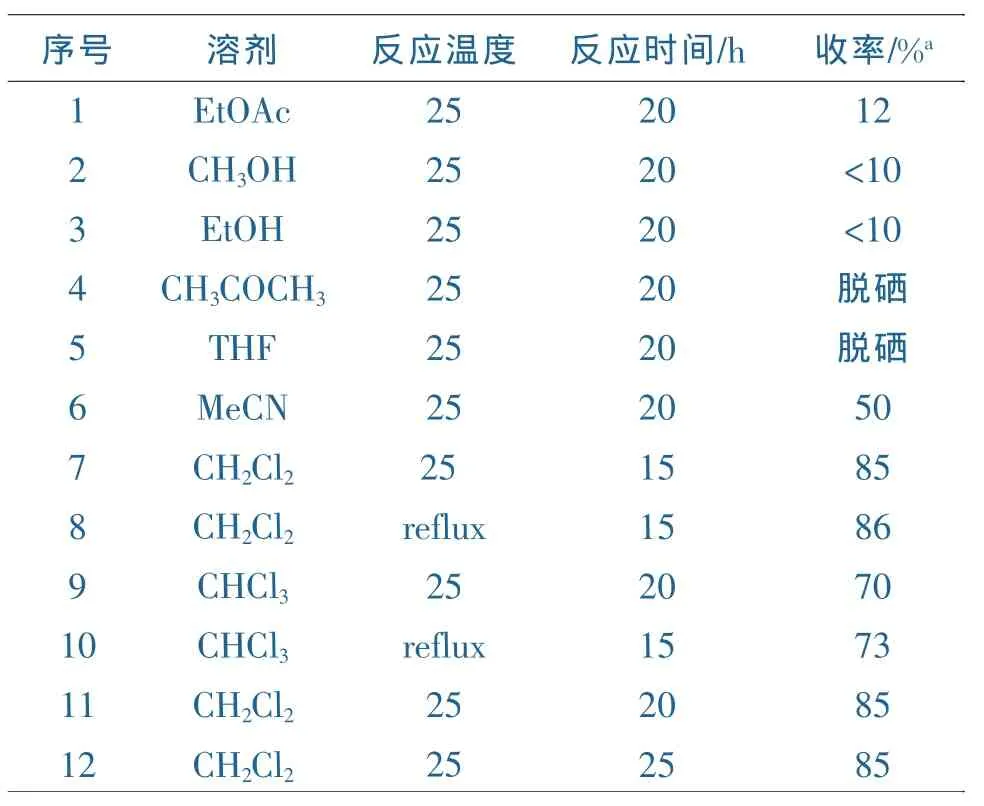
表1 反应条件优化
如表1所示,以3a制备为例,当采用乙酸乙酯、甲醇、乙醇为溶剂时,25℃条件下,只有非常少的目标产物生成;当采用丙酮、THF为溶剂时,反应过程中观测到脱硒现象,可能是由于中间体硒脲在这些溶剂中不稳定;当采用卤代溶剂如氯仿、二氯甲烷为溶剂时,反应结果比较理想,但是在室温下反应时,氯仿需要更长时间(20h),收率只有70%,即使回流反应15h,收率也只达73%。二氯甲烷为最优溶剂,25℃反应收率已达85%,升高反应温度,在回流条件下反应15h收率没有明显的改变;同时延长反应时间对反应收率的影响也不大。所以最佳反应温度为25℃,最佳反应时间为15h。
在最优溶剂确定后,对缚酸剂也进行了筛选,选取碳酸钠、碳酸氢钠(钾)、乙酸钠、三乙胺、二异丙基乙基胺(DIPEA)和哌啶等碱为候选敷酸剂,实验结果见表2。
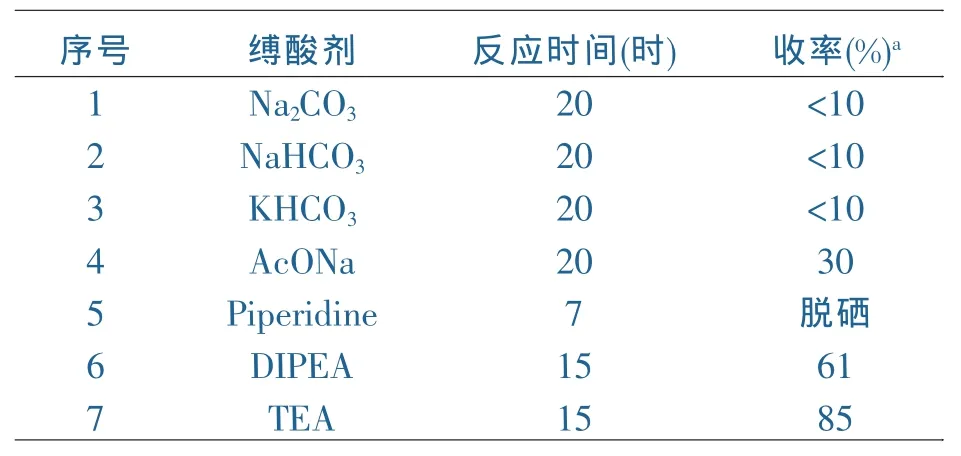
表2 缚酸剂的选择
如表2所示,最优敷酸剂为三乙胺。采用碳酸钠和碳酸氢钠(钾)等无机碱为敷酸剂,反应结果不理想,收率都低于10%;采用弱碱醋酸钠为缚酸剂,反应收率有所提高;采用哌啶作为敷酸剂时,出现脱硒现象;采用DIPEA时,收率有明显提高,但和三乙胺相比,仍然有差距。
通过对2-亚胺基-1,3-硒唑-4-酮化合物的合成反应中反应溶剂、反应温度、时间及缚酸剂做了系统研究后,本文提出了该反应的可能历程(Scheme 2)。
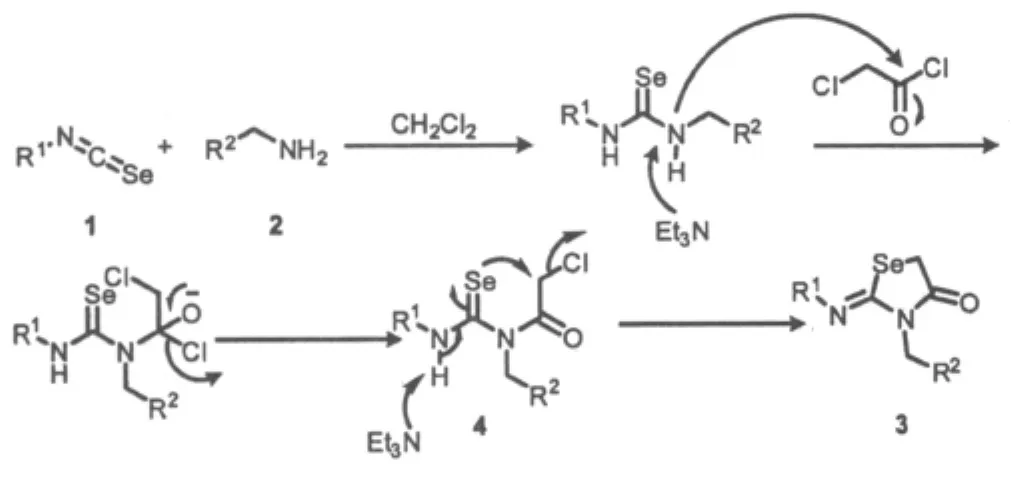
Scheme 2
反应在25℃下进行,首先异硒氰酸酯与1当量苄胺反应生成硒脲中间体,不经分离纯化,硒脲在碱性条件下,与烷基相连的N原子首先进行氯乙酰氯的羰基碳原子,脱去一分子氯化氢生成中间体4,中间体4在碱性条件下经环化反应再脱去一分子氯化氢最终得到化合物3。由反应历程可得出2-亚胺基-1,3-硒唑-4-酮的生成至少需要2当量的碱来中和所生成的酸。
3 结论
本文报导了异硒氰酸酯、苄胺和氯乙酸乙酯的一锅法反应,合成了一系列新型2-亚胺基-1,3-硒唑-4-酮化合物,该方法具有反应条件温和,操作简便,收率高,都在80%以上,以及对环境友好等优点,所合成的化合物为筛选具有生物活性的有机硒杂环化合物提供了更多新的候选物,有较好的应用前景。
参与文献:
[1]Sunde R A.Selenium In:Handbook of nutritionally essentialmineral element(Eds.B.L.O'dell&R.A.Sunde)[M].Marcel Dekker,Inc.,New York,1997,483-556.
[2]黄静,黄克和.硒的生物学特性与奶牛营养需要的研究进展[J].畜牧与兽医,2010,42:103.
[3]Nogueira C W,ZeniG.Organoselenium and organotellurium compounds:toxicology and pharmacology[J].Chem.Rev,2004,104:6255-6286.
[4]Koketsu M,Ishihara H.Thiourea and selenourea and their applications[J].Curr.Org.Syn.,2006,3:439.
[5]Koketsu M,Sasaki T,Ando H,et al.Preparation of 4,5-dihydro-1,3-selenazoles by reaction of aromatic primary selenoamides with acetylenedicarboxylate[J].J.Heterocycl.Chem.,2007,44:231.
[6]Koketsu M,Sakai T,Kiyokuni T,et al.One-pot synthesis of 2-amino-1,3-selenazolidines by reaction of isoselenocyanates with propargylamine[J].Heterocycles,2006,68:8.
[7]Koketsu M,Nada F,Ishihara H.Facile Preparation of 2-imino-1,3-selenazolidin-4-one derivatives by reaction of N,N'-disubstituted selenoureas with a-haloacyl halides[J].Synthesis,2002:195.
[8]Yuanyuan X,Junli L,Jianjun L.Selective synthesis of novel 2-imino-1,3-selenazolidin-4-ones and 2-amino-1,3,4-selenadiazin-5-ones from isoselenocyanates[J].Tetrahedron Lett.,2011,52:932.
[9]Sukata K.Alkylsilyl isoselenocyanate.A new silicon pseudohalide.Synthesis,characterization,and reaction with carbonyl compounds[J].J.Org.Chem.,1989,54:2015.
[10]Fernández-J G,López ó,Ulgar V,et al.Synthesis of O-unprotected glycosyl selenoureas.A new access to bicyclic sugar isoureas[J].Tetrahedron Lett.,2004,45:4081.

