绍兴黄酒麦曲制曲过程的宏蛋白质组学研究*
张波,管政兵,谢广发,陆健,余培斌
1(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)2(江南大学生物工程学院,江苏无锡,214122)3(浙江古越龙山绍兴酒股份有限公司,浙江 绍兴,312000)
麦曲在黄酒酿造中占有极重要的地位,其质量的优劣,直接影响着黄酒的产量和质量,因此麦曲又有“酒之骨”的美誉[1]。传统的黄酒酿造采用的是自然固态发酵培养的生麦曲,以小麦为原料,通过网罗自然界中微生物,在堆放车间中进行自然接种,使附着在小麦表面的微生物生长繁殖并代谢产生各种代谢产物[2-3]。制曲过程也就是在微生物的参与下,发生着一系列的生物化学变化的过程。通常整个制曲过程根据麦曲品温的变化分为6个阶段:起始期(麦曲制作成型后堆放在曲房的第1天),发酵前期(麦曲进入曲房的第2天),升温期(第3天,微生物大量繁殖并开始产热,麦曲品温逐渐上升),高温期(第4天,麦曲品温达到最高温度51~55℃,耐热性差的微生物因高温环境而失活死亡,而一些霉菌则停止生长,产生孢子),降温期(第5~7天,及时的开窗通风措施使得麦曲品温逐渐回落),成熟期(培养至25~30天,麦曲品温与室温相近,麦曲中水分含量逐渐降低,微生物停止生长,麦曲已结成硬块,即已成熟)。由于麦曲品温和水分含量的变化,不同时期麦曲中参与发酵的微生物不同,所参与的反应以及产酶情况也有所不同[3-5]。
目前对黄酒麦曲制曲过程的研究,一般多是通过酶活力的测定来研究制曲过程中主要水解酶系的活力变化,而对于这些同功酶的构成及其来源等,往往不能进行全面而有效的分析[6]。在麦曲制曲过程中微生物群落的动态变化研究方面,目前主要是利用传统的分离培养鉴定结合分子生态学方法,如核糖体内转录间隔区序列分析(RISA)、变性梯度凝胶电泳(DGGE)[7-9]。然而,利用这些方法所获得的研究结果无法将麦曲中存在的特定微生物与其分泌的特定胞外酶联系起来,从而达到深入理解黄酒麦曲固态发酵机理的目的。近几年来迅速发展起来的宏蛋白质组学理论和技术将可能解决这一问题。
目前主要应用于环境微生物生态系统研究的宏蛋白质组学,其定义是运用蛋白质组学技术对微生物群落进行研究的一项新技术,是从微生物群落的所有蛋白质水平上直观揭示复杂生态系统中微生物的功能及其变化[10-11]。本研究利用宏蛋白质组学的理论和方法,将麦曲样品浸提液中所有可溶性蛋白定义为待研究的“宏蛋白质组”,对麦曲制曲过程中的宏蛋白质组动态变化情况进行分析,所获得的研究结果将有助于深入理解麦曲发酵过程机理。
1 材料与方法
1.1 材料
1.1.1 实验材料
2010年夏秋,在绍兴某黄酒厂制曲车间跟踪两批麦曲在制曲过程中的温度和水分含量变化,分别采集第1天(起始期)、第2天(发酵前期)、3天(升温期)、4天(高温期)、6天(降温期)和30天(成熟期)的麦曲,作为制曲过程中6个典型时期样品[12]。
1.1.2 实验试剂
琼脂糖、溴酚蓝、二硫苏糖醇(DTT)、碘乙酰铵(IAA)、固相 IPG 干胶条(18cm,pH3~10,非线性)、IPG缓冲液(pH3 ~10,非线性)、3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸(CHAPS)、N,N,N’,N’-四甲基乙二胺(TEMED)、尿素,为GE公司产品。IPG覆盖液、RCDC蛋白定量试剂盒,为Bio-Rad公司产品。Complete蛋白酶抑制剂混合片,为Roche公司产品。丙烯酰胺、甲叉双丙烯酰胺、十二烷基磺酸钠(SDS)、过硫酸铵、考马斯亮蓝G-250、考马斯亮蓝R-250,为上海生工进口分装产品。甲醇、正丁醇、甘油、冰醋酸、磷酸、三氯乙酸(TCA)、三羟甲基氨基甲烷(Tris)、甘氨酸、丙酮、乙酸钠、牛血清白蛋白,均为国产分析纯产品。
1.1.3 实验仪器
等电聚焦电泳仪Ettan IPGphor 3、Ettan DALTsix垂直电泳系统和ImageScanner扫描仪,均为GE公司产品;CR22G型高速冷冻离心机,日本日立公司;Pico&Fresco17微量高速冷冻离心机,Thermo公司;UV-2100型紫外可见分光光度计,尤尼柯仪器有限公司;脱色摇床TS-1,海门市其林贝尔仪器公司。
1.1.4 溶液配制
样品水化液:尿素4.8 g,CHAPS 0.4 g,IPG 缓冲液50 μL,加入双蒸水至总体积为10 mL(使用前加入50 mmol/L DTT)。
平衡液 I:尿素 72.07 g,SDS 4.0 g,1.5 mol/L Tris-HCl 6.7 mL(pH 8.8),甘油69 mL,1%溴酚蓝贮存液400 μL,加入双蒸水至200 mL,使用前每10 mL加入DTT 100 mg。
平衡液 II:尿素 72.07 g,SDS 4.0 g,1.5mol/L Tris-HCl 6.7 mL(pH 8.8),甘油69 mL,1%溴酚蓝贮存液400 μL,加入双蒸水至200 mL,使用前每10 mL加入IAA 250 mg。
1.2 方法
1.2.1 样品制备
(1)麦曲浸提液的制备:称取25 g麦曲,加入50 mL 0.1 mol/L乙酸-乙酸钠缓冲溶液(pH 4.2)和1片Complete蛋白酶抑制剂混合片,在4℃条件下浸提过夜。然后依次用4层纱布过滤,滤液在12 000 r/min,4℃条件下离心30 min,上清液即为麦曲浸提液。Bradford 法测定蛋白含量[13]。
(2)TCA-丙酮法沉淀蛋白:取一定量的麦曲浸提液,加入4倍体积的预冷丙酮溶液I(含20 mmol/L DTT,10%TCA),摇匀,-20℃放置3 h 沉淀蛋白,之后4℃,12 000 r/min离心30 min。弃上清液,收集沉淀。加入2 mL预冷的丙酮溶液II(含20 mmol/L DTT),-20℃放置 1 h,清洗沉淀,4℃,12 000 r/min离心15 min。重复清洗2次。弃上清液,收集沉淀,然后置于-20℃冰箱中,使丙酮完全挥发。
(3)沉淀溶解:将干燥好的蛋白质沉淀加入适量的样品水化液,室温下充分溶解,然后于12 000 r/min离心10 min,上清液即为麦曲宏蛋白质组样品。RC-DC蛋白定量试剂盒测定蛋白含量。
1.2.2 双向电泳实验分析[14]
按照GE公司《双向电泳操作手册》进行水化上样和等电聚焦。吸取350 μL麦曲样品水化液加入到胶条再泡胀盘中,取长度为18 cm,pH 3~10非线性的IPG干胶条水平放入其中,加入少量IPG覆盖液,水化12 h。水化过夜后的胶条转移到Ettan IPGphor胶条槽中,进行等电聚焦。等电聚焦程序设置为:Step,50V×2 h;Gradient,150V × 2 h;Gradient,250V × 2 h;Gradient,500V × 2 h;Gradient,1 000V ×2 h;Gradient,5 000V ×2 h;Gradient,10 000V ×2 h;Step,10 000V ×40 000Vh。
等电聚焦结束后,立即进行平衡。采用两步平衡法,先将IPG胶条放入平衡液I中,在水平摇床上平衡15 min,再使用平衡液II进行第2步平衡,在摇床上平衡15 min。
平衡后进行第二向SDS-PAGE电泳,分离胶浓度为12.5%(26 cm ×21 cm ×1 mm)。将平衡后的IPG胶条转移到已聚合的聚丙烯酰胺凝胶胶面顶端,用0.5%的琼脂糖封闭,排除胶条与胶面之间的气泡。以恒功率方式进行电泳:2 W/根胶条,1.5 h,然后调至16 W/根胶条。
凝胶染色、脱色:剥离凝胶,置于固定液(50%乙醇,10%乙酸)固定1h后,换到考马斯亮蓝染色液(0.025%考马斯亮蓝R-250,25%乙醇,10%乙酸)中染色4 h,换脱色液(10%甲醇,10%乙酸)中脱色,直至背景为无色透明,蛋白点清晰为止。
1.2.3 凝胶扫描及图谱分析[15]
完成染色的双向电泳凝胶经过Image ScannerIII凝胶成像系统扫描并保存图像,图像使用PDQuest软件进行对比分析。所有图像选择自动找点模式,并手动校正以去除背景噪音和横纵条纹。对不同时期的麦曲浸提液的双向电泳图谱进行匹配和比对分析,并对蛋白点的定量值进行标准化处理。定量差异≥2倍认定为差异蛋白点。
1.2.4 质谱鉴定及数据库搜索[16]
挖取差异蛋白点送往上海博苑生物科技公司蛋白质组技术中心进行进行串联质谱(MALDI-TOF/TOF MS)分析,获得的质谱分析结果再利用Mascot在线服务器(http://www.matrixscience.com/)以美国国立生物技术信息中心GenBank的总蛋白质数据库(NCBInr)进行检索。
2 结果与讨论
2.1 麦曲制曲过程中水分含量和温度的变化情况
小麦经过碾碎、加水拌曲、压制成型、堆曲培养和通风干燥之后得到成品麦曲。在麦曲的生产过程中,工厂主要是通过控制制曲过程的麦曲品温来控制麦曲的质量。制曲过程中水分、温度的变化曲线如图1所示。
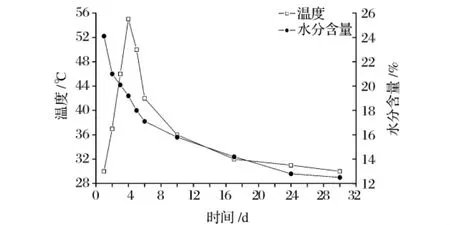
图1 制曲过程中水分含量和温度的变化曲线
从图1中可以看出,小麦经过轧碎拌水成型后,进入曲房,及时的关窗措施和稻草覆盖造成相对封闭的环境,随着麦曲水分的逐步挥发以及麦曲中微生物的生理代谢开始活跃,放出大量的热,于第4天达到麦曲中最高品温(55℃)。在这个高温下,一些微生物被淘汰,霉菌基本停止生长,开始产生孢子。此后采用开窗等降温措施,麦曲品温逐渐回落,在曲块成型堆放的第1周,麦曲品温一直维持在37℃以上。此后麦曲品温逐渐降低,在麦曲制作结束时,品温接近室温。制曲过程中麦曲中的水分一直在减少,从最初的24.0%降至12.4%左右,这时麦曲中微生物已完全停止生长。黄酒麦曲在成型堆放过程中合适的水分和品温,为麦曲中微生物的生长及代谢产酶提供了条件。根据制曲过程中麦曲品温发生显著变化时间点的情况,分别选择固态发酵第1、2、3、4、6及30天的麦曲作为制曲过程的6个典型时期样品,进行麦曲浸提液的宏蛋白质组学研究。
2.2 麦曲制曲过程中不同时期浸提液的宏蛋白质组样品的双向电泳图谱分析
绍兴黄酒麦曲制曲过程中6个不同时期的麦曲浸提液经过TCA-丙酮处理后获得宏蛋白质组样品,每个时期蛋白样品的上样量均控制在~550 μg左右,使用长度为18 cm,pH 3~10非线性的IPG胶条进行双向电泳实验,获得了分辨率较高的双向电泳图谱(见图2)。
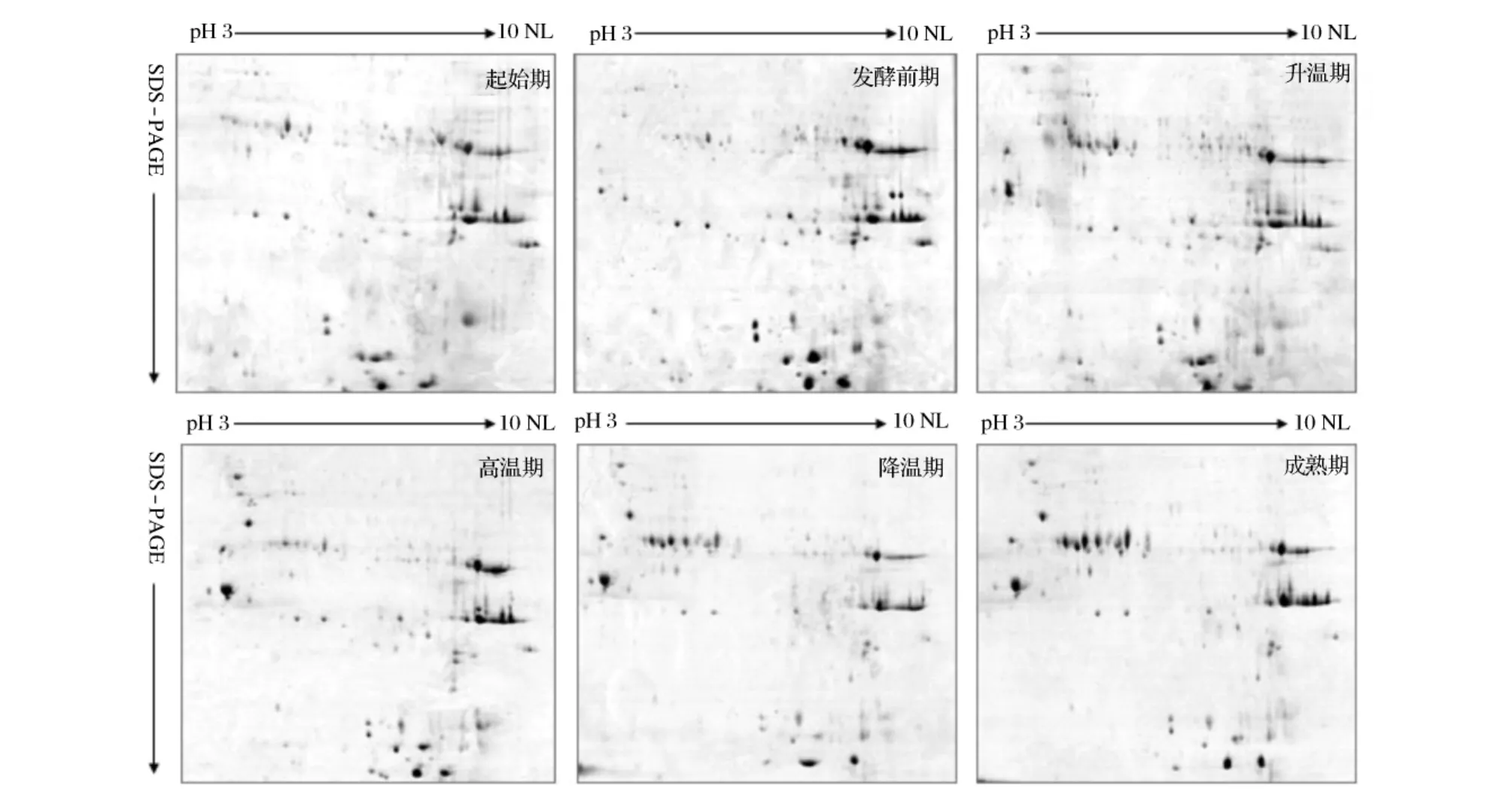
图2 绍兴黄酒麦曲制曲过程中不同时期的双向电泳图谱
应用PDQuest软件对制曲过程中6个不同时期的电泳图谱进行蛋白点检测,分别检测到了89、102、110、105、97及100个清晰且重复度高的蛋白质点。对以上6个时期蛋白质点的表达丰度(根据蛋白质点的相对体积自动生成的数量值)进行差异检测,共找到12个差异蛋白点(见图3及表1),其中差异蛋白点1-7的局部放大图见图4。
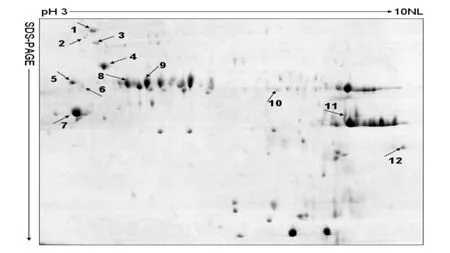
图3 绍兴黄酒麦曲成熟期样品的双向电泳图谱上差异蛋白点

图4 麦曲制曲过程中不同时期的双向电泳图谱中部分差异蛋白点的放大图
对制曲过程中差异表达量变化在2倍以上的12个差异蛋白,按照表达丰度的变化可分为3类:第1类是随着制曲过程,蛋白质表达量逐渐上升(蛋白点编号为5、7、9和10);第2类是制曲过程中蛋白表达量先上升后下降(蛋白点编号为1、2、3、4、6 和 8);第3类是制曲过程中蛋白表达量逐渐降低(蛋白点编号为11和12)。
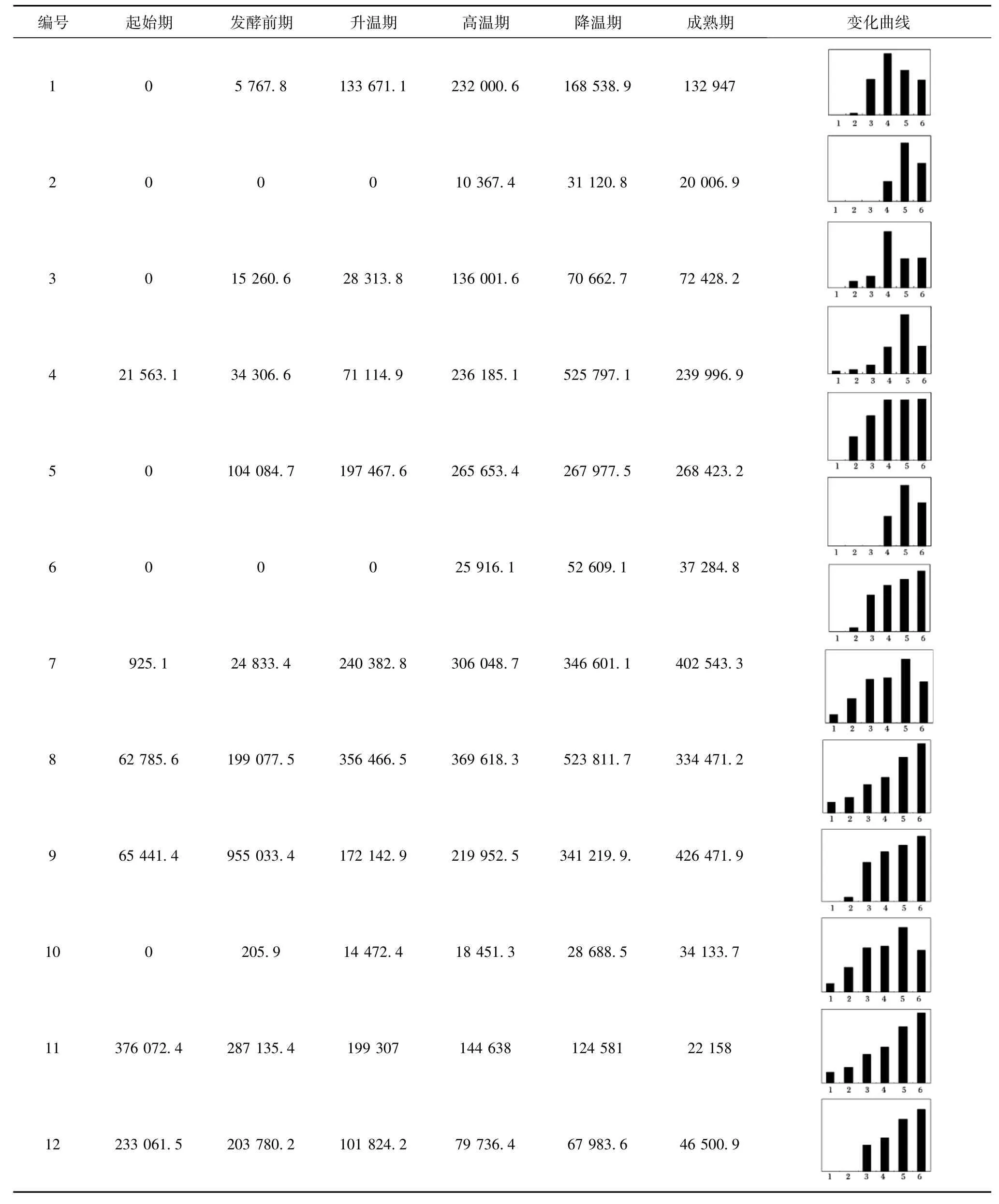
表1 制曲过程中12个差异蛋白点的表达丰度值及变化曲线
2.3 差异蛋白点的质谱鉴定结果
在成熟期样品的双向电泳凝胶上挖取这12个差异蛋白点进行串联质谱分析,质谱分析所得数据通过Mascot在线软件,对NCBI蛋白质总库进行检索。共有7个蛋白点鉴定成功,鉴定结果列于表2。
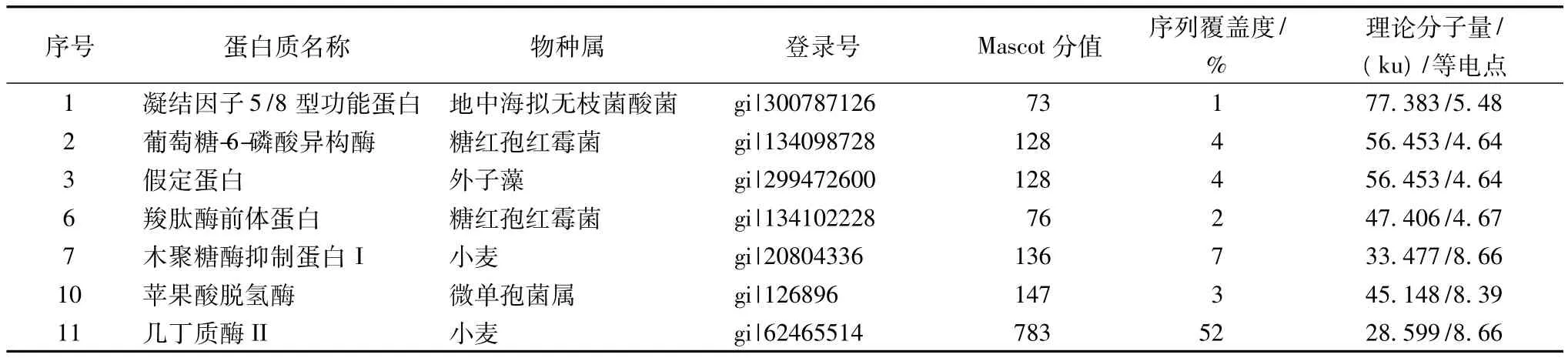
表2 绍兴黄酒麦曲制曲过程中不同时期差异蛋白点的MALDI-TOF/TOF MS鉴定结果
由表2可见,鉴定得到的7种蛋白中来自微生物的蛋白有4种,分别是来自地中海拟无枝菌酸菌产生的凝结因子5/8型功能蛋白和微单孢菌属产生的苹果酸脱氢酶,以及糖红孢红霉菌产生的葡萄糖-6-磷酸异构酶和羧肽酶前体蛋白。小麦来源的蛋白有2种,分别是木聚糖酶抑制蛋白I和几丁质酶II。此外还有一种外子藻来源的功能未知的假定蛋白。
从鉴定结果来看,麦曲中存在多种微生物参与各种生物化学反应,这也进一步证实了制曲过程是多菌种参与发酵的过程。其中糖红孢红霉菌分泌的葡萄糖-6-磷酸异构酶主要催化糖酵解中葡萄糖-6-磷酸与果糖-6-磷酸的可逆转化。微单孢菌属分泌的苹果酸脱氢酶,它催化柠檬酸循环(三羧酸循环)中苹果酸与草酰乙酸之间的可逆转换。他们都与丙酮酸、乳酸、苹果酸、柠檬酸、琥珀酸等黄酒风味物质的代谢有着一定的关系[17]。羧肽酶前体蛋白最终生成羧肽酶,羧肽酶是一类肽链端水解酶,作用于肽链的游离羧基末端释放单个氨基酸,在黄酒发酵过程中与酸性蛋白酶共同作用于糯米中的蛋白质产生游离的氨基酸,能赋予黄酒特有的风味[18]。稀有细菌地中海拟无枝菌酸菌分泌的凝结因子5/8型功能蛋白在细胞表面识别、信号转导过程中起着重要作用。
同时麦曲的浸提液中还存在着小麦相关的蛋白如木聚糖酶抑制蛋白和几丁质酶等。木聚糖酶抑制剂存在于多种谷物中,如小麦、黑麦、大麦、玉米等。谷物中的木聚糖酶抑制剂仅对微生物来源的木聚糖酶有活性,而与植物内源性木聚糖酶不发生作用,因此它们被看作植物防御外来致病性侵害的屏障[19]小麦种子中包含3类木聚糖酶抑制剂:TAXI、XIP、TLXI。在黄酒麦曲中鉴定出的木聚糖酶抑制剂为TAXI。TAXI仅存在于小麦种子中,它对真菌和细菌木聚糖酶均具有抑制作用,但仅限于G/11家族木聚糖[20]。几丁质酶是一类复合酶,主要水解几丁质多聚体中的β-1,4-糖苷键,产生N-乙酰氨基葡萄糖寡聚体,许多微生物、动物、植物等都可产生几丁质酶。高等植物的细胞中本身不含几丁质,但当植物受到真菌、细菌或病毒等的感染时,几丁质酶的活性迅速提高。植物产生的几丁质酶大部分为第19族糖基化水解酶类,其功能主要是抑制病原微生物的生长,进行自我防御,是重要的病程相关蛋白[21-22]。木聚糖酶抑制剂和几丁质酶在麦曲固态发酵和黄酒发酵发酵过程中的具体作用,目前还未见相关报道。
以小麦为原料,采用天然的固态发酵方式生产麦曲是黄酒酿造中的关键环节,麦曲质量的好坏对于黄酒的酿造具有举足轻重的作用,但目前对于麦曲在固态发酵过程中许多机理性问题尚不清楚。本研究中首次借助宏蛋白质组学的理论和方法对绍兴黄酒麦曲制曲过程中不同时期的麦曲浸提液进行了宏蛋白质组学研究,包括通过双向电泳分离宏蛋白质组样品、利用PDQuest软件分析不同时期样品的差异蛋白点以及对差异蛋白点进行质谱分析鉴定,所获得的研究结果将有助于理解麦曲固态发酵生产过程的机理。
[1] 顾国贤.酿造酒工艺学(第2版)[M].北京:中国轻工业出版杜,2007:471-483.
[2] 汪建国.小麦制曲在传统黄酒酿造中的工艺探讨[J].中国酿造,2003(5):20-22.
[3] 汪建国.传统麦曲在黄酒酿造中的作用和特色[J].中国酿造,2004(10):29-31.
[4] 谢广发.黄酒酿造技术[M].北京:中国轻工业出版杜,2010:42-59.
[5] 傅祖康,杨国军.黄酒生产200问[M].北京:化学工业出版社,2010:49-55.
[6] 王璐.黄酒麦曲中淀粉酶的分离纯化及其性质研究[D].无锡:江南大学,2007.
[7] 方华.绍兴黄酒麦曲中真菌资源的初步研究[D].无锡:江南大学,2006.
[8] 李旺军.绍兴黄酒麦曲中微生物的初步研究[D].无锡:江南大学,2007.
[9] 陈建尧.绍兴黄酒麦曲品质及其影响因素的研究[D].无锡:江南大学,2008.
[10] Wilmes P,Bond PL.Metaproteomics:studying functional gene expression in microbial ecosystems[J].Trends Microbiol,2006,14(2):92 -97.
[11] Maron PA,Ranjard L,Mougel C,et al.Metaproteomics:a new approach for studying functional microbial ecology[J].Microb Ecol,2007,53(3):486 -493.
[12] 赵光鳌.黄酒生产分析检验[M].北京:轻工业出版社,1987:27-38.
[13] Oda K,Kakizono D,Yamada O,et al.Proteomic analysis of extracellular proteins from Aspergillus oryzae grown under submerged and solid-state culture conditions[J].Appl Environ Microbiol,2006,72(5):3 448 -3 457.
[14] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976(72):248-254.
[14] R J辛普森.蛋白质与蛋白质组学实验指南[M].北京:化学工业出版社,2006:131-174.
[15] 陈捷.农业生物蛋白质组学[M].北京:科学出版社,2009:104-123.
[16] 薛庆中.DNA和蛋白质序列数据分析工具[M].北京:科学出版社,2009:117-129.
[17] 寿虹志,凌志勇,杨旭,等.浅析黄酒麦曲中微生物与黄酒风味的关系[J].中国酿造,2007(8):55-57.
[18] 汪建国.黄酒中色、香、味、体的构成和来源浅析[J].中国酿造,2004(4):6-10.
[19] Evi C,Kurt G,Johan R,et al.Variability of polymorphic families of three types of xylanase inhibitors in the wheat grain proteome [J].Proteomics,2008,8(8):1 692-1 705.
[20] Evi C,Kurt G,Nikkie L,et al.The three classes of wheat xylanase-inhibiting proteins accumulate in an analogous way during wheat ear development and germination[J].Journal of Plant Physiology,2009,166(12):1 253-1 262.
[21] 熊国如,杨本鹏,王俊刚,等.植物几丁质酶研究进展[J].安徽农业科学,2010,38(22):11 685-11 688.
[22] 张志忠,吴菁华,吕柳新.植物几丁质酶及其应用研究进展[J].福建农林大学学报:自然科学版,2005,34(4):294-299.

