糙米蛋白及其酶解产物对喂食高脂饲料叙利亚金仓鼠脂质代谢的影响
张慧娟,Wally Yokoyama,张晖
1(江南大学食品学院,江苏无锡,214122)2(美国农业部西部研究所,加利福尼亚,阿尔巴尼,94710)
动脉粥样硬化是世界范围内导致人类死亡的主要原因之一,它的作用机制并不清楚,但是各式各样的动物实验模型为我们近一步了解动脉粥样硬化的发病机理提供了很好的平台。兔子、大鼠、小鼠仓鼠、猪及其非人类的灵长类动物都已经被用于动脉粥样硬化的研究[1]。尽管没有一种动物模型与人体内脂质代谢过程完全吻合,但是大部分动物模型都对高脂高胆固醇的喂食有很好的反应。叙利亚金仓鼠(Mesocricetus auratus)具有胆固醇酯转移酶和与人体相似的脂蛋白组成,以及对高脂高胆固醇饲料的敏感性,已经被广泛用于脂质代谢的研究[2-4]。
膳食蛋白可降低人体内胆固醇含量以防止动脉粥样疾病得到越来越多的重视[5]。许多研究表明,膳食蛋白及其酶解产物具有降低胆固醇活性的作用。如:大豆蛋白及其酶解产物[6-8];牛乳球蛋白及其酶解产物等[9];向日葵蛋白及其水解产物等[10]。Yang等报道了大米蛋白降低胆固醇的作用[11],但是对于糙米蛋白及其酶解产物的降低胆固醇的作用鲜有报道。
糙米是去掉外壳后的全米粒,它含有皮层、糊粉层和胚芽等。与精米相比较,它含有更丰富的维生素、矿物质及膳食纤维。本实验以叙利亚金仓鼠为动物模型,以酪蛋白为对照组,研究糙米蛋白及其水解产物对动物脂质代谢的影响。
1 材料与方法
1.1 材料
1.1.1 主要材料
黄油,Odell公司;玉米油,Sunny Select公司;鱼油,Sigma公司;胆固醇,Sigma公司;纤维素,Dyete公司;酪蛋白,Dyete公司;玉米淀粉,Buffalo公司;DL-蛋氨酸,ICN公司;酒石酸氢胆碱,Dyete公司;L-赖氨酸,GNC公司;L-脯氨酸,Sigma公司;维他命混合物,Dyete公司;无机盐混合物,Dyete公司;Tirtonx-100,Calbiochem公司;甘油三酯试剂盒,Genzyme公司;总胆固醇试剂盒,Wako Chemicals公司;游离胆固醇试剂盒,Wako Chemicals公司;总胆汁酸试剂盒,Diazyme公司。
1.1.2 主要仪器
日立L-8800氨基酸分析仪,日立公司;MACRO cube CNS定氮仪,Elementar analysensyteme公司;Agilent 1100高效液相色谱仪,Agilent公司;快速脂肪提取仪,Dionex公司;Nanodrop 2000 C分光光度计,Thermo Scientific公司;冷冻干燥机,Labconco公司;CRP离心机,Beckman公司;恒温水浴锅,Rechert公司。
1.2 实验方法
1.2.1 糙米蛋白的制备及其酶解
取1 g糙米提取淀粉后的残渣,加入10 mL去离子水,用0.5 mol/L NaOH调节pH值至8.5,在50℃,300 r/min的条件下反应2h。然后离心(3 000×g)20 min,取上清液,用0.1mol/L HCl溶液调节pH至3.8。离心(3 000×g)20 min,沉淀物冷冻干燥。将制备所得蛋白,用Alcalase2.4 L试剂进行酶解。酶解条件为:50℃,pH 8.5,搅拌速度300 r/min,酶解度达到18%时停止酶解反应。将所得产物冷冻干燥,备用。
1.2.2 糙米蛋白基本成分分析
蛋白质含量的测定:MACRO cube CNS定氮仪。
脂肪含量的测定:Dionex脂肪测定仪。
灰分含量的测定:AOAC 923.03。
膳食纤维含量的测定:AOAC 935.53。
1.2.3 实验动物及其喂食
雄性叙利亚金仓鼠购于Charles River实验室(Kingston Colony,Laboratory Area K62,Wilmington,MA)。动物到达后,喂食Chow(Purina Rodent Laboratory Chow)并置于20~22℃,相对湿度为60%,12 h灯照,12 h黑暗的环境下。1周后,称重,并随机分组。将实验动物分为3组,分别为酪蛋白对照组(C)、糙米蛋白组(RBP)、糙米蛋白酶解物组(BRPH)。用这3种饲料喂食仓鼠3周,喂食期间,每周称其体重,每周喂食2次。动物实验的饲料组成如表1。
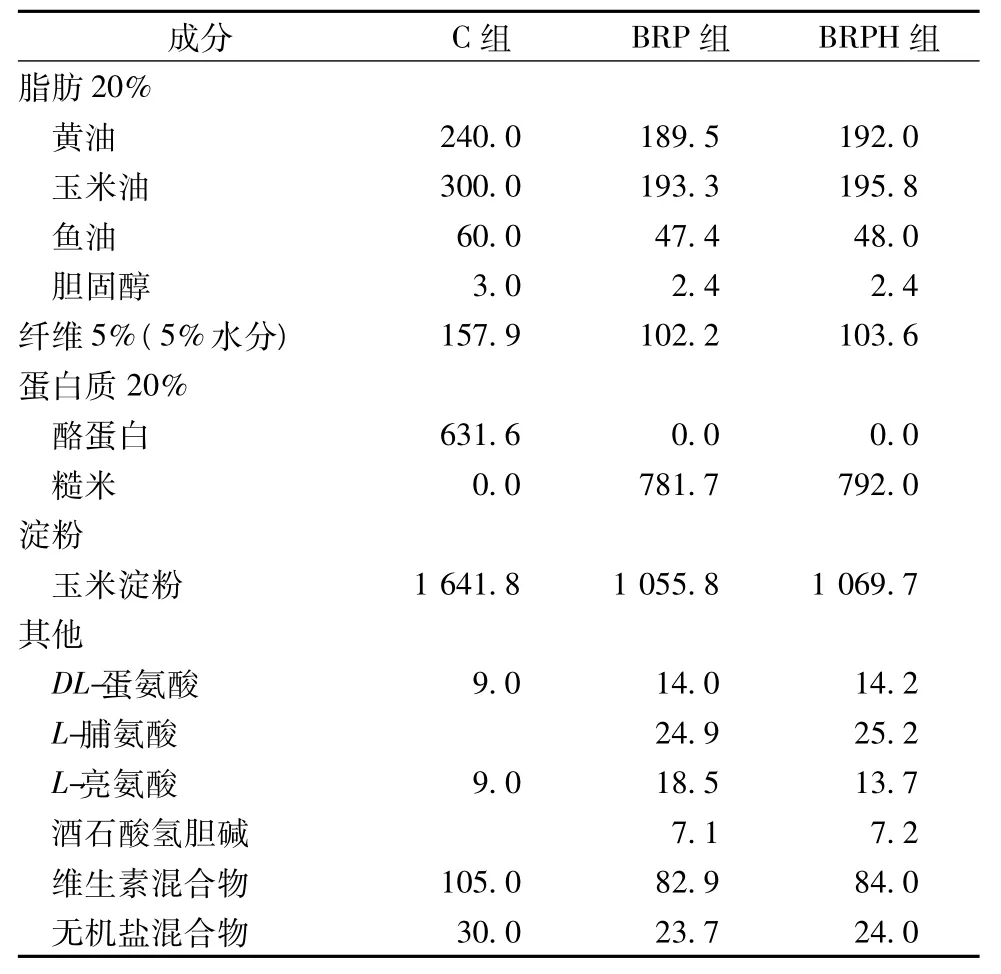
表1 动物实验的饲料组成 g
1.2.4 动物解剖
将仓鼠禁食12 h,然后麻醉窒息死亡。腹部解剖,用含有K3EDTA溶液的注射器心脏取血,然后取出肝脏和其他器官,冷冻干燥,备用。
1.2.5 肝脏中脂肪的提取及总胆固醇(TC)和游离胆固醇(FC)含量的测定
肝脏中脂肪的提取使用Dionex快速脂肪提取仪,过程如下:将约0.5 g冷冻干燥后的肝脏样品与少量沙子混合,放于盛有沙子的提取容器内,然后用沙子封顶,密封提取容器。将装有样品的提取容器放在仪器上,在60℃,2175psig条件下进行,用3∶2(体积比)的乙醚和异丙醇溶液提取。提取结束后,在37℃条件下,用氮气干燥至恒重,称重计算脂肪含量。然后将干燥的脂肪溶于V(三氯甲烷)∶V(甲醇)=5∶2溶液,取0.55 mL容易转移至新的试管中,加入2.2 mL,1%Triton X-100的氯仿溶液,混合均匀后,37℃,氮气干燥。在干燥后的试管中加入1 mL去离子水,充分混合后在37℃恒温水浴锅内静置1 h。分别使用 FC试剂盒(Wako Chemicals公司)和TC试剂盒(Wako Chemicals公司)进行TC和FC含量的测定。
1.2.6 仓鼠粪便的分析及其脂肪、TC、FC和胆汁酸含量的测定
动物实验结束的前3 d,收集动物粪便,冷冻干燥,研磨,-20℃保存备用。仓鼠粪便中脂肪的提取及TC和FC含量的测定同1.2.5。
1.2.7 仓鼠粪便的胆汁酸含量的测定
根据Van Der Meer R等的方法进行了仓鼠粪便中胆汁酸的提取和测定[12]。将干燥的粪便约50 mg和1 mL叔丁醇-水(1∶1,体积比)加入到 eppendorf试管内,在漩涡振荡器上混合10 s,然后放入37℃水浴振荡器内15 min,再次用漩涡振荡器混合10s,最后在10 000×g速度下离心2 min,取出上清液,用Diazyme胆汁酸试剂盒进行胆汁酸含量测定。
1.2.8 数据处理
所有的数据表示为平均值±SE,数据之间的显著性分析通过Minitab 15软件(Minitab INC.,State college,PA,USA)的 one-way ANOVA进行分析,其置信区间为P<0.05。数据之间的相关性是pearson系数,通过SPSS软件得到。
2 结果与讨论
2.1 糙米蛋白基本成分分析(表2)

表2 糙米蛋白的基本组成
2.2 糙米蛋白及其酶解产物对仓鼠进食量、体重及器官重量的影响
从表3可以看出,实验期间,仓鼠的体重增加量与肝脏重量呈现显著的正相关关系(r=0.991,P<0.05)。与对照组相比较,喂食含有BRPH的仓鼠,进食量增加了2%,而体重却显著降低(P<0.05),降低了12%,体重增加量降低了大约58%;但是BRP饲料组对仓鼠体重影响不显著,同时,喂食BRPH饲料的仓鼠,肝脏重量降低了28.8%,但是BRP饲料组使仓鼠肝脏重量有所降低(9%),但是未达到统计学上显著性的水平。对于BRPH饲料组,仓鼠的附睾脂肪分别与仓鼠体重和腹膜后脂肪呈正相关关系(r=0.884,P<0.01;r=0.874,P<0.01)。BRP饲料组降低了仓鼠腹膜后脂肪含量,但是增加了其附睾脂肪含量。与对照组相比较,BRP饲料组对仓鼠脂肪总量无显著影响。

表3 不同饲料对仓鼠进食量和体重的影响
2.3 糙米蛋白及其酶解产物对仓鼠肝脏总脂肪含量的影响
从图1可以看出,与对照组相比较,喂食糙米蛋白及其酶解产物后的仓鼠,其肝脏总脂肪含量分别降低了9%和14%。这就说明糙米蛋白可以调节仓鼠的脂质代谢,糙米蛋白酶解产物则具有更好的效果,这可能是由于酶解后的低分子肽段更易于肝脏调节脂质代谢。
2.4 糙米蛋白及其酶解产物对仓鼠肝脏TC和FC的影响
肝脏在胆固醇的合成及运输方面起着重要的作用,肝脏中胆固醇的含量也是影响动脉粥样硬化的一个重要指标。图2显示出不同饲料组中仓鼠肝脏TC和FC的含量。从图2可以看出,与对照组对比,BRP和BRPH饲料组可以显著降低仓鼠肝脏中的胆固醇含量(P<0.05),降低量分别为22%和51%。这说明糙米蛋白可以降低肝脏中胆固醇的含量,但是经过Alcalase2.4L酶解后的产物,其作用更为显著。BRP和BRPH饲料组对仓鼠肝脏游离胆固醇的含量影响不显著,因此,BRP和BRPH饲料组使仓鼠肝脏中游离胆固醇和总胆固醇的比例增加,分别为对照组的1.2倍和1.8倍。
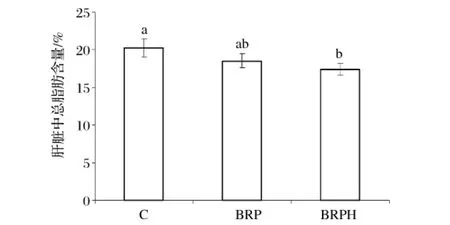
图1 不同饲料组对仓鼠肝脏总脂肪含量的影响
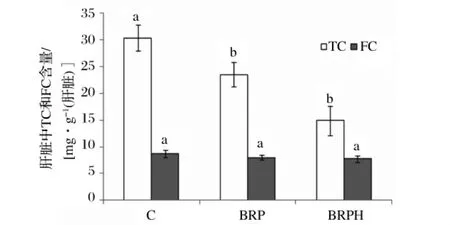
图2 不同饲料组对仓鼠肝脏TC和FC含量的影响
2.5 糙米蛋白及其酶解产物对仓鼠粪便中总脂肪含量的影响
从图3可以看出,与对照组相比较,糙米蛋白和糙米蛋白酶解物可以增加仓鼠粪便中脂肪含量,其增加量分别为98%和120%。这可能是糙米蛋白及其酶解产物中的不易被消化的蛋白相当于膳食纤维的功能,促进了粪便中脂肪含量的增加。
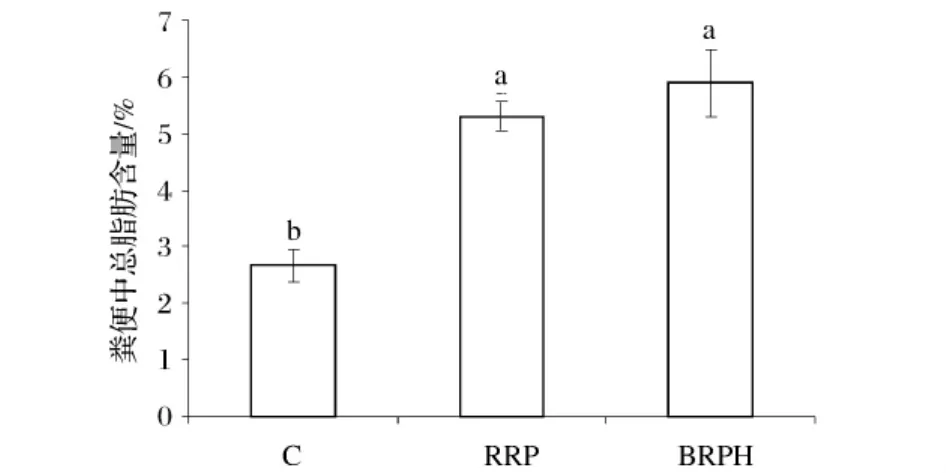
图3 不同饲料组对仓鼠粪便中脂肪含量的影响
2.6 糙米蛋白及其酶解产物对仓鼠肝脏仓鼠粪便中TC和FC含量的影响
从图4可以看出,与酪蛋白相比较,糙米蛋白及其酶解产物对粪便中TC及FC排出量有显著影响。糙米蛋白及其酶解产物可以显著提高粪便中TC含量,其增加量分别为66%和68%,它们还提高粪便中FC含量,增加量分别为60%和48%。
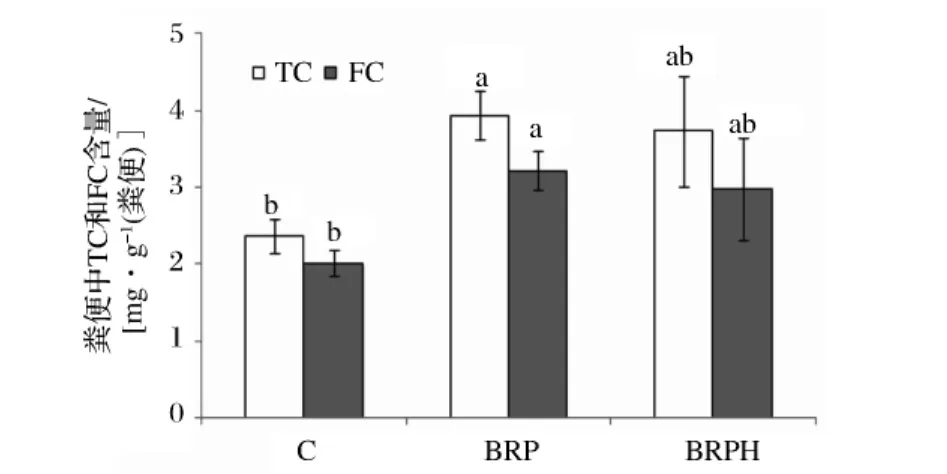
图4 不同饲料组对仓鼠粪便中TC和FC含量的影响
2.7 糙米蛋白及其酶解产物对仓鼠肝脏仓鼠粪便中胆汁酸含量的影响
从图5可以看出,与对照组相比较,BRP饲料组使仓鼠粪便中胆汁酸的含量增加了27%,但是未达到统计学上的显著增加。BRPH对仓鼠粪便中胆汁酸含量无显著影响。这可能是由于糙米蛋白更容易结合胆汁酸,促进其排出体外。一些研究已经表明大豆蛋白的消化性低于酪蛋白,其不易被消化的部分可能会结合胆汁酸,促进胆汁酸排出体外[13]。
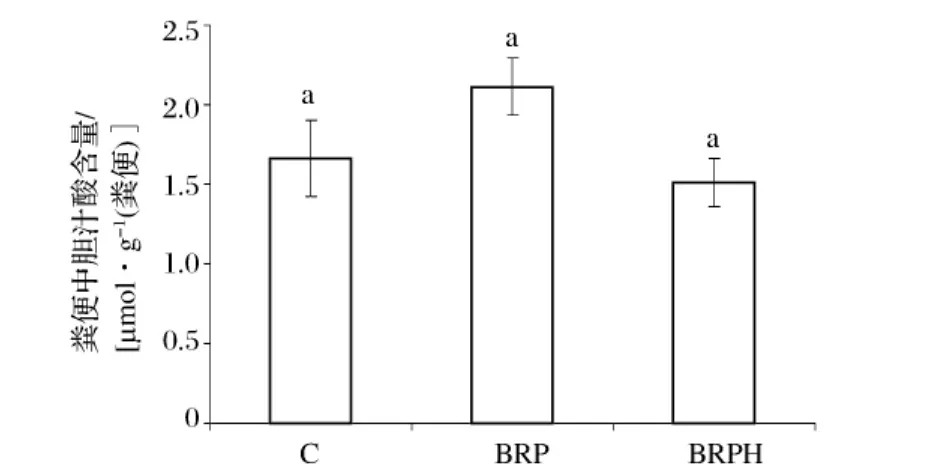
图5 不同饲料组对仓鼠粪便中胆汁酸含量的影响
3 结论
实验以酪蛋白为对照组,研究了糙米蛋白及其酶解产物对叙利亚金仓鼠体重、进食量及其器官重量;肝脏总脂肪含量、TC和FC含量以及仓鼠粪便中成分的影响。膳食蛋白及其酶解产物的降低胆固醇的机理尚不清楚,但是有一些机制已经被提出。机制1:膳食蛋白结合胆汁酸,使胆酸排出体外,促进胆固醇向胆汁酸的转化,从而降低肝脏中胆固醇的含量;机制2:在小肠内胆固醇必须与胆汁酸和磷脂等结合,形成胶束结构才能被小肠上皮细胞吸收,膳食蛋白有可能会破坏胆固醇的胶束结构,使胆固醇聚集,从而阻止了胆固醇的吸收;机制3:膳食蛋白可以直接促进脂肪的排出。从本实验的研究结果来看:BRP和BRPH饲料组都可以破坏胆固醇的胶束结构,促进胆固醇的排出;同时它们还可以促进脂肪的排出。尽管BRP和BRPH饲料组对仓鼠粪便中胆汁酸的排出无显著影响,但是BRPH饲料可使粪便中胆汁酸的排出量有所增加。同时,还有研究表明,无异黄酮大豆蛋白可能降低与胆固醇代谢有关的酶(HMG-CoA还原酶)和与胆固醇吸收有关的酶(LDL-R)的mRNA表达量[14],因此我们在后续实验中将会进行与胆固醇代谢有关的基因的mRNA表达的研究。
[1] Xiangdong L,Yuanwu L,Hua Z,et al.Animal models for the atherosclerosis research:A review[J].Protein Cell,2011,2(3):189-201.
[2] Suckling K E,Jackson B.Animal models of human lipid metabolism[J].Progress in Lipid Research,1993,32(1):1-24.
[3] Ness G C,Gertz K R.Hepatic hmg-coa reductase expression and resistance to dietary cholesterol[J].Experimental Biology and Medicine,2004,229(5):412-416.
[4] Kris-Etherton P,Dietschy J.Design criteria for studies examining individual fatty acid effects on cardiovascular disease risk factors:Human and animal studies[J].The A-merican Journal of Clinical Nutrition,1997,65(5):1 590S-1 596S.
[5] Frota K M G,Mendonça S,Saldiva P H N,et al.Cholesterol-lowering properties of whole cowpea seed and its protein isolate in hamsters[J].Journal of Food Science,2008,73(9):H235-H240.
[6] Morita T,Oh-hashi A,Takei K,et al.Cholesterol-lowering effects of soybean,potato and rice proteins depend on their low methionine contents in rats fed a cholesterol-free purified diet[J].J Nutr,1997,127(3):470-477.
[7] Zhong F,Zhang X,Ma J,et al.Fractionation and identification of a novel hypocholesterolemic peptide derived from soy protein alcalase hydrolysates[J].Food Research International,2007,40(6):756-762.
[8] Zhong F,Liu J,Ma J,et al.Preparation of hypocholesterol peptides from soy protein and their hypocholesterolemic effect in mice[J].Food Research International,2007,40(6):661-667.
[9] Nagaoka S,Futamura Y,Miwa K,et al.Identification of novel hypocholesterolemic peptides derived from bovine milk β-lactoglobulin[J].Biochemical and Biophysical Research Communications,2001,281(1):11-17.
[10] Megías C,Pedroche J,del Mar Yust M,et al.Sunflower protein hydrolysates reduce cholesterol micellar solubility[J].Plant Foods Hum Nutr,2009,64(2):86-93.
[11] Yang L,Kumagai T,Kawamura H,et al.Effects of rice proteins from two cultivars,koshihikari and shunyo,on cholesterol and triglyceride metabolism in growing and adult rats[J].Biosci Biotechnol Biochem,2007,71(3):694-703.
[12] Van Der Meer R,Vries H.T-butanol extraction of feces:Rapid procedure for enzymic determination of fecal bile acids[M].Wageningen:The Netherlands:Posen and Looijen,1985:113-119.
[13] Lin Y,Meijer G W,Vermeer M A,et al.Soy protein enhances the cholesterol-lowering effect of plant sterol esters in cholesterol-fed hamsters[J].The Journal of Nutrition,2004,134(1):143-148.
[14] Shukla A,Brandsch C,Bettzieche A,et al.Isoflavonepoor soy protein alters the lipid metabolism of rats by srebp-mediated down-regulation of hepatic genes[J].The Journal of Nutritional Biochemistry,2007,18(5):313-321.

