人参皂苷F1转化菌株的原生质体诱变育种
孟飞,高紫维,孙明波,张怡轩
(沈阳药科大学生命科学与生物制药学院,辽宁沈阳110016)
人参皂苷F1(Ginsenoside F1,GF1)于1976年由Yahara等[1]在人参(Panax ginseng C.A.Meyer,Asian ginseng)叶中分离得到。经药理研究表明,稀有GF1能够抑制人体骨肉瘤细胞U2OS的增殖[2],减少UV-B导致的细胞死亡并防止UV-B诱发的人类HaCaT角化细胞凋亡[3]、拮抗人的血小板凝集[4]。但GF1在人参叶、花、果中的含量甚微,从天然人参中提取十分困难,因此GF1的获得十分有限。然而人参皂苷Rg1(Ginsenoside Rg1,GRg1)获得相对容易,它的结构与GF1十分相似[5],仅在C6位多一个糖基,去掉GRg1分子C6侧链的O-Glc中的β-葡萄糖基,即可得到GF1。如何高效地获得更多更纯的GF1,具有极其重要的药用价值和经济意义。利用微生物转化制备稀有人参皂苷已成为获得稀有人参皂苷的有效途径[6-8]。目前采用微生物转化GRg1的研究报道较少,且产物多为GRh1[9]。本实验室筛选保藏的1株真菌菌核青霉(Penicillium sclero-tiorum)2246,所产生的酶能特异性水解GRg1C6位上的葡萄糖基,生成GF1[10],但其转化率不高,且转化能力不稳定。原生质体诱变技术是一种行之有效的菌种选育技术,由于微生物原生质体去除了细胞壁,外界的物质很容易穿透细胞膜进入细胞内,造成原生质体对外界各种诱变因子的敏感性大大增强,应用诱变剂对原生质体进行处理,有可能在短期内获得产量高、生产性能好的菌株。本实验通过对菌株2246原生质体制备和再生过程中的几个重要影响因素进行研究,确定了原生质体制备和再生的最佳条件,并对原生质体进行了亚硝基胍(NTG)复合紫外诱变,以期提高菌株2246将GRg1转化为GF1的能力,提高其转化率。
1 材料与方法
1.1 材料
1.1.1 菌株菌核青霉2246(Penicillium sclerotiorum)[11],本实验室保藏。
1.1.2 培养基①生孢培养基(PDA):葡萄糖10.0 g,琼脂20.0 g,马铃薯浸汁(去皮马铃薯200.0 g,切成块状,加蒸馏水1 L煮沸30 min,4层纱布过滤得浸汁)定容至1 L,pH 7.2~7.5;②菌丝生长培养基:葡萄糖10.0 g,蔗糖10.0 g,花生饼粉5.0 g,蛋白胨10.0 g,KH2PO43.0 g,MgSO4·7H2O 3.0 g,NH4Cl 10.0 g蒸馏水定容至1 L。121℃灭菌20 min;③查氏培养基:NaNO32.0 g,K2HPO41.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO40.01 g,蔗糖30.0 g,琼脂20.0 g,蒸馏水1 L,pH自然。121℃灭菌20 min;④沙氏培养基:蛋白胨10.0 g,葡萄糖40.0 g,NaCl 5.0 g,琼脂20.0 g,蒸馏水1 L,pH自然。121℃灭菌20 min;⑤再生固体培养基:PDA培养基中加入相应的渗透压稳定剂;⑥初筛培养基:PDA培养基中加入0.3%的GRg1作为底物;⑦复筛培养基:葡萄糖20.0 g,玉米粉5.0 g,药媒10.0 g,酵母粉10.0 g,KH2PO43.0 g,MgSO4·7H2O 3.0 g蒸馏水定容至1 L。121℃灭菌20 min。
1.1.3 试剂溶壁酶(Lywallzyme)购自广东省微生物研究所,纤维素酶(Cellulase)与蜗牛酶(Snailase)购自索来宝公司,亚硝基胍(NTG)购自Fluka公司。
1.2 方法
1.2.1 原生质体的制备取新鲜斜面孢子适量,接种于菌丝生长培养基,28℃摇瓶振荡(160 r/min)培养24 h,4 000 r/min离心10 min收集菌丝体,蒸馏水洗涤2次,渗透压稳定液洗涤1次,离心得菌丝体,并用灭过菌的滤纸吸干菌丝体上的水分。按照每200 mg菌丝体加入1 mL混合酶液(酶液配制:称取一定量的酶,用渗透压稳定剂配制成一定浓度,用微孔滤膜过滤除菌),向上述菌丝体中加入相应体积的酶解液,31℃酶解2 h,每30 min镜检1次观察原生质体形成情况。酶解后,原生质体与菌丝碎片混杂,用3层无菌擦镜纸过滤除去菌丝碎片和未被酶解的菌丝体分离出原生质体。将滤液3 000 r/min离心10 min,弃去上清液,用渗透压稳定液(用0.1 mol/L pH 5.5~6.0的磷酸缓冲液配制0.8 mol/L KCl)洗涤原生质体沉淀2次,以解除酶解作用。将得到的原生质体悬浮于渗透压稳定液中,显微镜下计数。
1.2.2 原生质体再生将制备的原生质体悬液用渗透压稳定液适当稀释后,取0.2 mL涂布再生平皿,同时将原生质体悬液用无菌水适当稀释后,静置裂解30 min,取0.2 mL涂布再生平皿作为对照。所有平皿置28℃培养,计算原生质体再生率。原生质体再生率=((高渗培养基菌落数-普通培养基菌落数)/培养基上接种的原生质体个数)×100%。
1.2.3 原生质体的诱变取上述制备的原生质体悬浮液,加入适量浓度为20 mg/mL的NTG溶液使其终浓度为0.6 mg/mL,30℃水浴保温30 min,然后用渗透压稳定液进行梯度稀释涂再生平板,并用紫外灯(30 W距离30 cm)照射30 s,28℃避光培养。以未经过NTG和紫外复合诱变的原生质体为对照。计算原生质体再生株致死率。
1.2.4突变株的筛选方法①初筛:将诱变后再生培养基上生长好的单菌落,用竹签转接到含有GRg1的初筛培养基制成的琼脂块上,每1菌株点2个琼脂块,并且同时做斜面,保留备用。接种后的琼脂块在28℃条件下,保湿培养3~4 d。将培养好的琼脂块放入EP管中,加入1 mL正丁醇萃取12 h,进行TLC检测,点样量5 μL,展开剂CHCl3/MeOH/H2O(7/3/1,体积比)展开,挥干溶剂,喷10%(体积比)H2SO4-EtOH于105℃下显色。选取转化产物GF1斑点颜色较深的菌株进行复筛;②复筛:将初筛获得的菌株,接入三角瓶复筛培养基中,于28℃160 r/min的摇床上培养36 h,以10%转种量转种,培养48 h后,投入GRg1(终浓度为0.6%,质量体积比)28℃继续培养4 d。转化结束后,HPLC测定GF1含量,色谱条件为检测波长203 nm,流动相为甲醇、水,体积比为65∶35,柱温40℃,流速为1 mL/min。
1.2.5 遗传稳定性试验连续传代5次并摇瓶发酵培养,测定GF1的产量,并观察其遗传稳定性。
2 结果与分析
2.1 原生质体制备
2.1.1 培养基对原生质体形成的影响培养基成分不同可导致细胞壁结构的差异,这种差异又导致了细胞壁对酶的敏感度不同,从而使菌丝细胞释放的原生质体量有差别[12]。本实验考察了PDA、菌丝生长培养基、查氏培养基、沙氏培养基对原生质体形成的影响,结果菌株在PDA、查氏、沙氏3种液体培养基中极易结团形成致密的小球,阻碍酶和菌丝体的接触,不利于原生质体形成。而菌丝生长培养基培养的菌丝体量大,菌丝舒张,状态好,结团不明显,能够较好地形成原生质体。
2.1.2 菌龄对原生质体形成的影响微生物的生理状态是决定原生质体产量的主要因素之一,丝状真菌一般在菌丝体对数生长的早期阶段产生原生质体的数量多,但并非菌丝越嫩越利于酶解。菌丝只是在其生长的某个阶段对混合酶液最为敏感,在此阶段酶解效果较好,过早或过晚都不利于酶解,这有可能是因为菌丝生长的不同阶段其细胞壁的结构组成不同,从而导致对混合酶液的敏感度不同[13]。因此有必要对用于原生质体制备和再生的菌丝体菌龄进行考察。分别取培养18、24、30、36 h的菌丝体制备原生质体,从实验结果(图1)可见菌龄对原生质体的形成影响很大,培养24 h的菌丝其原生质体的产量最高,达到1.8×106个/mL。
2.1.3 酶浓度对原生质体形成的影响适宜的酶浓度是影响原生质体制备的重要因素,酶浓度过大或过小都不利于原生质体形成。本实验选取不同质量浓度的蜗牛酶、溶壁酶、纤维素酶来探讨混合酶液对原生质体形成量的影响。从表1中可以看出,当溶壁酶、蜗牛酶、纤维素酶配比为1∶1∶1,且浓度为5 mg/mL时原生质体形成率和再生率最高。
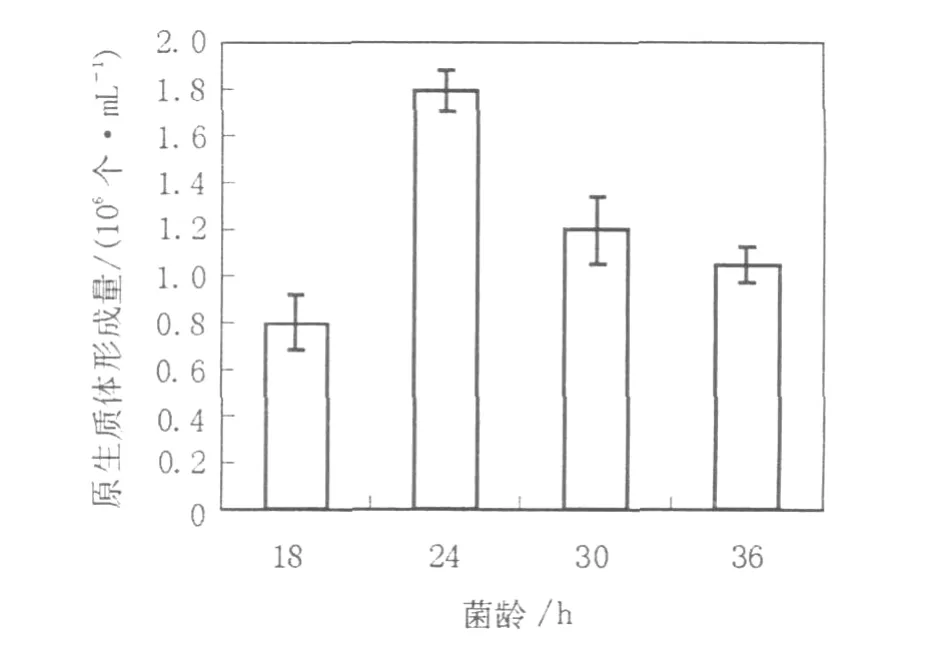
图1 菌龄对菌核青霉2246原生质体形成的影响Fig.1 Effect of incubation time on the protoplasts release of P.sclerotiorum 2246
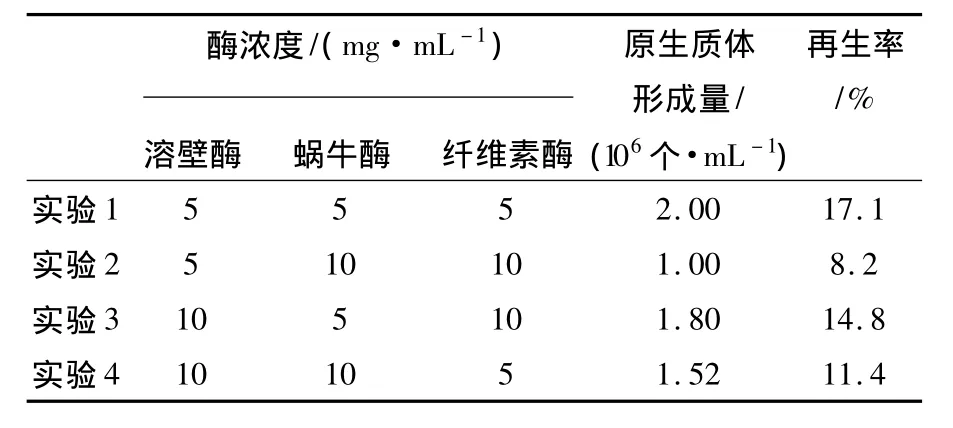
表1 酶浓度和配比对菌核青霉2246原生质体形成的影响Table 1 Effect of concentrations and ratio of the enzymes on the protoplasts release of P.sclerotiorum 2246
2.1.4 渗透压稳定剂对原生质体形成的影响分别选用0.8 mol/L的NaCl、KCl、MgSO4、蔗糖、甘露醇等5种溶液作为渗透压稳定剂,比较各种渗透压稳定剂对原生质体形成量的影响,结果见图2A。实验结果显示,不同的渗透压稳定剂对原生质体的形成有着明显的影响,无机盐类NaCl、KCl均能有效地制备原生质体,与文献[14]报道一致。对0.6、0.7、0.8、0.9 mol/L 4个不同浓度的KCl渗透压稳定剂进一步深入考察,发现0.8 mol/L的KCl溶液作为渗透压稳定剂得到的原生质体数目最多(图2B),制备的原生质体数可达到3×106个/mL。
2.1.5 酶解时间和温度对原生质体的影响由于裂解细胞壁的酶中含有几丁质酶、蛋白酶等多种酶组分,酶解时间过长或温度过高可能会损害原生质体质膜,影响原生质体的形成,因此本实验采用了不同的酶解时间和不同的酶解温度,考察酶解时间和酶解温度对原生质体形成的影响。确定最佳酶解时间为1.5~2 h(图3A),温度为31℃(图3B)。
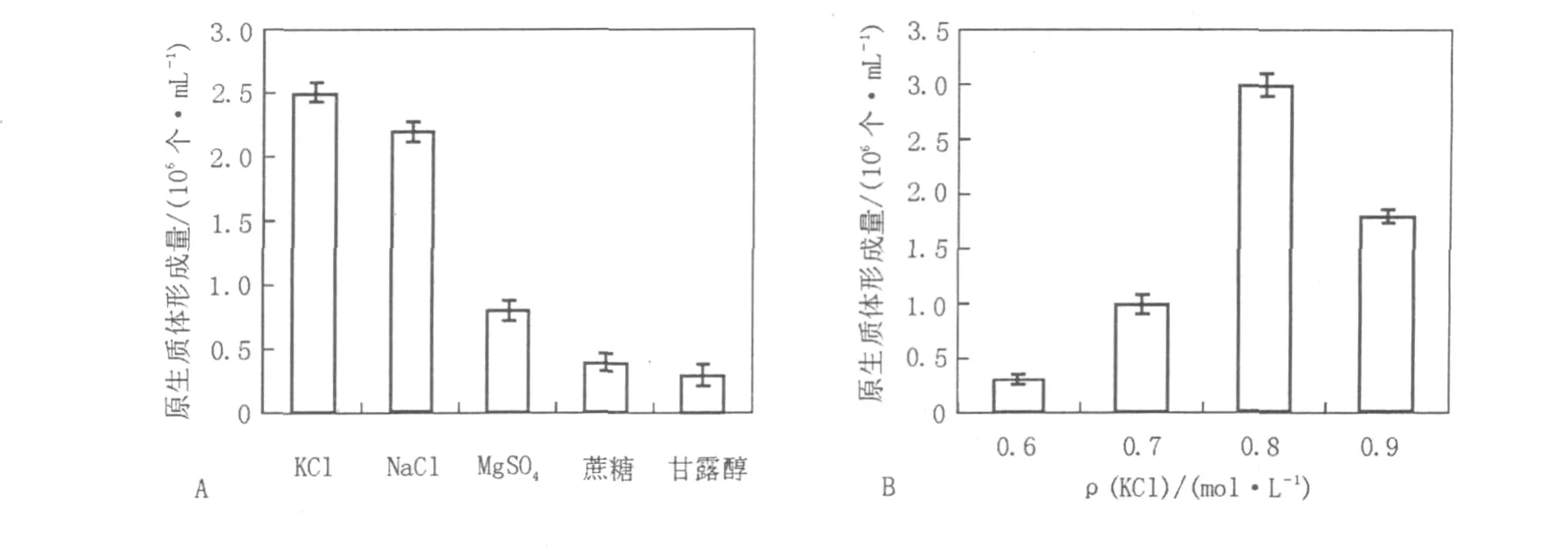
图2 渗透压稳定剂对菌核青霉2246原生质体形成的影响Fig.2 Effect of osmotic pressure stabilizer on the protoplasts release of P.sclerotiorum 2246
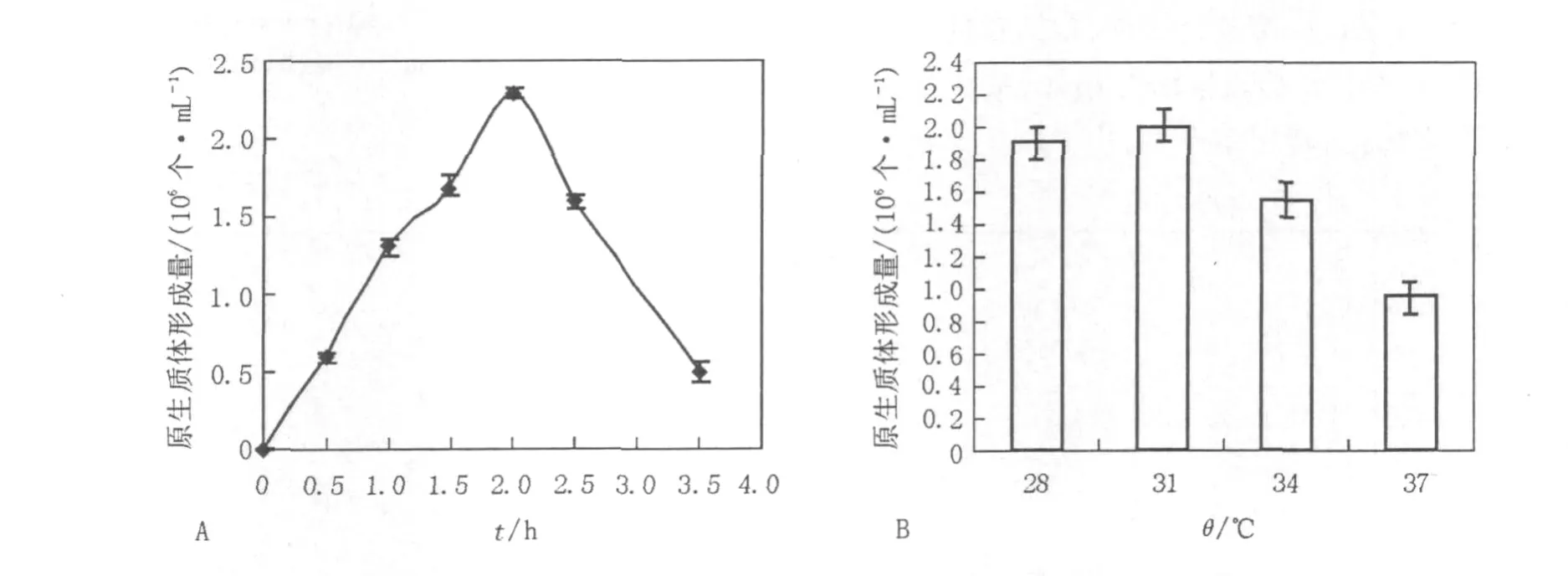
图3 酶解时间和温度对菌核青霉2246原生质体形成的影响Fig.3 Effect of digesting time and temperature on the protoplasts release of P.sclerotiorum 2246
2.2 原生质体再生
2.2.1 再生培养基的选择本实验比较了PDA、查氏、沙氏3种不同的再生固体培养基对原生质体再生的影响,结果见表2。PDA与沙氏培养基有利于原生质体再生,原生质体在PDA培养基与沙氏培养基上的再生率分别为10.6%和18.2%。但沙氏培养基上生长的菌落较小,生长缓慢,而查氏培养基再生效果较差,再生率只有1.17%。因此,选用PDA高渗培养基作为原生质体再生培养基。

表2 不同再生培养基对原生质质体再生的影响Table 2 Effect of different regeneration media on the regeneration rate of protoplasts
2.3 原生质体形成过程观察
取不同酶解时间的酶解液观察原生质体的形成情况,酶解0.5 h后开始有原生质体释放,大多数原生质体从菌丝顶端释放,但是形成的量较少。酶解1 h后,菌丝碎片增多,原生质体开始大量形成。酶解1.5~2 h时形成大量菌丝片段,原生质体呈圆球形,且大小不一,同时原生质体数达到最大值,继续酶解原生质体开始破裂,数量减少。
2.4 原生质体的诱变
2.4.1 原生质体再生株致死率曲线将稀释到(1~2)×105个/mL的原生质体与不同浓度的NTG作用30 min后终止反应,各取0.2 mL菌悬液、稀释涂平板,紫外线照射30 s,避光培养72 h,计算致死率,致死曲线见图4。由图4可知,致死率随NTG浓度的升高而增加,NTG浓度在0.6 mg/mL,菌体致死率在80%左右。但采用高致死率的诱变剂量会大大影响原生质体的再生,因此,综合考虑原生质体再生率与正突变机率存在范围,选取0.6 mg/mL作为最佳诱变剂量。
2.4.2 诱变育种结果从原生质体诱变后的再生菌株中,选取680株菌进行初筛,挑选在薄层板上GF1斑点颜色比出发菌株深的菌株,按照复筛方法进行生物转化,转化结束后,用HPLC外标法测定GF1的产量,结果见图5。出发菌株经过多次的诱变筛选,最后得到1株转化率高达30.5%的菌株(NU-1),较出发菌株16.7%的转化率提高了13.8%。
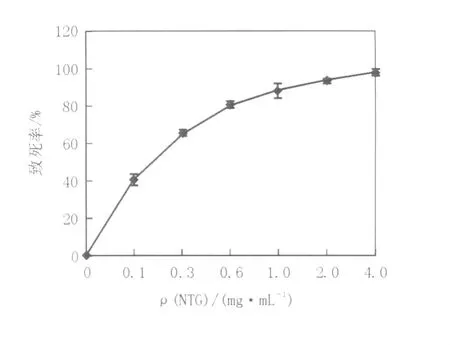
图4 不同浓度NTG对原生质体致死率的影响Fig.4 Effect of different NTG concentrations on the death rate of protoplasts
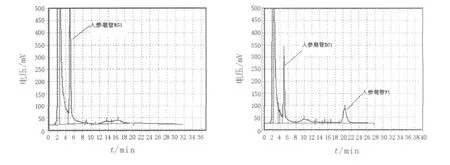
图5 GRg1与转化产物GF1的HPLC检测图Fig.5 HPLC analysis of GRg1and its transformation product GF1
2.4.3 遗传稳定性试验将筛选获得的高转化率菌株(NU-1)连续传代培养5次,摇瓶发酵培养,HPLC测定GF1的产量,观察其遗传稳定性。试验结果表明,此菌株遗传稳定性强,连续传代的转化率稳定在28.5%~31%之间。
3 讨论
在影响菌核青霉2246菌株原生质体形成的因素中,主要影响因子为酶系统。不同的微生物细胞壁的组成不完全相同,霉菌细胞壁的主要成分为纤维素、几丁质,通常采用蜗牛酶、纤维素酶等来水解细胞壁,通过对酶解浓度、温度、时间、菌龄等因素的考察分析,确定菌株原生质体形成与再生的最佳条件为菌丝体培养24 h,用5 mg/mL溶壁酶、5 mg/mL纤维素酶、5 mg/mL蜗牛酶的混合酶液酶解,以0.8 mol/L的KCl作为渗透压稳定剂,31℃水浴中酶解2 h。在此条件下原生质体的形成量达到(2.0~3.0)×106个/mL,再生率为18.2%。
不同的青霉菌原生质体制备的条件也不相同,比较斜卧青霉[13]、指状青霉[14]、荨麻青霉[15]等原生质体的制备条件,菌龄大都采用对数期较幼嫩的菌丝,由于不同的菌株细胞壁结构成分存在差异,所以需要采用的酶的种类、酶的配比和浓度、酶解时间、酶解温度也不尽相同。由此可见,虽然有些菌同属,但进行原生质体制备时,也有必要探讨其最佳的原生质体形成条件。
原生质体由于失去了细胞壁,对外界环境的影响更加敏感。诱变剂很容易透过细胞膜,直接作用于遗传物质(DNA),从而引发较强强度的诱变[16]。原生质体诱变技术已经应用于很多菌种的诱变选育中,成为国内外进行菌种改造的一种有效途径。张玲等[17]利用原生质体诱变技术获得1株β-葡萄糖苷酶酶活显著提高的突变菌株。此外,由于紫外线与亚硝基胍作用于DNA时,其作用位点不一样,有更多的诱变“热点”,可以避免采用单一诱变剂多次诱变出现的“饱和”[18]。为了进一步提高该菌株的转化率,本研究用原生质体的诱变选育技术,采用NTG紫外复合诱变,得到1株转化率高达30.5%的菌株,较出发菌株16.7%的转化率提高了13.8%。实验结果表明,原生质体NTG和UV复合诱变是对该菌株行之有效的选育方法,通过该菌进行GRg1的生物转化,制备GF1具有工业化应用的前景。
[1] Yahara S,Tanaka O,Komori T.Saponins of the leaves of Panax ginseng[J].Chemical and Pharmaceutical Bulletin,1976,24:2204-2208.
[2] 张有为,窦德强,陈英杰,等.人参皂苷对人体骨肉瘤细胞U2OS增殖的影响[J].中草药,2001,32(3):232-236.
[3] Lee EH,Cho SY,Kim SJ,et al.Ginsenoside F1Protects Human HaCaT Keratinocytes from Ultraviolet-B-Induced Apoptosis by Maintaining Constant Levels of Bcl-2[J].Journal of Investigative Dermatology,2003,121(3):607-613.
[4] Wang J,Huang ZG,Cao H,et al.Screening of anti-platelet aggregation agents from Panax notoginseng using human platelet extraction and HPLC-DAD-ESI-MS/MS[J].Journal of Separation Science,2008,31(6-7):1173-1180.
[5] 吴秀丽,张怡轩,赵文倩,等.真菌EST-Ⅰ及EST-Ⅱ对人参皂苷Rg1定向转化为人参皂苷F1的研究[J].沈阳药科大学学报,2008,25(1):73-76.
[6] Sung-Ryong Ko,Kang-Ju Choi,Yukio Suzuki.Enzymatic preparation of ginsenosides Rg2,Rh1,and F1[J].Chemical and Pharmaceutical Bulletin,2003,51(4):404-408.
[7] Chi H,Kim DH,Ji GE.Transformation of Ginsenosides Rb2and Rc from Panax ginseng by Food Microorganisms[J].Biological&pharmaceutical bulletin,2005,28(11):2102-2105.
[8] L.Q.Cheng,M.K.Kim,D.C.Yang,et al.Conversion of major ginsenoside Rb1to 20(S)ginsenoside Rg3by Microbacterium sp.GS514[J].Phytochemistry,2008,69(1):218-224.
[9] Dong AL,Cui YJ,Guo HZ,et al.Microbiological Transformation of Ginsenoside Rg1[J].Journal of Chinese Pharmaceutical Sciences,2001,10(3):115-118.
[10] Wei Ying,Zhao Wenqian,Zhang Yixuan.Purification and characterization of a novel and unique ginsenoside Rgrhydrolyzing β-D-Glucosidase from Penicillium sclerotiorum[J].Acta Biochimica et Biophysica Sinica,2011,43(3):226-231.
[11] 张琪,武玉久,张磊磊,等.两株具有将人参皂苷Rg1转化为人参皂苷F1活性的真菌鉴定[J].中国抗生素杂志,2010,35(5):395-398.
[12] 张志光,李东屏,郭建春,等.丝状真菌原生质体技术研究—培养条件对原生质体的影响(VII)[J].湖南师范大学自然科学学报,1998,30(1):60-65.
[13] 赵晨,易宗春,荣龙,等.斜卧青霉原生质体制备和再生的研究[J].微生物学杂志,2009,29(1):18-21.
[14] 宋爱环,李红叶,刘小红.指状青霉(Penicillium digitatum)原生质体制备和再生条件[J].农业生物技术学报,2004,12(2):197-201.
[15] 李小容,曾如意,杨民和,等.荨麻青霉(Penicillium urticae)原生质体的制备与再生[J].福建师范大学学报(自然科学版),2009,25(4):76-83.
[16] 李秀珍,杨平平,王燕.黑曲霉原生质体诱变育种技术研究进展[J].中国酿造,2007,(12):1-4.
[17] 张玲,张芬琦,姚卫蓉.β-葡萄糖苷酶产生菌原生质体的诱变研究[J]食品研究与开发,2006,(10):62-64.
[18] 肖怀秋,李玉珍,兰立新.复合诱变原生质体选育高产中性蛋白酶菌株[J].中国酿造,2008,(15):52-54.
——2017年渗透压相关高考真题赏析

