EGFP-线粒体蛋白导入载体的构建及功能验证
乔录新,张玉林,丁 渭,陈德喜
(首都医科大学附属北京佑安医院感染科,北京100069)
EGFP-线粒体蛋白导入载体的构建及功能验证
乔录新,张玉林,丁 渭,陈德喜*
(首都医科大学附属北京佑安医院感染科,北京100069)
目的 构建能够将外源蛋白导入真核细胞线粒体的真核表达载体,并且通过增强型绿色荧光蛋白的表达进行示踪。方法 利用多重PCR扩增法将线粒体导肽序列与EGFP序列融合在一起,并插入真核表达载体pcDNA3.1,构建成真核表达载体pcDNA5.1-EGFP。将P53基因分别插入pcDNA5.1-EGFP和pcDNA3.1构建成pcDNA5.1-P53和pcDNA3.1-P53载体。经酶切和测序验证后在脂质体介导下分别将上述载体转染293T细胞,一方面在荧光显微镜下比较绿色荧光蛋白与细胞色素C在细胞内的分布情况,另一方面通过免疫荧光法比较P53蛋白在细胞内的定位。结果 绿色荧光的表达分布与细胞色素C具有一致性,且转染pcDNA5.1-P53载体的细胞内P53蛋白集中在胞质线粒体中,而转染pcDNA3.1-P53载体的细胞内P53蛋白主要分布在细胞核内。结论 成功构建能够将外源蛋白导入线粒体的真核表达载体。
表达载体;绿色荧光蛋白;线粒体导肽
线粒体是真核细胞重要的细胞器,是人体的动力工厂,无论是细胞的成活(氧化磷酸化)和细胞死亡(凋亡)均与线粒体功能有关,特别是呼吸链的氧化磷酸化异常与许多人类疾病有关。自从Luft等[1]首次报道1例线粒体肌病以来,因线粒体功能障碍导致的疾病已累及全身多个系统,其中以神经系统和肌肉系统受累表现突出,近年来有发现线粒体与各种肿瘤的发生有密切关系[2]。因此有关线粒体的研究已经成为人们关注的焦点。
每个线粒体内大约含有1 000~1 500种蛋白质[3]。这些蛋白质大部分都是由细胞核DNA编码经转录翻译并在细胞质核糖体合成后运入线粒体的,参与电子传递和ATP合成、三羧酸循环、脂肪酸氧化或氨基酸降解等重要生理过程,与众多线粒体疾病的发生发展有着密切关系。因此,对这些蛋白质在生理及病理状态下的变化趋势及相互关系的研究是一项十分必要和有意义的工作。本研究构建含有线粒体导肽的真核表达载体,并且在载体上加有EGFP示踪其蛋白的表达情况,为研究线粒体内蛋白质的功能及相互作用提供直观便捷的工具。
1 材料与方法
1.1 主要试剂
限制性内切酶ApaⅠ,XbaⅠ,EcoRⅠ,HindⅢ,DNA Marker,T4 DNA Ligase,Taq酶(Takara公司);质粒提取试剂盒和琼脂糖凝胶回收试剂盒(博迈德生物科技有限公司);细胞转染试剂Lipofectin(Invitrogen公司);JM109感受态(北京全式金生物科技有限公司);鼠抗细胞色素C抗体(Zymed Lab公司);鼠抗P53抗体(Sigma公司)。
1.2 引物与载体
1.2.1 引物:Cyc-S1:5'-TGGCAAGAGAGGGGGTTC TCATCATCATCATCAT-3',Cyc-S2:5'-TTAGCCTAAT TGGCAAGAGAGGGGGTTCTCATCATC-3',Cyc-S3:5'-ACCAGGGCACTTAGCCTAATTGGCAAGAGAGGGGG-3',Cyc-S4:5'-CCATGTTGGCTACCAGGGCACTTAG CCTAATTGGCA-3',Cyc-S5:5'-AGCAAGCTTGCCAC CATGTTGGCTACCAGGGCACTTAGCC-3',Cyc-AS:5'-AGCGGGTTTAAACGGGCCCTC-3';P53-S:5'-TATCT AGAGAGGAGCCGCAGTCA-3',P53-AS:5'-GAGGGC CCAGTCTGAGTCAG-3'。引物的合成及测序均由上海生工生物技术有限公司完成。
1.2.2 载体:pGEM-T easy载体(Promega公司),pcDNA4.1-EGFP载体(本实验室构建EGFP插入位点为KpnⅠ和XbaⅠ),pcDNA 3.1载体(Invitrogen公司),pCMV-P53载体(Clontech公司)。
1.3 细胞系及培养
人肾上皮细胞系(293T细胞,中国科学院),在含有10%灭活小牛血清的DMEM培养液中常规培养。
1.4 PCR扩增EGFP目的片段和线粒体导肽融合序列
PCR 1:引物:Cyc-S1,CYC-AS;模板:pcDNA4.1-EGFP;PCR反应体系:pcDNA4.1-EGFP 50 ng,引物200 nmol/L,DNA 聚合酶1 μL,dNTP 200 nmol/L,终体积50 μL;反应条件:94 ℃ 1 min;94℃ 15 s,65℃ 30 s,72 ℃ 2 min,30个循环。
PCR 2:引物:Cyc-S2,CYC-AS;模板:1 μL PCR1产物;PCR 条件:每50 μL体系中加1 μL PCR 1产物,引物200 nmol/L,DNA 聚合酶1 μL,dNTP 200 nmol/L;反应条件:94℃ 1 min;94℃ 15 s,65℃ 30 s,72℃ 2 min,30个循环。PCR 2产物的纯化、连接、转化及验证:二轮产物行0.8%琼脂糖电泳后切胶回收(参照试剂说明书进行),与pGEMT easy载体连接,连接方法参照Takara T4 DNA Ligase说明书。将上述连接产物pGEM-T-PCR2转化至JM109细胞内,氨苄抗性筛选克隆并提取质粒,EcoRⅠ酶切验证,具体步骤参照精编分子生物学实验指南[4]。
PCR 3:引物:Cyc-S3;CYC-AS模板:pGEM-TPCR2质粒。反应体系:pGEM-T-PCR2质粒50 ng,引 物 200 nmol/L, DNA 聚 合 酶 1 μL, dNTP 200 nmol/L,终体积为50 μL体积,反应条件:94 ℃1 min;94 ℃ 15 s,65 ℃ 30 s,72 ℃ 2 min,30 个循环。
PCR 4:引物:Cyc-S4;CYC-AS 模板:1 μL PCR3产物;PCR 条件:每50 μL体系中加1 μL PCR3 产物,引物200 nmol/L,DNA 聚合酶1 μL,dNTP nmol/L。反应条件:94℃ 1 min;94℃ 15 s,65℃30 s,72℃ 2 min,30个循环。PCR 4产物的纯化,连接、转化及验证具体操作同PCR2。
PCR 5:引物 Cyc-S5;CYC-AS模板:pGEM-T-PCR4(PCR4扩增TA克隆质粒)质粒;反应体系:PGEM-T-PCR4质粒50 ng,引物200 nmol/L,DNA 聚合酶1 μL,dNTP 200 nmol/L。终体积为50 μL体积;反应条件:94℃ 1 min;94℃ 15 s,65℃ 30 s,72℃ 2 min,30个循环。PCR 5产物的纯化、连接、转化及验证具体操作同上。
1.5 PCR扩增P53基因
PCR6:引物P53-S,P53-AS;模板:pcmv-P53质粒;反应体系:pCMV-P53质粒50 ng,引物200 nmol/L,DNA 聚合酶1 μL,dNTP 200 nmol/L,终体积为50 μL;反应条件:94℃ 2 min;94℃15 s,56℃ 30 s,72℃ 2 min,30个循环。PCR 6产物的纯化、连接、转化及验证:PCR 6产物行0.8%琼脂糖电泳后切胶回收,与pGEM-T easy载体连接,连接方法参照Takara T4 DNA Ligase说明书。将上述连接产物pGEM-T-PCR6转化至JM109细胞内,氨苄抗性筛选克隆并提取质粒,EcoRⅠ酶切及测序验证,具体步骤参照精编分子生物学实验指南[4]。
1.6 pcDNA5.1-EGFP载体构建
限制性内切酶HindⅢ 和ApaⅠ双酶切pGEMT-PCR5正确质粒,回收含有线粒体导肽序列的EGFP目的片段,并用限制性内切酶HindⅢ和ApaⅠ双酶切pcDNA3.1载体,回收载体大片段,连接转化提取质粒步骤同上,HindⅢ和ApaⅠ酶切及测序验证,阳性克隆命名为pcDNA5.1-EGFP(因为该质粒上带有线粒体导肽序列,为了和原有pcDNA3.1质粒区别,特命名为pcDNA5.1-EGFP)。
1.7 pcDNA5.1-P53和pcDNA3.1-P53载体构建
限制性内切酶XbaⅠ和ApaⅠ双酶切pGEM-TPCR6正确质粒,回收P53目的片段,限制性内切酶XbaⅠ和ApaⅠ切 pcDNA5.1-EGFP和 pcDNA3.1载体,分别回收载体大片段,连接转化提质粒步骤同上,提取质粒ApaⅠ酶切及测序验证读码框正确,阳性克隆命名为pcDNA5.1-P53和pcDNA3.1-P53。
1.8 免疫荧光
293T细胞从液氮中取出复苏后,传代。转染前1天,胰蛋白酶消化细胞并计数,将细胞铺到6孔板(3盘),细胞汇合为60% ~80%时转染。取1 μg质粒DNA,按Lipofectin试剂操作说明进行转染。其中1盘细胞转染pcDNA5.1-EGFP,另外两盘细胞分别转染 pcDNA5.1-P53(实验组)和pcDNA3.1-P53(对照组)。转染后,3盘细胞继续培养24 h,做如下处理:PBS漂洗3次,4%多聚甲醛固定,含 5%BSA、0.25%Triton-X-100的 PBS封闭2 h。转染pcDNA5.1-EGFP质粒的细胞加入鼠抗细胞色素c抗体,室温下孵育1 h,PBS洗3次,加入荧光素标记兔抗鼠IgG,室温下避光孵育1 h,PBS漂洗后封片;pcDNA5.1-P53实验组细胞和pcDNA3.1-P53对照组细胞分别加鼠抗P53抗体室温下孵育1 h,PBS洗3次,加入荧光素标记兔抗鼠IgG,室温下避光孵育1 h,PBS漂洗去除二抗,加入DAPI染色液室温作用15 min以上,PBS漂洗3次后封片;于荧光显微镜下观察细胞色素C,绿色荧光蛋白以及两组P53蛋白在细胞内的分布情况。
2 结果
2.1 目的基因EGFP-线粒体导肽的获取
以pcDNA4.1-EGFP载体为模板经过5次重复PCR扩增,利用引物附加碱基的多重扩增PCR方法将引物中添加的线粒体导肽序列与质粒原有EGFP序列融合在一起。线粒体导肽序列为:ATGTTGGCT ACCAGGGCACTTAGCCTAATTGGCAAGAGA(MLAT RALSLIGKR),序列参照大鼠线粒体细胞色素C氧化亚基 mRNA序列设计添加[5](图1)。
多重PCR扩增添加线粒体导肽步骤(图2)。
EcoRⅠ酶切pGEM-T-PCR5质粒,电泳显示有两条带分别位于870 bp和3 000 bp左右(图3),测序验证已经成功扩增出EGFP基因序列并带有线粒体导肽序列。
2.2 重组载体pcDNA5.1-EGFP酶切鉴定
pcDNA5.1-EGFP阳性克隆经HindⅢ和ApaⅠ双酶切后电泳在870 bp和5 500 bp处有条带,而双酶切pcDNA3.1载体仅在5 500 bp有一条带,实验结果与预期相符(图4A),测序验证读码框正确表明得到正确质粒pcDNA5.1-EGFP(图4B)。
2.3 pcDNA5.1-P53和pcDNA3.1-P53载体构建
以pCMV-P53质粒为模板PCR扩增P53基因分别连接到pcDNA5.1-EGFP和pcDNA3.1,酶切鉴定(图5),pcDNA5.1-P53质粒阳性克隆经XbaⅠ和ApaⅠ双酶切有两条带分别位于6 200 bp和1 100 bp(图5A),pcDNA3.1-P53阳性克隆双酶切后两条带分别位于5 500 bp和1 100 bp(图5B),与预期结果相符,进一步测序验证读码框正确,表明得到P53基因插入的质粒pcDNA5.1-P53和pcDNA3.1-P53。

图1 EGFP-线粒体导肽序列结构Fig 1 The structure of EGFP-mitochondrial transit peptide sequence


图4 重组载体pcDNA5.1-EGFP酶切鉴定及其结构图Fig 4 Identification of recombinant vector pcDNA5.1-EGFP by restriction analysis and its scheme
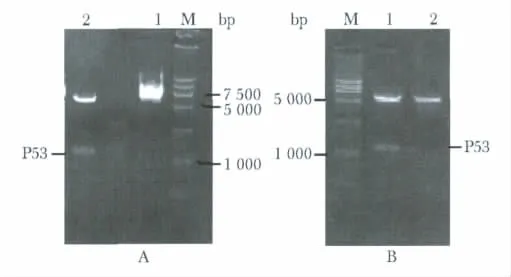
图5 pcDNA5.1-P53和pcDNA3.1-P53质粒鉴定Fig 5 Identification of pcDNA5.1-P53 plasmid and pcDNA3.1-P53 plasmid
2.4 pcDNA5.1-EGFP、pcDNA5.1-P53 或 pcDNA3.1-P53质粒转染细胞后荧光定位分析
pcDNA5.1-EGFP转染293T细胞做细胞色素C免疫荧光处理后在显微镜下观察细胞色素C的定位与绿色荧光蛋白的细胞定位具有一致性(图6A)。pcDNA5.1-P53或pcDNA3.1-P53质粒转染细胞做P53免疫荧光处理,在荧光显微镜下观察,pcDNA5.1-P53转染细胞表达的P53蛋白集中定位在胞质线粒体,而pcDNA3.1-P53质粒表达P53蛋白定位在细胞核(图6B),DAPI染色将所有细胞核均染为蓝色。上述结果表明所构建线粒体蛋白导入载体pcDNA5.1-EGFP是成功的。
3 讨论
线粒体虽然有自己的DNA,但是其内98%以上的蛋白质是由胞核基因组DNA编码的,并在胞质内由游离核糖体合成,再送到这些细胞器中去的[6-7]。目前认为大部分线粒体蛋白质之所以能够进入线粒体与其N端带有的一肽段有关,这段肽段被称为导肽,又称转运肽(transit peptide)或导向序列(targeting sequence)。导肽内含定向运往线粒体的信息。导肽序列中不含有或基本不含有带负电荷的酸性氨基酸,并且有形成两性α螺旋的倾向,这种特征性的结构有利于穿过线粒体的双层膜[8-9]。本研究中所选取导肽序列为目前公认的大鼠线粒体细胞色素C亚基IV的导肽(presequences)序列,它可以介导外源蛋白质进入线粒体。1985年Eduard C.Hurt等就已经发现线粒体细胞色素C氧化亚基IV导向序列的前12个氨基酸可以介导小鼠二氢叶酸还原酶进入线粒体基质,并且发现了第二个导向序列裂解点。同时,他们将线粒体导向序列中17~22个氨基酸去掉后发现,剩余序列仍能够介导细胞色素C氧化亚基IV进入线粒体内膜外侧,参与组装完整的细胞色素C氧化酶复合体[10]。
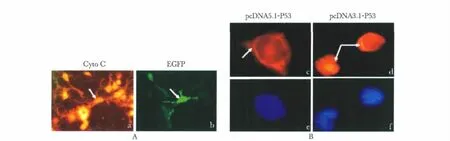
图6 pcDNA5.1-EGFP、pcDNA5.1-P53或pcDNA3.1-P53质粒转染293T细胞荧光观察Fig 6 Transfection of pcDNA5.1-EGFP,pcDNA5.1-P53 and pcDNA3.1-P53 plasmid into 293T cell
绿色荧光蛋白(green fluorescent protein,GFP)是一个生物发光系统具有性质稳定、无细胞毒性、灵敏性、检测便捷等优点,在荧光显微镜下,可直接观察到活细胞中的GFP绿色荧光,因此作为研究与之融合的其他蛋白表达的报告基因受到人们的关注。EGFP是优化的突变型GFP,其所产生的荧光要比野生型GFP强35倍,大大增强了该报告分子的灵敏度[11]。本研究利用多重PCR将线粒体细胞色素C氧化亚基IV导向序列的前12个氨基酸基因序列利用引物5'端附加碱基的方法与EGFP融合,并插入真核表达载体pcDNA3.1,转染细胞后表达的荧光蛋白,借助线粒体导肽与线粒体膜上的受体结合,并进入线粒体。因而凭借荧光显微镜可以观察到荧光蛋白在线粒体内的表达及分布情况,无需共转染其他带有荧光的质粒,操作简单可靠。
P53蛋白在细胞内起着整合的作用,正常情况下,该蛋白在所有类型的细胞内都存在且位于细胞核内,具有转录因子的功能[12]。本研究将P53基因插入构建的载体后转染细胞,发现该蛋白主要集中在线粒体内。进一步证明,所构建载体的导肽能够将外源蛋白导向线粒体。同时,由于本载体本身在EGFP两端具有内切酶HindⅢ、XbaⅠ、ApaⅠ等酶切位点,方便外源蛋白基因的插入,转染细胞后与EGFP形成融合蛋白在导肽的介导下共同进入线粒体表达。观察荧光蛋白的表达情况,就可以示踪外源基因在线粒体的表达,使相关实验变得更为简单、直观,尤其是在活细胞或活体观察方面具有很大的优势。因此,所构建的载体pCDNA5.1-EGFP是一种直观便捷的工具,将有助于更好地研究线粒体蛋白的定位机制,功能及相互关系,进而有助于线粒体及其相关疾病的研究,具有良好的应用前景。
[1]Luft R,Ikkos D,Palmizeri G,et al.A cose of severe hypermetabolism of nonthyroid origin with a defect in the maintenance of mitochondrial respiratory control:a correlated clinical,biochemical and morphological study[J].Clin Invest,1962,41:1776 -1804.
[2]杨越,贺军栋,郭学君,等.云南乳腺肿瘤发生与线粒体DNA控制区体细胞突变的相关性[J].基础医学与临床,2010,30:1299 -1302.
[3]Taylor SW,Fahy E,Zhang B,et al.Characterization of the human heart mitochondrial proteome[J].Nat Biotechnol,2003,21:281-286.
[4]奥斯伯F,金斯顿RE,塞德曼JG,等.颜子颖,王海林译.精编分子生物学实验指南[M].北京:科学出版社,1998,108 -112.
[5]Yamada M,Amuro N,Goto Y,et al.Structural organization of the rat cytochrome c oxidase subunit IV gene[J].J Biol Chem,1990,265:7687-7692.
[6]Neupert W,Herrman JM.Translocation of proteins into mitochondria[J].Annu Rev Biochem,2007,76:723 -749.
[7]Lopez MF,Melov S.Mitochondrial proteins and effect on functions[J].Circ Res,2002,90:380 -389.
[8]杨福愉.蛋白质跨线粒体膜运送的研究进展[J].生命科学,2008,20:514 -518.
[9]Herrmann JM,Riemer J.The intermembrane space of mitochondria[J].Antioxid Redox Signal,2010,13:1341 -1358.
[10]Hurt EC,Pesold-Hurt B,Suda K,et al.The first twelve amino acids(less than half of the pre-sequence)of an importedmitochondrial protein can direct mouse cytosolic dihydrofolate reductase into the yeast mitochondrial matrix[J].EMBO J,1985,4:2061-2068.
[11]唐孝青,李斌,伍小兵,等.绿色荧光蛋白及其应用的研究进展[J].陕西农业科学,2007,1:123-125.
[12]Li Q,Martinez JD.P53 is transported into the nucleus via an Hsf1-dependent nuclear localization mechanism[J].Mol Carcinog,2011,50:143-152.
Construction of the mitochondrial protein imported vector with EGFP and confirmation
QIAO Lu-xin,ZHANG Yu-lin,DING Wei,CHEN De-xi*
(Dept.of Infectious Diseases,the Affiliated Beijing Youan Hospital of Capital Medical University,Beijing100069,China)
ObjectiveTo construct a eukaryotic expression vector which can transport foreign protein into mitochondria.MethodsThe mitochondrial transit peptide's sequences were fused with EGFP through multiplex PCR amplification and inserted into the eukaryotic expression vector pcDNA3.1,constructing the eukaryotic expression vector pcDNA5.1-EGFP.Then the P53 gene was inserted into pcDNA5.1-EGFP and pcDNA3.1,constructing pcDNA5.1-P53 and pcDNA3.1-P53 vector.After verification by restriction enzyme digestion and sequencing,the plasmids were transfected into 293T cells for profiling the distribution of EFGP and cytochrome C in the cell,and the positioning of P53 protein in the cell.ResultsThe distribution of EGFP was consistent with cytochrome C,and the P53 protein expressed by pcDNA5.1-P53 was concentrated in mitochondria in the cytoplasm,while the vector pcDNA3.1-P53 was mainly distributed in the nucleus.ConclusionsThe eukaryotic expression vector was successfully constructed,which may transport foreign protein into the mitochondria.
expression vector;green fluorescent protein;mitochondrial transit peptide
R 34
A
1001-6325(2012)09-0992-06
2011-04-25
2011-12-15
国家“十一五”传染病重大专项(2008ZX10001-004,2008ZX10001-007);国家自然科学基金(30910103915,30870853)
*通信作者(corresponding author):dexi09@yahoo.com

