高效液相色谱法测定香蕉中的多菌灵、噻菌灵、甲基硫菌灵*
周雪晴,谢艳丽,张青,冯玉红
(1.海南省精细化工重点实验室,海口 570228;2. 海南大学分析测试中心,海口 570228; 3.海南大学环植学院,海口 570228)
高效液相色谱法测定香蕉中的多菌灵、噻菌灵、甲基硫菌灵*
周雪晴1,2,谢艳丽1,2,张青3,冯玉红1,2
(1.海南省精细化工重点实验室,海口 570228;2. 海南大学分析测试中心,海口 570228; 3.海南大学环植学院,海口 570228)
采用高效液相色谱法测定香蕉中的多菌灵、噻菌灵、甲基硫菌灵。样品经乙腈提取、硅胶柱净化后用HPLC法测定,外标法定量。对样品前处理和色谱分析条件进行了研究和优化。3种杀菌剂在确定的浓度范围内线性良好,相关系数r≥0.999。添加3个浓度水平标准品的回收率分别为:多菌灵80.5% ~ 91.2%,噻菌灵81.2% ~86.9%,68.9% ~ 72.6%。该法对多菌灵、噻菌灵、甲基硫菌灵3种杀菌剂的检出限较低,分别为0.008,0.009,0.015 mg/kg。该方法可满足香蕉中多菌灵、噻菌灵、甲基硫菌灵的残留限量检测要求。
香蕉;多菌灵;噻菌灵;甲基硫菌灵;高效液相色谱法
香蕉为热带水果,是华南地区主要经济作物之一。多菌灵、噻菌灵、甲基硫菌灵在防治香蕉病虫害中发挥着重要作用,它们都属于苯并咪唑类农药,这类物质在自然环境中降解较慢,对人、畜有一定的毒副作用[1]。近年来,随着人们对食品安全和绿色食品的重视,水果中农药残留问题日益突出[2,3]。目前有关多菌灵、噻菌灵单剂的残留检测较多,但同时分析香蕉中多菌灵、噻菌灵、甲基硫菌灵的相关方法少见报道[4]。笔者采用高效液相色谱法对香蕉中的多菌灵、噻菌灵和甲基硫菌灵进行提取分析,旨在建立一种高效、实用的香蕉中多菌灵、噻菌灵、甲基硫菌灵残留分析方法[5],为香蕉中农残的测定提供参考。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:2695型,2487紫外检测器,配 Xbridge C18柱 (150mm×4.6 mm,5μm),美 国Waters公司;
电子分析天平: AB265-S型,梅特勒-托利多仪器有限公司;
旋涡混匀器:IKA MS3 basic型,德国IKA公司;
高速分散器:IKA T25 digital ULTRA-TURRAX型,德国IKA公司;
氮吹仪:Zymark LV型,美国Caliper公司;
超声清洗机:KS-120EI型,宁波海曙科生超声设备有限公司;
真空干燥箱:VD23型,德国BINDER公司;
乙腈、甲醇:色谱纯, 美国Sigma公司;
丙酮、正己烷:分析纯;
超纯水:英国ELGA超纯水仪制备;
固相萃取柱:硅胶填料,500mg,6 m L容量;
针筒过滤器:0.22 μm, 上海兴亚净化材料厂;
多菌灵、噻菌灵、甲基硫菌灵标准品:浓度均为100μg /m L,农业部环境保护科研监测所。
1.2 色谱条件
色谱柱:Waters xbridge C18柱(4.6 mm×150mm,5 μm);流动相:乙腈-2 mmol/L乙酸铵溶液(体积比40∶60);流速:0.8 m L/m in;检测波长:280nm ;进样量:100μL。
1.3 样品制备
称取20g香蕉泥于150m L烧杯中,加入60m L乙腈,用匀浆机以转速15 000r/m in匀浆提取2 min 后用滤纸过滤,收集滤液于100m L具塞量筒中,加入干燥后的氯化钠振摇,静置后分层。准确吸取上层样品乙腈溶液40m L,用氮吹仪吹干,加入2 m L丙酮-正己烷(体积比1∶9)溶液溶解,待净化。
固相萃取柱分别通过10m L丙酮、5 m L正己烷预处理,加入待净化的样品溶液,再加入5 m L丙酮-正己烷(体积比1∶9),舍弃流出液。将20m L甲醇-丙酮(体积比1∶1)溶液分4次加入进行洗脱,收集洗脱液,于40℃旋转蒸发仪中浓缩至干,加入2 m L乙腈定容,待测定。
2 结果与讨论
2.1 检测波长的选择
用紫外分光光度计对多菌灵、噻菌灵和甲基硫菌灵标准溶液进行全波长扫描(180~ 900nm),结果表明在280nm有最大吸收,因此选择280nm作为检测波长。
2.2 流动相及洗脱条件的选择
分别试验不同比例的甲醇-水、甲醇-缓冲盐体系、乙腈-水、乙腈-乙酸铵溶液等混合溶剂体系对3种农药的分离效果,结果表明,甲醇与水的体积比为60∶40、流速为0.8 m L/m in时,3种农药的谱图相互重叠;甲醇与磷酸盐缓冲液(pH 6.8)体积比为60∶40时,3种农药能分开,但是保留时间较长,而且磷酸盐对色谱柱及仪器的维护影响较大;乙腈与水的体积比为40∶60时,3种农药能分开,但分离度不理想;流动相为乙腈-2 mmol/L乙酸铵溶液(体积比40∶60)时,3种农药能完全分开,而且峰型较好。
在优化的色谱条件下,多菌灵、噻菌灵、甲基硫菌灵混合标准品的色谱峰见图1。

图1 多菌灵、噻菌灵、甲基硫菌灵混合标准品的色谱图
2.3 提取溶剂的选择
比较了乙酸乙酯、乙腈两种溶剂的提取效果,结果见表1。从表1可以看出,样品用乙腈提取的效果较好,回收率较高,重现性较好;乙酸乙酯提取效果差,并且乙酸乙酯与水分层不明显,导致样品损失较大,重现性差,所以选择乙腈作提取溶剂。

表1 不同提取溶剂的回收率结果
2.4 标准曲线与线性关系
准确移取多菌灵、噻菌灵、甲基硫菌灵农药标准品(浓度均为100μg/m L)各 1 m L于5 m L容量瓶中,定容得20μg/m L混合标准溶液,逐级稀释至浓度分别为 4,2,1,0.5,0.2,0.1 μg/m L。在实验确定的最佳色谱分离条件下进行色谱测定,以各组分的峰面积(y)对样品浓度(x)做标准曲线,结果见表2。
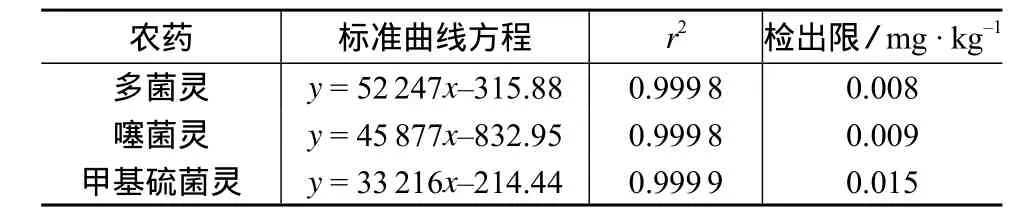
表2 多菌灵、噻菌灵、甲基硫菌灵的标准曲线和检出限
实验表明,多菌灵、噻菌灵、甲基硫菌灵3种农药在0.1~10μg/m L范围内线性相关性良好,r2均大于0.999,按照信噪比S/N=3得到该方法对多菌灵、噻菌灵、甲基硫菌灵的检出限分别为0.008,0.009,0.015 mg/kg,可以满足香蕉样品的最高残留限量(MRL)的检测要求[6]。
2.5 回收试验
在空白香蕉样品中分别添加3种浓度的混合标准溶液,每种浓度做3次平行试验,按照上述样品前处理方法和仪器工作条件进行试验,用外标法定量,计算回收率,结果见表3。
由表3可知,多菌灵、噻菌灵、甲基硫菌灵的加标回收率分别为 80.5%~91.2%,81.2%~86.9%,68.9%~72.6%,满足农残分析准确度要求。

表3 回收试验结果( n=3)
2.6 样品测定结果
取海南市场上不同品种的香蕉样品,按1.3样品处理方法进行提取浓缩,用2 m L乙腈定容后进行液相色谱检测,图2是香蕉样品的色谱图(其中甲基硫菌灵未检出)。表4是不同样品的检测结果。
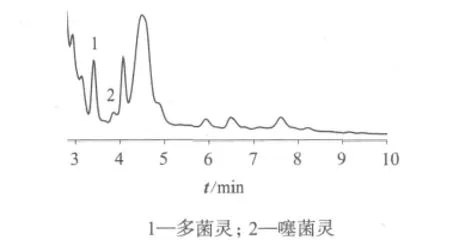
图2 香蕉样品的色谱图

表4 不同香蕉样品农残检测结果
通过与多菌灵、噻菌灵、甲基硫菌灵的标准色谱峰保留时间对比,得到不同样品中的农残检测结果。由表4可以看出,只有HN008样品中3种农残没有检出,其它样品中都检出一种或几种农残,均小于国家标准规定食品中农药最大残留限量的要求:多菌灵0.5 mg/kg(香蕉),噻菌灵5 mg/kg(香蕉),甲基硫菌灵 1 mg/kg(香蕉 )[6]。
3 结语
采用液相色谱法对香蕉样品的农残进行检测,香蕉样品中的多菌灵、噻菌灵、甲基硫菌灵得到了较好的分离,该方法准确可靠,灵敏度高。
[1]刘杰,杨春亮,查玉兵,等. 高效液相色谱法-荧光检测器同时检测龙眼中多菌灵和噻菌灵残留[J]. 广东农业科学,2010(3):150-152.
[2]NY/T 1453-2007 蔬菜及水果中多菌灵等16种农药残留测定液相色谱-质谱-质谱联用法[S].
[3]盛灵慧,赵正宜,王晶,等. 液相色谱法测定多元维生素片中4中水溶性维生素[J]. 化学分析计量,2010,19(1): 30-32.
[4]廖涛,杨玉平,程薇,等. 苹果中多菌灵、噻菌灵和甲基托布津的高效液相色谱法分析[J]. 分析测试技术与仪器,2010,16(4):257-261.
[5]Filigenzi M S, Puscher B, Aston L S, et al. Dterm ination of melam ine and related compounds in kidney tissue by liquid chromatography / tandem mass spectrometey[J]. J Agri Food Chem,2008,56(17): 7 593-7 599.
[6]GB 2763-2005 食品中农药最大残留限量[S].
Determ ination of Carbendazim, Thiabendazole and M ethylthiophanate in Banana by High Performance Liquid Chromatography
Zhou Xueqing1,2, Xie Yanli1,2, Zhang Qing3, Feng Yuhong1,2
(1. Hainan Provincial Key Lab of Fine Chem., Haikou 570228, China;2. Chemical Analytical and Testing Center of Hainan University,
Haikou 570228, China;3. College of Environment and Plant Protection of Hainan University, Haikou 570228, China)
A method of high performance liquid chromatographic(HPLC) was developed to determ ine the residues of carbendazim, thiabendazole and methylthiophanate in banana. Samples extracted w ith acetonitrile, extracts were cleaned up by silica gel column. Analytical samples were determined by HPLC and quantified by external standard method. The average recoveries spiked in banana at three concentration levels of carbendazim, thiabendazole and methylthiophanate were 80.5%-91.2%, 81.2%-86.9%, 68.9%-72.6%, respectively. The detection lim its of carbendazim, thiabendazole and methylthiophanate in banana samples were 0.008, 0.009, 0.015 mg/kg, respectively. The result showed the method is suitable for the determ ination of carbendazim, thiabendazole and methylthiophanate in banana.
banana; carbendazim; thiabendazole; methylthiophanate; HPLC
O657.7
A
1008–6145(2012)02–0034–03
10.3969/j.issn.1008–6145.2012.02.010
*海南大学2010年青年基金项目(qnjj1003); 海南大学研究生创新平台科研项目基金
联系人:周雪晴;E-mail: zhouxueqing001@sina.com
2011-12-15

