异丙酚和地卓西平马来酸盐对电休克后抑郁模型大鼠学习记忆和Tau蛋白过度磷酸化的影响
刘 超,闵 苏,魏 珂,刘 东,董 军,罗 洁,黎 平,刘小滨
1重庆医科大学附属第一医院麻醉科,重庆 400016 2天津医科大学第二医院神经外科,天津 300211
异丙酚和地卓西平马来酸盐对电休克后抑郁模型大鼠学习记忆和Tau蛋白过度磷酸化的影响
刘 超1,闵 苏1,魏 珂1,刘 东2,董 军1,罗 洁1,黎 平1,刘小滨1
1重庆医科大学附属第一医院麻醉科,重庆 4000162天津医科大学第二医院神经外科,天津 300211
目的观察异丙酚和地卓西平马来酸盐 (MK-801)对电休克 (ECT)后抑郁模型大鼠学习记忆和Tau蛋白过度磷酸化的影响。方法按析因设计干预因素,即ECT(2水平:无处置和1个疗程ECT)和药物 (3水平:腹腔注射生理盐水、异丙酚和MK-801),采用Morris水迷宫检测认知能力,高效液相色谱法检测谷氨酸 (Glu)含量,Western blot检测Tau5、PHF-1(pSer396/404)、AT8(pSer199/202)、12E8(pSer262)在大鼠海马中的表达。结果异丙酚、MK-801及ECT均可造成大鼠学习记忆障碍,ECT可明显增加海马中Glu浓度,异丙酚可降低海马中Glu浓度,MK-801对海马中Glu浓度无明显影响。ECT可增加海马中磷酸化Tau蛋白的表达,异丙酚和MK-801可减少海马中磷酸化Tau蛋白的表达。结论异丙酚和MK-801可能是通过降低海马Glu浓度,减缓Tau蛋白的磷酸化程度,进而改善认知能力。
异丙酚;N-甲基-D-天门冬氨酸受体拮抗剂;电休克;学习记忆;Tau蛋白
电休克 (electroconvulsive therapy,ECT)后出现的认知障碍与谷氨酸 (glutamic acid,Glu)浓度过高引起的兴奋性毒性[1]及其诱发的氧化应激有关[2]。Glu对学习记忆具有双向作用,适当浓度的Glu可激动N-甲基-D-天门冬氨酸受体 (N-methyl-d-aspartate receptor,NMDAR),有助于记忆形成[3];但若 Glu过高,则会过度激动Glu受体,导致Ca2+大量内流,进而激活对Ca2+敏感的酶,产生氧自由基,破坏细胞超微结构。Glu系统过度激活可诱导海马Tau蛋白过度磷酸化[4]。Tau蛋白集中分布在轴突和树突,为高度不对称的磷蛋白,可促进轴突微管的装配和稳定,影响神经细胞轴突的物质运输,促进神经元生长发育[5],其磷酸化程度是调节Tau蛋白功能的主要手段[6]。Tau被异常磷酸化后可发生错误折叠、分子聚集[7],削弱其结合稳定微管的功能,造成递质运输障碍,导致认知障碍[8]。异丙酚可作为NMDAR拮抗剂发挥作用[9],可抑制Glu的生成、释放和转运。此外,其苯环基团可非竞争性拮抗NMDAR,缩短兴奋性突触后电位持续时间,减轻ECT导致的认知障碍[1,10]。本研究评估了 Glu受体拮抗剂地卓西平马来酸盐 (dizocilpine maleate,MK-801)和异丙酚对ECT后抑郁模型大鼠学习记忆和Tau蛋白磷酸化的影响。
材料和方法
主要试剂及仪器 纯品MK-801(美国Sigma公司),异丙酚 (英国阿斯利康公司),色谱级L-谷氨酸 (L-Glutamic acid,美国 Sigma公司),小鼠抗牛Tau5单克隆抗体 (美国 Millipore公司),兔抗牛PHF-1(pSer396/404)单克隆抗体 (英国Abcam公司),兔抗人AT8(pSer199/202)多克隆抗体 (美国Invitrogen公司),兔抗人12E8(pSer262)多克隆抗体 (美国Life Span Biosciences公司);DAB显色试剂盒、BCA蛋白浓度测定试剂盒 (上海碧云天公司);HPD-25D型无油隔膜真空泵 (上海鲁硕公司),YDJZ-Ⅱ型医用微型电动磨钻 (上海慧恩公司),Harvard啮齿类动物电休克仪 (美国自然基因有限公司),Morris水迷宫视频分析系统 (北京军事医学科学院),高效液相色谱 (high performance liquid chromatography,HPLC)色谱系统 (美国 Waters公司),蛋白电泳系统 (美国Bio-rad公司),金盘多媒体图像处理系统 (成都金盘公司),光学显微照相系统(Olympus-45,日本Olympus公司)。
实验动物及模型建立 24周健康雄性SD大鼠,体重250~300 g,由天津医科大学实验动物科学部提供,置通风良好、12 h明暗交替、自由饮水摄食条件,每日触摸2 min。适应性饲养1周后,建立嗅球切除抑郁模型[11-12]:2.75%戊巴比妥钠 (55 mg/kg)皮下注射麻醉,在两耳联线中点切皮,暴露颅骨,在距前囟前7~8 mm、正中缝两侧旁开2 mm的交点,钻2个直径2 mm小孔,用探针搅动破坏嗅球后用真空泵将破坏的嗅球组织全部吸出。以吸收性明胶海绵填入止血,青霉素 (20万U/ml)冲洗,缝合皮肤,肌注青霉素钠4万U/只,连续给药3 d。术后每日对大鼠抚摸、称重,2周后进行旷场测试,于晨9时开始,选取水平计分和垂直计分之和在30~90分间的48只大鼠。本实验经重庆医科大学动物伦理委员会批准,按美国医学研究协会《实验动物处理原则》及美国国家卫生研究院《实验动物使用和处理指南》进行,行孤笼饲养,循双盲原则。
实验设计及分组 采用2×3析因设计:将每只大鼠视为1个单位,予两个处理因素,即ECT(2水平:无处置、施行1疗程ECT)和药物 (3水平:腹腔注射生理盐水、异丙酚、MK-801),共6组。将48只嗅球切除抑郁模型大鼠随机分为6个实验组,每组8只:Ⅰ组 (5 ml生理盐水 ip),Ⅱ组 (5 ml MK-801 ip,10 mg/kg),Ⅲ组 (5 ml MK-801 ip,10 mg/kg+1个疗程ECT),Ⅳ组 (5 ml异丙酚ip,200 mg/kg),Ⅴ组 (5 ml异丙酚 ip,200 mg/kg+1个疗程 ECT);Ⅵ组 (5 ml生理盐水ip+1个疗程ECT)。
ECT处置 施行ECT前15 min注射相应药物,于大鼠双颞侧安放电极,采用Harvard啮齿类动物电休克仪行ECT处理,予方波 (单个正弦半波20 ms),电流50 mA,频率50 Hz,持续1 s电刺激,引起强直阵挛抽搐发作视为ECT成功[13],隔天1次,共7次,均于晨9时进行。不施行ECT的组在同样时间、以同样频率和剂量注射相应药物。
大鼠学习记忆功能检测 采用Morris水迷宫视频分析系统,全部ECT结束后行Morris水迷宫检测。Morris水迷宫均分为Ⅰ、Ⅱ、Ⅲ、Ⅳ4个象限。训练前,水迷宫内盛自来水,加墨汁使水浑浊,检测前将平台置Ⅰ象限水面下2 cm。实验在9:00~15:00间进行,保持室内安静,物品放置及灯光状态一致,水温 (24±1)℃。Morris 1.0软件跟踪记录分析相关数据。第1~6天进行定位航行实验:检测前将平台置Ⅰ象限正中水面下2 cm,按逆时针方向分别从Ⅰ、Ⅱ、Ⅲ、Ⅳ4个象限将大鼠面向池壁置水中,观察计时120 s。摄像记录大鼠寻找并爬上平台的时间,计为逃避潜伏期;若120 s内未找到平台,则引其至平台,停留30 s,逃避潜伏期记为120 s。检测结束后以第1~6天逃避潜伏期的平均值为学习成绩,越短显示大鼠的学习能力越好。第7天进行空间探索实验:撤平台,将大鼠从距原平台最远的Ⅲ象限面向池壁放入水中,摄录大鼠在60 s内各象限游泳时间,以原平台象限Ⅰ象限游泳时间即空间探索时间作为记忆成绩,越长显示大鼠记忆能力越好。
样本采集及保存 Morris水迷宫测试结束后取海马,具体为:麻醉后快速断头取脑,在DEPC冰面上吸除血迹,分离海马,左侧海马用锡箔纸包裹,置液氮中过夜,然后-80℃保存;右侧海马称重,加1 ml甲醇-水离心液,低温匀浆,4℃ 10 000×g离心15 min,取上清液,滤膜过滤后-80℃保存。
海马中Glu含量的检测
样本:处理好的右侧海马匀浆上清液。
试剂:Glu色谱级标准品,OPA(分析纯,上海碧云天公司),β-巯基乙醇 (美国 Amresco公司),甲醇 (色谱级,上海碧云天公司)。
仪器及色谱条件:Centrifuge 5810R型低温高速离心机 (德国Eppendof公司);HPLC色谱系统 (美国Waters公司),包括600泵、荧光2475检测器、Empower色谱工作站;18-ODS色谱柱 (美国Dima公司),柱温35℃。流动相A:0.1 mol/L醋酸钾,流动相B:甲醇。进行二元梯度洗脱,梯度洗脱程序:(T,B%)(0,45%)(1,65%)(6,75%)(20,45%),T指时间 (单位:min),B%指B流动相所占的比例。流动相经0.45 μm微孔滤膜过滤,超声脱气。流速1.0 ml/min,激发波长250 nm,发射波长410 nm,以Glu峰面积定量。
衍生化试剂配制:将20 mg OPA溶于500 μl甲醇中,超声溶解,加入β-巯基乙醇500 μl,再加入9 ml pH 10.0的硼酸缓冲液,避光密封后0~4℃保存。
氨基酸标准液配制:Glu标准品配成100 μmol/L的标准溶液,测前稀释。取100 μl标准液或者组织样品液置EP管中,加100 μl衍生化试剂反应2 min,进样 20 μl。
Glu标准曲线建立:配制浓度分别为0.150、0.300、0.735、1.470、2.940、3.675、5.880 mg/L的Glu标准溶液,衍生化处理后测定。采用外标法进行定量分析,以峰面积 (Y)对其浓度 (X)进行直线回归,得到线性方程。
Glu含量测定:每1 ml匀浆上清液加0.75 ml 4%碳酸氢钠溶液混匀,4℃ 3000 r/min离心5 min,取上清液过0.45 μm滤膜,分装。然后取该分装液24 μl,在进样瓶中加入衍生试剂12 μl,四硼酸钠缓冲液 (pH 9.18)960 μl,混匀,温度控制在20℃下静置3 min后依次进样,梯度洗脱,测定Glu含量。
海马中Tau蛋白含量检测 取左侧海马匀浆,取0.2 g经Western blot检测及IP细胞裂解液提取蛋白,用BCA蛋白浓度测定试剂盒测定蛋白浓度,据此调节蛋白浓度一致。取等量蛋白样品,用5×SDS加样缓冲液按体积比1∶1稀释待测样品,于100℃煮沸5 min;另用1×SDS加样缓冲液溶解预染蛋白质相对分子质量标准混合物,于100℃煮沸3 min。取待测标本15 μl上样 [甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,GRPDH)作为蛋白质上样量的标定],经SDS-PAGE电泳至预染标准混合物所示目的条带出现为止,湿法将蛋白条带电转至Immun-blot PVDF膜,50 g/L脱脂奶粉封闭3 h,加相应抗体 [小鼠抗牛Tau5单克隆抗体、兔抗牛PHF-1(pSer396/404)单克隆抗体、兔抗人AT8(pS-er199/202)多克隆抗体、兔抗人12E8(pSer262多克隆抗体)(1∶200)],4℃孵育过夜,用相应辣根酶标记IgG(1∶200)37℃孵育2 h,DAB显色,金盘多媒体图像处理系统测定阳性条带的积分光密度值。
结 果
MK-801、异丙酚和ECT对大鼠学习记忆功能的影响 MK-801、异丙酚和ECT均可造成学习记忆障碍,即延长逃避潜伏期 (ECT:F=15.185,P=0.000;MK-801和异丙酚:F=18.591,P=0.000)并缩短空间探索时间 (ECT:F=9.609,P=0.003;MK-801和异丙酚:F=18.591,P=0.000);两者的影响相减 (逃避潜伏期:F=112.366,P=0.000;空间探索时间:F=7.603,P=0.002)(表1、2)。
ECT和异丙酚对海马Glu含量的影响 ECT可增加海马中Glu的浓度 (F=234.540,P=0.000),异丙酚可减少海马中Glu的浓度 (F=16.971,P=0.000),两者存在相减效应 (F=11.190,P=0.000)(表3)。
MK-801、异丙酚和ECT对海马中Tau蛋白含量的影响 MK-801、异丙酚和ECT对海马总Tau蛋白(Tau5蛋白)的表达无影响 (ECT:F=0.748,P=0.393;MK-801、异丙酚:F=0.028,P=0.972),且无交互效应 (F=0.145,P=0.865)。ECT可增加海马中磷酸化Tau蛋白的表达 (pSer396/404:F=40.906,P=0.000;pSer199/202:F=175.859,P=0.000;pSer262:F=49.551,P=0.000)。实验药物 (NMDAR拮抗剂和异丙酚)可减少海马中磷酸化Tau蛋白(pSer396/404:F=52.523,P=0.000;pSer199/202:F=77.013,P=0.000;pSer262:F=77.204,P=0.000)。两者的影响相减 (pSer396/404:F=4.294,P=0.020;pSer199/202:F=15.730,P=0.000;pSer262:F=9.989,P=0.000)(表4~7)。
表1 Morris水迷宫学习记忆成绩:逃避潜伏期 (n=8,± s,s)Tablet 1 Morris water maze test:evasive latency time(n=8,± s,s)
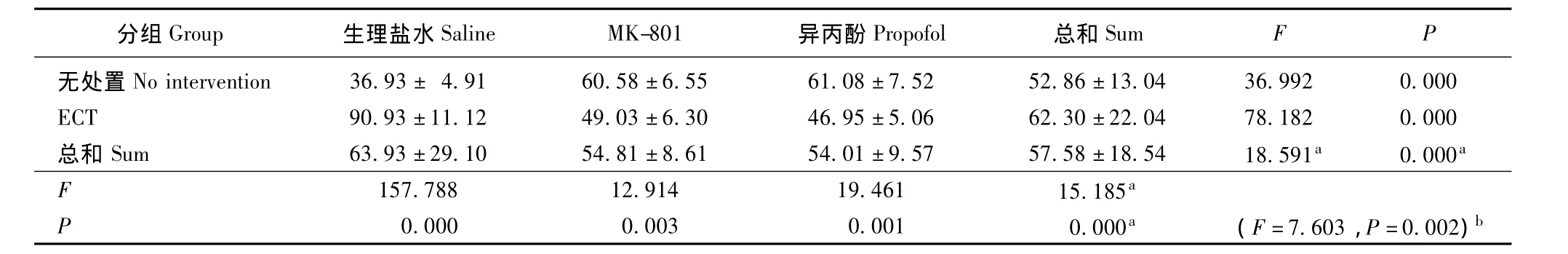
表1 Morris水迷宫学习记忆成绩:逃避潜伏期 (n=8,± s,s)Tablet 1 Morris water maze test:evasive latency time(n=8,± s,s)
ECT:电休克;MK-801:地卓西平马来酸盐;a:主效应;b:交互效应ECT:electroconvulsive therapy;MK-801:dizocilpine maleate;a:main effect;b:crossover effect
分组G r o u p 生理盐水S a l i n e M K-8 0 1 异丙酚P r o p o f o l 总和S u m FP无处置N o i n t e r v e n t i o n 3 6.9 3± 4.9 1 6 0.5 8±6.5 5 6 1.0 8±7.5 2 5 2.8 6±1 3.0 4 3 6.9 9 2 0.0 0 0 E C T 9 0.9 3±1 1.1 2 4 9.0 3±6.3 0 4 6.9 5±5.0 6 6 2.3 0±2 2.0 4 7 8.1 8 2 0.0 0 0总和S u m 6 3.9 3±2 9.1 0 5 4.8 1±8.6 1 5 4.0 1±9.5 7 5 7.5 8±1 8.5 4 1 8.5 9 1 a 0.0 0 0 a F 1 5 7.7 8 8 1 2.9 1 4 1 9.4 6 1 1 5.1 8 5 P a 0.0 0 0 0.0 0 3 0.0 0 1 0.0 0 0 a (F=7.6 0 3,P=0.0 0 2)b
表2 Morris水迷宫学习记忆成绩:空间探索时间 (n=8,± s,s)Tablet 2 Morris water maze test:space exploration time(n=8,± s,s)
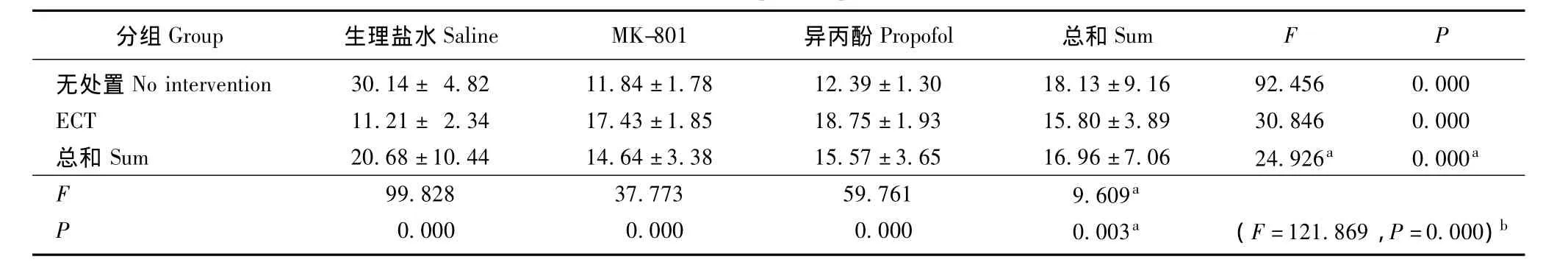
表2 Morris水迷宫学习记忆成绩:空间探索时间 (n=8,± s,s)Tablet 2 Morris water maze test:space exploration time(n=8,± s,s)
a:主效应;b:交互效应a:main effect;b:crossover effect
分组G r o u p 生理盐水S a l i n e M K-8 0 1 异丙酚P r o p o f o l 总和S u m FP无处置N o i n t e r v e n t i o n 3 0.1 4± 4.8 2 1 1.8 4±1.7 8 1 2.3 9±1.3 0 1 8.1 3±9.1 6 9 2.4 5 6 0.0 0 0 E C T 1 1.2 1± 2.3 4 1 7.4 3±1.8 5 1 8.7 5±1.9 3 1 5.8 0±3.8 9 3 0.8 4 6 0.0 0 0总和 S u m 2 0.6 8±1 0.4 4 1 4.6 4±3.3 8 1 5.5 7±3.6 5 1 6.9 6±7.0 6 2 4.9 2 6 a 0.0 0 0 a F 9 9.8 2 8 3 7.7 7 3 5 9.7 6 1 9.6 0 9 P a 0.0 0 0 0.0 0 0 0.0 0 0 0.0 0 3 a (F=1 2 1.8 6 9,P=0.0 0 0)b
表3 海马中Glu的含量 (n=8,± s,μmol/g蛋白)Tablet 3 Glutamate level in the hippocampus of rats(n=8,± s,μmol/g protein)
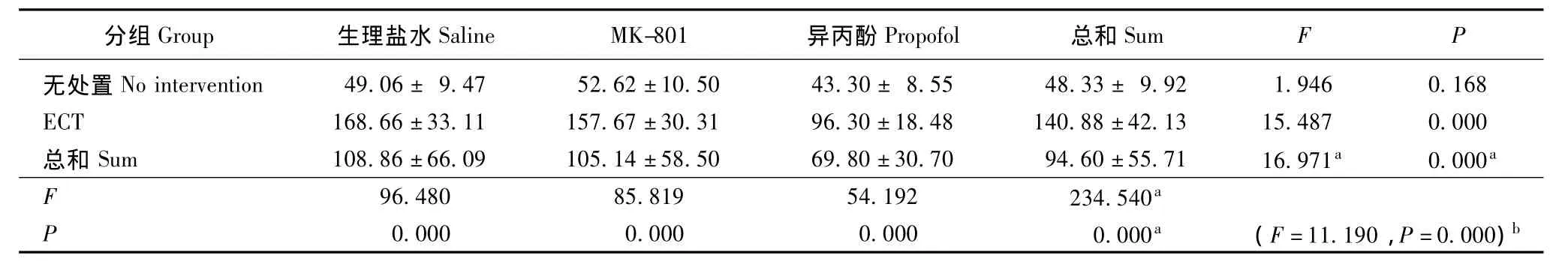
表3 海马中Glu的含量 (n=8,± s,μmol/g蛋白)Tablet 3 Glutamate level in the hippocampus of rats(n=8,± s,μmol/g protein)
a:主效应;b:交互效应a:main effect;b:crossover effect
分组G r o u p 生理盐水S a l i n e M K-8 0 1 异丙酚P r o p o f o l 总和S u m FP无处置N o i n t e r v e n t i o n 4 9.0 6± 9.4 7 5 2.6 2±1 0.5 0 4 3.3 0± 8.5 5 4 8.3 3± 9.9 2 1.9 4 6 0.1 6 8 E C T 1 6 8.6 6±3 3.1 1 1 5 7.6 7±3 0.3 1 9 6.3 0±1 8.4 8 1 4 0.8 8±4 2.1 3 1 5.4 8 7 0.0 0 0总和S u m 1 0 8.8 6±6 6.0 9 1 0 5.1 4±5 8.5 0 6 9.8 0±3 0.7 0 9 4.6 0±5 5.7 1 1 6.9 7 1 a 0.0 0 0 a F 9 6.4 8 0 8 5.8 1 9 5 4.1 9 2 2 3 4.5 4 0 P a 0.0 0 0 0.0 0 0 0.0 0 0 0.0 0 0 a (F=1 1.1 9 0,P=0.0 0 0)b
讨 论
ECT后认知障碍与Glu受体过度激动引起氧化应激,进而导致海马长时程增强饱和,造成突触可塑性障碍有关[10]。本研究观察到ECT后Glu在神经元中浓度明显升高,与Wu等[4]研究结果一致。
表4 海马中Tau蛋白总含量 (n=8,± s,积分吸光度值)Tablet 4 Tau5 protein level in the hippocampus of rats(n=8,± s,integral absorbance value)
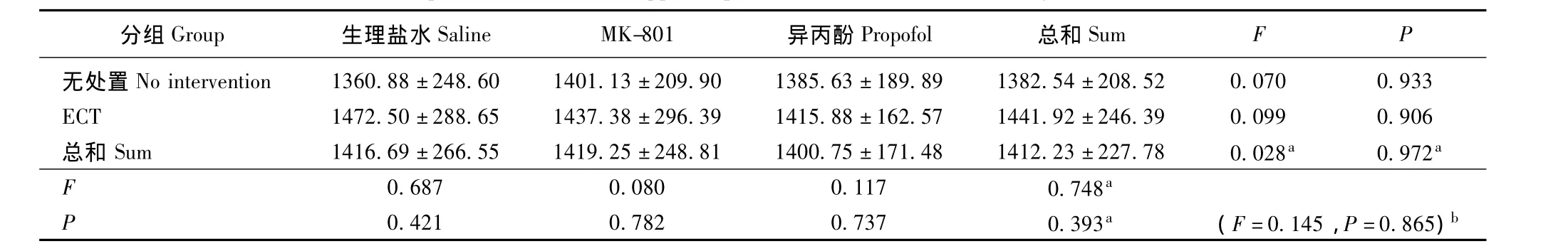
表4 海马中Tau蛋白总含量 (n=8,± s,积分吸光度值)Tablet 4 Tau5 protein level in the hippocampus of rats(n=8,± s,integral absorbance value)
a:主效应;b:交互效应a:main effect;b:crossover effect
分组Group 生理盐水Saline MK-801 异丙酚Propofol 总和Sum FP无处置No intervention 1360.88±248.60 1401.13±209.90 1385.63±189.89 1382.54±208.52 0.070 0.933 ECT 1472.50±288.65 1437.38±296.39 1415.88±162.57 1441.92±246.39 0.099 0.906总和 Sum 1416.69±266.55 1419.25±248.81 1400.75±171.48 1412.23±227.78 0.028a 0.972a F 0.687 0.080 0.117 0.748 P a 0.421 0.782 0.737 0.393a (F=0.145,P=0.865)b
表5 海马中pSer396/404的含量 (n=8,± s,积分吸光度值)Tablet 5 pSer396/404level in the hippocampus of rats(n=8,± s,integral absorbance value)
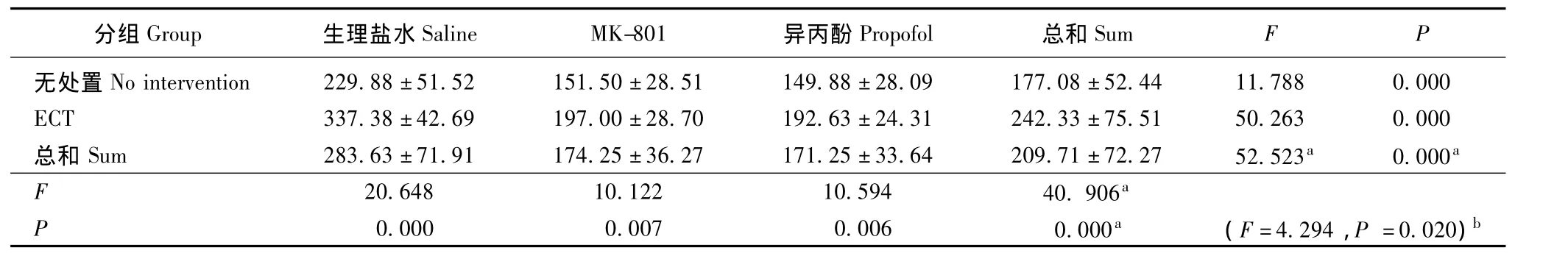
表5 海马中pSer396/404的含量 (n=8,± s,积分吸光度值)Tablet 5 pSer396/404level in the hippocampus of rats(n=8,± s,integral absorbance value)
a:主效应;b:交互效应a:main effect;b:crossover effect
分组Group 生理盐水Saline MK-801 异丙酚Propofol 总和SumFP无处置No intervention 229.88±51.52 151.50±28.51 149.88±28.09 177.08±52.44 11.788 0.000 ECT 337.38±42.69 197.00±28.70 192.63±24.31 242.33±75.51 50.263 0.000总和 Sum 283.63±71.91 174.25±36.27 171.25±33.64 209.71±72.27 52.523a 0.000a F 20.648 10.122 10.594 40.906 P a 0.000 0.007 0.006 0.000a (F=4.294,P=0.020)b
表6 在海马中pSer199/202含量 (n=8,± s,积分吸光度值)Tablet 6 pSer199/202level in the hippocampus of rats(n=8,± s,integral absorbance value)
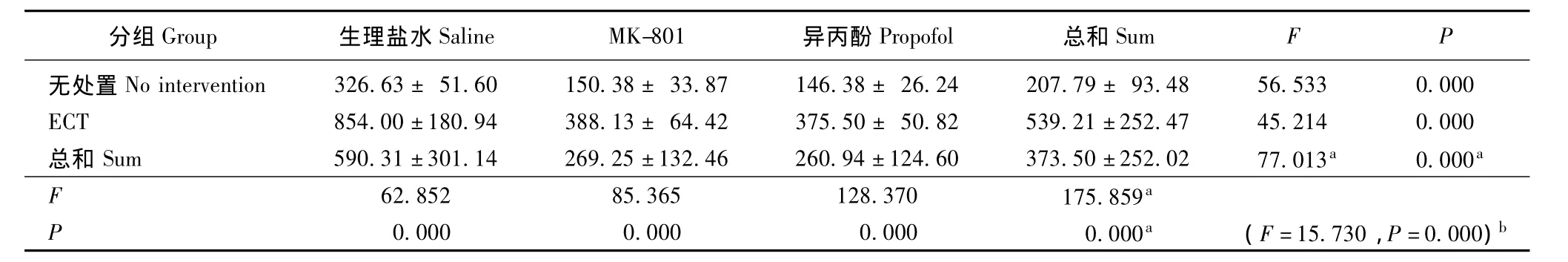
表6 在海马中pSer199/202含量 (n=8,± s,积分吸光度值)Tablet 6 pSer199/202level in the hippocampus of rats(n=8,± s,integral absorbance value)
a:主效应;b:交互效应a:main effect;b:crossover effect
分组Group 生理盐水Saline MK-801 异丙酚Propofol 总和SumFP无处置No intervention 326.63±51.60 150.38±33.87 146.38±26.24 207.79±93.48 56.533 0.000 ECT 854.00±180.94 388.13± 64.42 375.50± 50.82 539.21±252.47 45.214 0.000总和Sum 590.31±301.14 269.25±132.46 260.94±124.60 373.50±252.02 77.013a 0.000a F 62.852 85.365 128.370 175.859 P a 0.000 0.000 0.000 0.000a (F=15.730,P=0.000)b
表7 海马中pSer262含量 (n=8,± s,积分吸光度值)Tablet 7 pSer262level in the hippocampus of rats(n=8,± s,integral absorbance value)
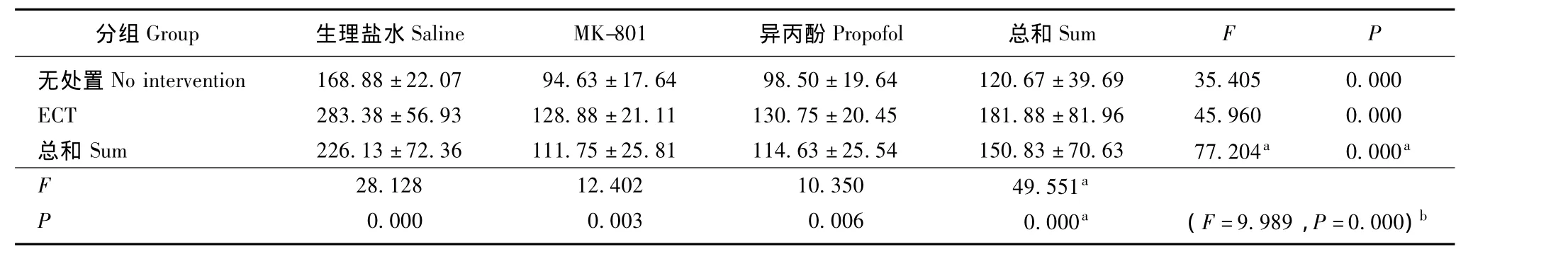
表7 海马中pSer262含量 (n=8,± s,积分吸光度值)Tablet 7 pSer262level in the hippocampus of rats(n=8,± s,integral absorbance value)
a:主效应;b:交互效应a:main effect;b:crossover effect
分组Group 生理盐水Saline MK-801 异丙酚Propofol 总和SumFP无处置No intervention 168.88±22.07 94.63±17.64 98.50±19.64 120.67±39.69 35.405 0.000 ECT 283.38±56.93 128.88±21.11 130.75±20.45 181.88±81.96 45.960 0.000总和 Sum 226.13±72.36 111.75±25.81 114.63±25.54 150.83±70.63 77.204a 0.000a F 28.128 12.402 10.350 49.551 P a 0.000 0.003 0.006 0.000a (F=9.989,P=0.000)b
本研究结果显示,ECT后海马Glu浓度明显上升同时伴有认知能力减退,而使用NMDAR拮抗剂后,Glu受体过度激动造成的学习记忆障碍缓解,该结果与以往实验结果[10]相同。异丙酚可降低ECT后海马中的Glu,亦可改善ECT后的学习记忆,与以往实验结果[1,10]亦相同,且NMDAR拮抗剂MK-801与异丙酚改善ECT后认知功能的效果类似。
本研究还发现,异丙酚和MK-801保护ECT后学习记忆过程与减轻海马中Tau蛋白过度磷酸化程度有关,总Tau蛋白的表达在ECT应激前后没有明显变化,而Ser199/202位点磷酸化程度与ECT应激关系紧密,推测这可能与Ser199/202位于微管结合区,其磷酸化参与调节Tau蛋白与微管的结合活性[14]有关。
NMDAR激动可以增加Tau磷酸化程度,从而损伤神经元[15];而NMDAR可阻断Glu的兴奋性毒性,使经由Tau蛋白过度磷酸化程度而造成的神经损伤过程中断。故可推测ECT作为强应激导致海马Glu浓度升高,而Glu激动离子型受体通过引发兴奋性毒性增加海马Tau蛋白磷酸化程度,最终影响降低轴突转运效率,神经信号传递障碍及突触退化,导致学习记忆功能障碍。其中,海马Tau蛋白过磷酸化后会导致神经递质运输障碍,可进一步造成Glu在受损神经元的积聚,形成恶性循环,加重神经元损伤程度。如研究结果所示,若阻断其中某一环节(如使用异丙酚降低脑内Glu或使用NMDAR拮抗剂),则ECT等应激所致海马Tau蛋白过磷酸化程度会明显减缓,同时学习记忆障碍会相应缓解。
[1]Luo J,Min S,Wei K,et al.Propofol protects against impairment of learning-memory and imbalance of hippocampal Glu/GABA induced by electroconvulsive shock in depressed rats[J].J Anesth,2011,25(5):657-665.
[2]Andrade C,Singh NM,Thyagarajan S,et al.Possible glutamatergic and lipid signalling mechanisms in ECT-induced retrograde amnesia:experimental evidence for involvement of COX-2,and review of literature [J].J Psychiatr Res,2008,42(10):837-850.
[3]Kloda A,Martinac B,Adams DJ.Polymodal regulation of NMDA receptor channels[J].Channels(Austin),2007,1(5):334-343.
[4]Wu FY,Feng Q,Cheng M,et al.The activation of excitatory amino acid receptors is involved in tau phosphorylation induced by cold water stress[J].Prog Biochem Biophys,2010,37(5):510-516.
[5]Weingarten MD,Lockwood AH,Hwo SY,et al.A protein factor essential for microtubule assembly[J].Proc Natl Acad Sci USA,1975,72(5):1858-1862.
[6]De Calignon A,Fox LM,Pitstick R,et al.Caspase activation precedes and leads to tangles[J].Nature,2010,464(16):1201-1204.
[7]李芳序,卢静,许亚杰,等.老年性痴呆发病过程中内源性甲醛慢性损伤机制 [J].生物化学与生物物理进展,2008,35(4):393-400.
[8]Onishi T,Iwashita H,Uno Y,et al.A novel glycogen synthase kinase-3 Inhibitor 2-methyl-5-(3-{4-[(S)-methylsulfinyl]phenyl}-1-benzofuran-5-yl)-1,3,4-oxadiazole(MMBO)decreases tau phosphorylation and ameliorates cognitive deficits in a transgenic model of Alzheimer's disease[J].J Neurochem,2011,119(6):1130-1140.
[9]Kingston S,Mao LM,Yang L,et al.propofol inhibits phosphorylation of N-methyl-D-aspartate receptor NR1 subunits in neurons[J].Anesthesiology,2006,104(4):736-739.
[10]Dong J,Min S,Wei K,et al.Effects of electroconvulsive therapy and propofol on spatial memory and glutamatergic system in hippocampus of depressed rats [J].J ECT,2010,26(2):126-130.
[11]Wang D,Noda Y,Tsunekawa H,et al.Bshavioural and neurochemical feaures of olfactory bulbertomized rats resembling depression with comorbid anixiety [J].Behav Brain Res,2007,178(2):262-273.
[12]Tasset I,Medina FJ,Pena J,et al.Olfactory bulberctomy induced oxidative and cell damage in rat:protective effect of melatoni[J].Physiol Res,2010,59(2):105-112.
[13]Altar CA,Laeng P,Jurata LW,et al.Electroconvulsive seizures regulate gene expression of distinct neurotrophic signaling pathways [J].J Neuresci,2004,24(11):2667-2677.
[14]Bibow S,Mukrasch MD,Chinnathambi S,et al.The dynamic structure of filamentous tau[J].Angew Chem Int Ed Engl,2011,50(48):11520-11524.
[15]Vossel KA,Zhang K,Brodbeck J,et al.Tau reduction prevents abeta-induced defects in axonal transport[J].Science,2010,333(6001):198.
Effects of Propofol and Dizocilpine Maleate on the Cognitive Abilities and the Hyperphosphorylation of Tau Protein of Rats after the Electroconvulsive Therapy
LIU Chao1,MIN Su1,WEI Ke1,LIU Dong2,DONG Jun1,LUO Jie1,LI Ping,LIU Xiao-Bin1
1Department of Anesthesiology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
2Department of Neurosurgery,the Second Hospital of Tianjin Medical University,Tianjin 300211,China
MIN Su Tel:023-89011068,E-mail:minsu89011068@yahoo.com.cn
ObjectiveTo explore the effects of propofol and dizocilpine maleate(MK-801)on the cognitive abilities the hyperphosphorylation of Tau protein of rats after the electroconvulsive therapy.Methods
Two intervention factors including electroconvulsive shock therapy(ECT)(two levels:not applied and one treatment course)and drug intervention(three levels:intravenous saline,intravenous MK-801,and intravenous propofol).The morris water maze test started within 1 day after ECT to evaluate the learning-memory.Theglutamate level in the hippocampus of rats was determined by high-performance liquid chromatography.The Tau protein that includes Tau5(total Tau protein),PHF-1(pSer396/404),AT8(pSer199/202),and 12E8(pSer262)in the hippocampus of rats was determined using Western blotting.ResultsPropofol,MK-801,and ECT could induce the impairment of learning-memory in depressed rats.The electroconvulsive shock significantly upregulated the glutamate level,which was reduces by the propofol.The ECT up-regulated the hyperphosphorylation of Tau protein in the hippocampus of depressed rats,which was reduced by propofol and MK-801.ConclusionBoth propofol and MK-801 could protect against the impairment of learning-memory and reduce the hyperphosphorylation of Tau protein induced by ECT in depressed rats.
propofol;N-methyl-d-aspartate receptor antagonist;electroconvulsive therapy;learning and memory;Tau protein
Acta Acad Med Sin,2012,34(4):324-329
闵 苏 电话:023-89011068,电子邮件:minsu89011068@yahoo.com.cn
R614.2+4
A
1000-503X(2012)04-0324-06
10.3881/j.issn.1000-503X.2012.04.003
国家自然科学基金 (30972831)Supported by the National Natural Sciences Foundation of China(30972831)
2011-12-16)
·综 述·

