红花速煎饮片与传统饮片化学成分对比研究
付薛衡,傅超美,毛 茜,林俊芝,秦素红
(成都中医药大学药学院中药材标准化教育部重点实验室,四川成都 611137)
0 引言
红花为菊科红花属植物红花(Carthamus tinctorius L.)的干燥花,产于河南、四川等地,具祛瘀、止痛、抗炎等功效,临床上常用于心脑血管系统疾病的治疗和预防,其主要有效成分为黄酮类化合物——红花羟基黄色素A[1-3].由传统红花饮片制备的汤剂,需水量较大且煎煮时间较长.本研究基于传统中药“煮散”理论[4],以节约中药资源、减少煎煮时间、增加药物疗效为核心理念,结合现代制剂技术,开发出不含任何外加辅料,只改变红花药材粉碎粒度等物理状态而形成的新型饮片——速煎饮片,并以其有效成分羟基红花黄色素A煎出率和干膏收率为指标,并与传统红花饮片进行综合对比研究,拟为中药现代速煎饮片的开发应用提供科学依据.
1 仪器与试药
1.1 仪 器
实验所用的仪器包括:LC-10ATVP型高效液相色谱仪(包括SPD-10AVP检测器、LC Solution工作站,日本岛津公司),Diamonsil C18色谱柱(250×4.6 mm,5 μm);DK-8D型电热恒温水浴锅(上海精宏实验设备有限公司),Sartorius-BS110S分析天平(德国赛多利斯公司),AS10200A超声波清洗器(南京昕航科学仪器有限公司).
1.2 试 药
实验所用的试药包括:红花速煎饮片(实验室自制,批号,100721、100722、100723),红花药材,购于四川新荷花中药饮片股份有限公司(批号,0905208),羟基红花黄色素A,购于中国药品生物制品检定所(批号,111637),色谱甲醇、色谱乙腈(美国天地公司),超纯水,其他试剂均为分析纯.
2 方法
2.1 两种红花饮片煎液制备
(1)分别取红花传统饮片约5 g,精密称定10份,加入10倍量水,浸泡30 min,取5份样品分别煎煮5 min、10 min、15 min、20 min、30 min,滤过,滤液加水定容至100 mL,备用.另5份样品,先煎煮30 min,滤过,收集滤液备用,再将滤渣加入10倍量水,分别煎煮5 min、10 min、15 min、20 min、30 min,滤过,合并两次滤液,加水定容至100 mL,备用.
(2)分别取红花速煎饮片约5 g,精密称定10份,按照红花传统饮片相同的方法制备红花速煎饮片样品煎液.
2.2 羟基红花黄色素A含量测定
羟基红药黄色素A的含量测定参照2010版《药典》(一部)“红花”项下羟基红花黄色素A含量测定的色谱条件[5]:检测波长403 nm,流动相为甲醇—乙腈—0.7%磷酸溶液(26∶2∶72),流速为1.0 mL/min,柱温为25℃,理论塔板数按羟基红花黄色素A峰计应不低于3 000.
2.2.1 供试品溶液的制备.
取“2.1"项下各样品溶液,摇匀,经0.45 μm微孔滤膜滤过,即得供试品溶液.
2.2.2 对照品溶液的制备.
取羟基红花黄色素A对照品适量,精密称定,加25%甲醇配制成浓度为0.131 mg/mL的对照品溶液.2.2.3 样品含量测定.
精密吸取按“2.2.1"项下方法制得的供试品溶液10 μL,按照含量测定色谱条件测定峰面积,计算羟基红花黄色素A含量,记录测定数据.
2.3 含量测定方法学分析
2.3.1 线性关系考察.
精密吸取羟基红花黄色素A对照品溶液,2 μL、4 μL、8 μL、12 μL、16 μL、20 μL,分别进样,以峰面积(Y)为纵坐标,对照品含量(X)为横坐标绘制标准曲线[6].结果表明,在0.262 μg~2.620 μg范围内,羟基红花黄色素A峰面积与进样量呈良好线性关系,其回归方程为,
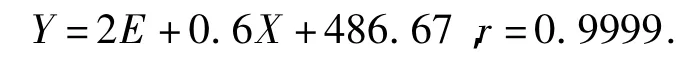
2.3.2 精密度实验.
精密吸取浓度为0.131 mg/mL的对照品溶液10 μL,重复进样6次,按照实验所定色谱条件进行检测,记录羟基红花黄色素A峰面积,计算RSD.实验结果表明,RSD为1.51%,表明仪器精密度良好.2.3.3 稳定性实验.
精密吸取对照品溶液和红花现代饮片供试品溶液10 μL,按照实验所定色谱条件分别于0 h、4 h、8 h、12 h、16 h、20 h、24 h,进样测定分析,记录羟基红花黄色素A峰面积,计算RSD.实验结果表明,RSD分别为1.63%和1.12%,表明对照品和供试品溶液在24h内基本稳定.
2.3.4 重复性实验.
取同批号红花传统饮片和现代饮片各5份,每份10 g,按照“2.1"项下方法制备供试品溶液,测定并计算羟基红花黄色素A含量.实验结果表明,RSD值分别为1.93%和1.09%,表明该方法重复性良好.
2.3.5 加样回收率实验.
精密称定已知含量的红花传统饮片和现代饮片样品各5份,精密加入羟基红花黄色素A对照品适量,按照“2.2.1"项下制备供试品溶液,计算加样回收率.结果表明,本方法的平均回收率分别为98.85%和99.32%,RSD为1.10%和1.49%,结果符合含量测定要求.
2.4 干膏收率测定
分别吸取“2.1"项下饮片煎液各50 mL,置于已恒重的蒸发皿中,在水浴上蒸干后,于105℃干燥3 h,置干燥器中冷却30 min,迅速精密称定重量[7].
3 结果与讨论
3.1 羟基红花黄色素A含量测定结果
在不同煎煮时间点下,红花两种饮片的羟基红花黄色素A含量测定结果如表1、图1所示.

表1 不同时间点羟基红花黄色素A含量测定结果(x—±s,n=3)
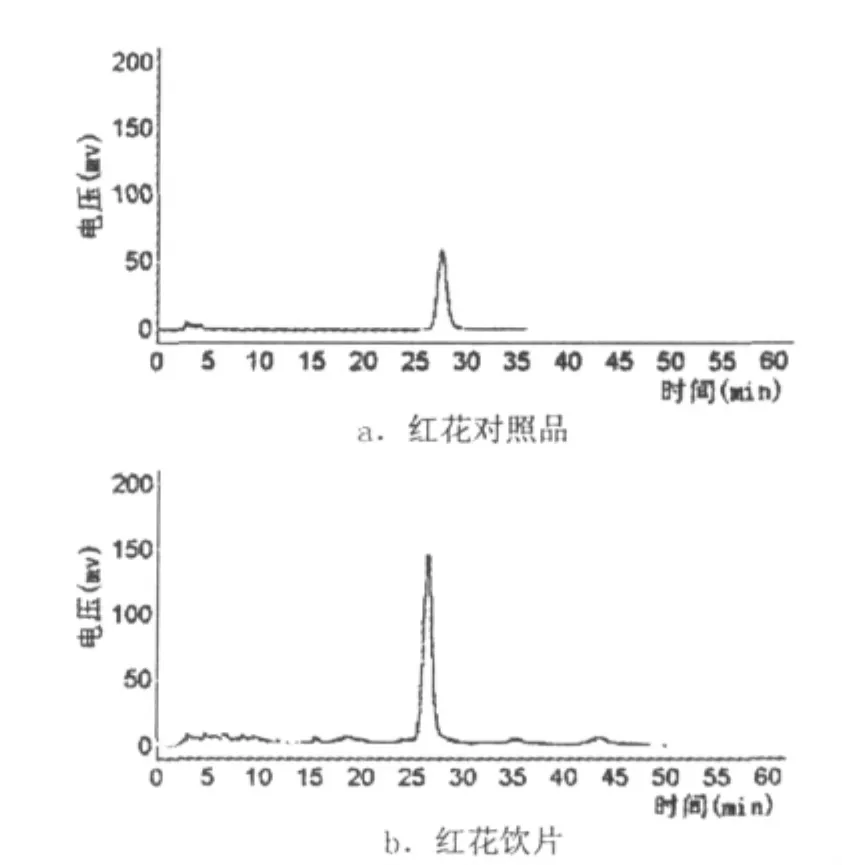
图1 HPLC色谱图
实验结果表明:在第一次加水煎煮中,红花速煎饮片和传统饮片均在煎煮20 min时,煎液中羟基红花黄色素A浓度达到最高;在第二次加水煎煮中,红花传统饮片与速煎饮片的羟基红花黄色素A量均在15 min达到最大值.
3.2 干膏收率测定结果
在不同煎煮时间点下,两种红花饮片的干膏收率试验结果如表2所示.

表2 不同时间点干膏收率测定结果表(x—±s,n=3)
实验结果表明,在第一次和第二次加水煎煮中,速煎饮片的干膏收率略高于传统饮片.
3.3 综合加权评分
根据药物性质和临床疗效,选择羟基红花黄色素A含量和干膏收率作为评价指标,对红花速煎饮片不同时间点的溶出曲线进行综合加权评分.由于羟基红花黄色素A是红花速煎饮片的主要有效成分,其含量的高低对红花经配伍后的临床疗效影响较大.因此,选择羟基红花黄色素A含量作为评价指标之一,权重系数相应较高,以0.6为宜;干膏收率作为煎煮工艺的参考指标,可反映出红花速煎饮片固体成分的煎出率,综合评价时权重系数相应较小,以0.4为宜[8,9].不同时间点的溶出曲线综合评分结果如表3、图2所示.
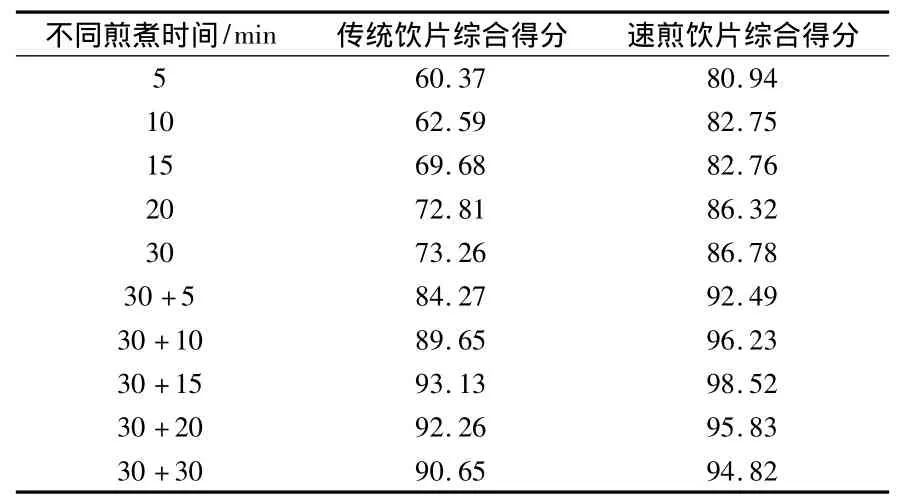
表3 不同时间点溶出曲线综合得分结果表

图2 红花传统饮片与速煎饮片溶出曲线比较结果
由表3和图2可以看出:不同时间点红花速煎饮片煎液中的羟基红花黄色素A含量均高于传统饮片煎液,可见速煎饮片中羟基红花黄色素A的煎出速率较传统饮片快;速煎饮片中羟基红花黄色素A的最大煎出量为传统饮片中羟基红花黄色素A的最大煎出量的1.05倍;速煎饮片中最大干膏收率是传统饮片中最大干膏收率的1.17倍;红花速煎饮片溶出曲线的综合得分是传统饮片的1.06倍,可知速煎饮片的煎出效率与传统饮片相比,无显著提高.
4 结论
本研究结果表明,红花速煎饮片在较短煎煮时间内,药物主要作用成分充分溶出,药材的生物利用度提高,这对节省煎煮时间、减少煎煮次数从而达到节约能源的目的有实际意义.但综合评分显示,红花速煎饮片和传统饮片煎煮效果无显著差异,这可能与红花入药部位为花,花质轻,一定煎煮时间后有效成分易于溶出等因素相关.本研究为红花速煎饮片代替其传统饮片是否可行提供了科学的实验数据.此外,本研究挑选红花有效成分羟基红花黄色素A和干膏收率为评价指标,以对比两种饮片的煎出效果,如能增加相关评价指标数量,则结论将更为科学合理.同时,两种饮片在相同剂量下其药理效应是否相同,尚需今后进一步研究.
[1]沈丽萍.红花的现代研究进展[J].中国社区医师(医学专业),2009,10(24):8-9.
[2]尹宏斌,何直升,叶阳.红花化学成分的研究[J].中草药,2001,32(9):11-13.
[3]王小平,刘峰.红花中羟基红花黄色素A含量测定方法的改进[J].陕西中医学院学报,2010,33(4):96-97.
[4]郑乾文.中药煮散的研究概况[J].海峡药学,2009,21 (1):146-147.
[5]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2010.
[6]施峰.红花黄酮素成分提取分离及其质量[D].石家庄:河北中医学院,2007.
[7]魏力.正交设计法对中药制剂提取工艺的研究[J].辽宁化工,2008,37(9):620-621.
[8]李荣,胡成穆.正交设计研究金银花绿原酸煎提工艺[J].安徽中医学院报,2006,25(1):39-41.
[9]昝丽霞.综合评分法优选黄芪的微波提取工艺[J].时珍国医国药,2009,20(7):1690-1691.
[10]张隽,张祥伟.葛根芩连汤超微饮片与传统饮片葛根素溶出量及药效作用对比研究[J].时珍国医国药,2011,22(2):358-361.
[11]蔡光先,杨永华.中药饮片改革的新探索——单味中药 超微速溶饮片[J].湖南中医杂志,2001,17(6):50.

