毛细管电泳法检测牛奶中硫氰酸钠质量浓度
吴剑平,顾欣,李丹妮,严凤,张鑫
(上海市兽药饲料检测所,上海 201103)
毛细管电泳法检测牛奶中硫氰酸钠质量浓度
吴剑平,顾欣,李丹妮,严凤,张鑫
(上海市兽药饲料检测所,上海 201103)
运用毛细管区带电泳法直接检测牛奶中硫氰酸钠质量浓度。前处理使用乙睛沉淀蛋白,中性氧化铝SPE柱除去部分水溶性维生素、氨基酸,离心脱脂。在NaH2PO4-Na2B4O7缓冲液中加入溴化十四烷基三甲基溴化铵(TTAB)作为电渗流反相作用剂,分离电压20 kV,分离温度30℃,电极反向,以二极管阵列紫外检测器218 nm波长下分析样品,质量浓度范围在5~500 mg/L内线性较好,r>0.9995。该方法可适用于生鲜乳和巴氏灭菌成品乳,检测限可达到0.2 mg/kg,定量范围0.5~50 mg/kg,精确度<10%,回收率>90%。
硫氰酸钠;毛细管区带电泳法;电渗流反向作用剂
0 引言
在2008年12月,卫生部发布的《食品中可能违法添加的非食用物质和易滥用的食品添加剂名单(第一批)》中明确规定硫氰酸钠属于违法添加物质,硫氰酸钠的主要毒性来自于硫氰酸根离子,硫氰酸根离子是强极性阴离子,使用普通的高效液相色谱法较难进行分离测定。由于毛细管电泳的分离模式多样化,毛细管内壁的修饰方法及流动的缓冲液中的添加剂的不同,以及新检测技术的发展,使毛细管电泳的应用非常广泛。尤其是在分析具有强极性的阴离子和阳离子领域,比传统的色谱学方法有着更好的分析效果。本文建立了毛细管电泳检测牛奶中硫氰酸钠含量的方法。
1 实验
1.1 仪器与试剂
BECKMAN COULTER毛细管电泳系统(PA-800 PLUS DEMO,32KARAT工作站);电子天平(Mettler AE240,瑞士);高速冷冻离心机(Allegra X-22R,BECKMAN COULTER);减压旋转蒸发仪(B-490,BUCHI);十八烷基硅烷键合硅胶色谱柱(Agela-ASBC18,250 mm×4.6 mm,5 μm);碱性氧化铝SPE固相萃取柱(Agela-Cleanert,1 000 mg×6 mL);硫氰酸钠(98.5%);NaH2PO4H2O NaH2PO4H2O(分析纯);Na2B4O7(色谱纯);H3PO4(分析纯);正丙醇(分析纯);去离子水(自制,电阻率>10 MΩ·cm)。
1.2 方法
1.2.1 NaH2PO4-Na2B4O7缓冲液制备
分别称取量NaH2PO4H2O 0.3120 g,Na2B4O70.2012 g置50 mL容量瓶中,加水定容至刻度,摇匀,倒入烧杯中,逐滴加入H3PO4调节pH值至7.00±0.02后加入TTAB 0.42 g摇匀后超声溶解,制得缓冲溶液,抽滤后备用。
1.2.2 标准贮备溶液与标准工作溶液制备
取硫氰酸钠对照品2.50 g,置250 mL容量瓶中,加水溶解并定容至刻度,摇匀,得1 g/L标准贮备液。分别精密量取该标准贮备液1.00,2.00,5.00,10.00,20.00,50.00,100.00 mL置200 mL容量瓶中用1.2.1所制得磷酸盐缓冲液定容至刻度,摇匀,即得5,10,25,50,100,250,500 mg/L标准工作溶液。
1.2.3 仪器条件
新毛细管首次使用时依次在0.14 MPa压强下用甲醇冲洗5 min,去离子水冲洗5 min,浓度为1 mol/L的HCl冲洗5 min,去离子水冲洗5 min,浓度为0.1 mol/L的NaOH冲洗5 min,去离子水冲洗5 min,1.2.1缓冲液冲洗5 min,加20 kV电压平衡30 min。
运行间依次在0.14 MPa压强下用浓度为0.1 mol/L的NaOH冲洗5 min,去离子水冲洗5 min,1.2.1缓冲液冲洗5 min。进样时压强0.003 MPa,进样时间5 s;分离中,分离温度30℃,分离电压-20 kV,跃迁时间0.5 min,检测波长218 nm。
运行后依次在20 psi压强下用浓度为0.1 mol/L的NaOH冲洗5 min,去离子水冲洗5 min,空气吹干后保存毛细管。
1.2.4 前处理方法
精密量取样品10.00 g,置50 mL具塞离心管中,加入乙睛15 mL,密塞强烈振摇提取3 min后,至高速冷冻离心机中,4℃下8 000 r/min离心3 min,小心取出全部上层清液,过中性氧化铝SPE柱,挤干,收集全部流出液于100 mL梨型瓶中,加入1 mL正丙醇,置60℃恒温水浴中减压旋转蒸发至干,精密加入1.00 mL的1.2.1中缓冲液,振荡溶解后,取出置2 mL的TIP离心管中,14 000 r/min离心3 min脱脂后取水层溶液过0.22 μm滤膜,待测。
2 结果
2.1 方法的检测限与定量限
在1.2.3仪器条件下,对空白溶液、标准工作溶液和样品溶液进行实验,结果如图1所示。结果表明,硫氰酸钠的理论塔板数不低于5 000,主峰与杂质峰的分离度大于2.0,拖尾因子小于1.5。结果表明,该色谱条件适用于牛奶中的硫氰酸钠的质量浓度测定,根据实验结果3倍信噪比计算可得其仪器检测限为1 mg/L,10倍信噪比计算可得其定量限为3.3 mg/L。

2.2 标准曲线的制作
分别精密量取该标准贮备液1.00,2.00,5.00,10.00,20.00,50.00,100.00 mL置200 mL容量瓶中用1.2.1中所制得缓冲液定容至刻度,摇匀,即得质量浓度5,10,25,50,100,250,500 mg/L标准工作溶液序列。分别经过0.22 μm滤膜过滤后上机测定,按1.2.3中的仪器条件操作,每个浓度分别反复进样6次,记录色谱峰面积均值,以标准曲线序列工作液质量浓度(C)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,得标准工作曲线A=314.89C-508.49,R=0.9997,回归曲线如图2所示。结果表明,该方法进样质量浓度在5~500 mg/L范围内线性良好。

2.3 回收率实验
取生鲜乳3批(批号:A-沪浦20110512-09,B-沪奉20110518-01,C-沪宝20110427-08),巴氏灭菌乳(D-三岛鲜牛奶20110510,E-光明学生奶20110505)各取10.00 mL,分别添加5,10,20 μL质量浓度为1 g/L的标准贮备液,按1.2.4前处理方法进行预处理,按1.2.3的仪器条件进行检测,所得结果如表1所示。结果表明,该方法的准确度和精密度都符合要求。
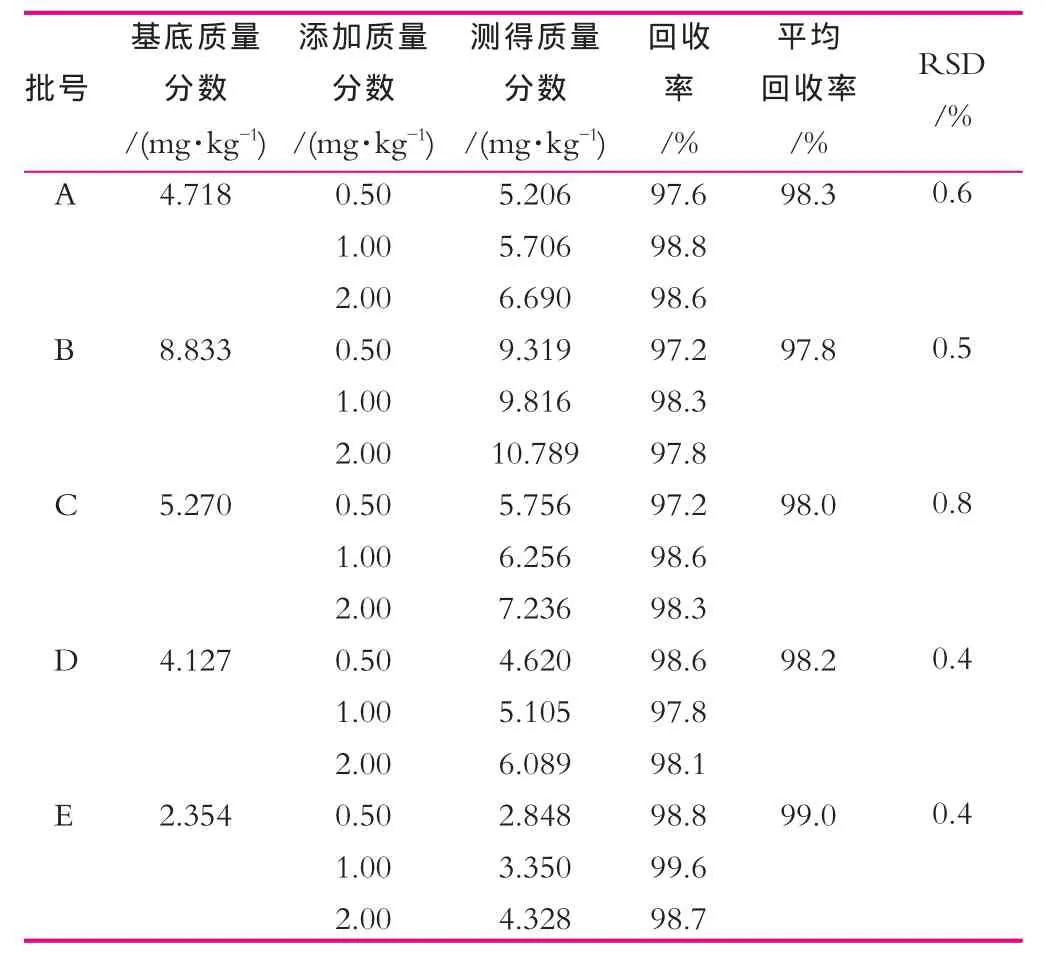
表1 回收率测定结果(n=6)
取批号沪浦20110512-09的生鲜乳按1.2.4中的前处理方法制得样品溶液。取该溶液于分别于室温下保存0,4,8,12,24 h后以1.2.3仪器方法进行测定,NaSCN峰面积的RSD分别为0.97%。实验结果表明,样品溶液中硫氰酸钠在24 h内稳定。
3 讨论
3.1 检测波长的选择
通过PA800 PLUS的3D全波长扫描图谱可知,硫氰酸根离子在218 nm处具有最大吸收,并且此处的背景基线噪音也相对较小,因此选择218 nm作为检测波长。
3.2 缓冲盐的选择
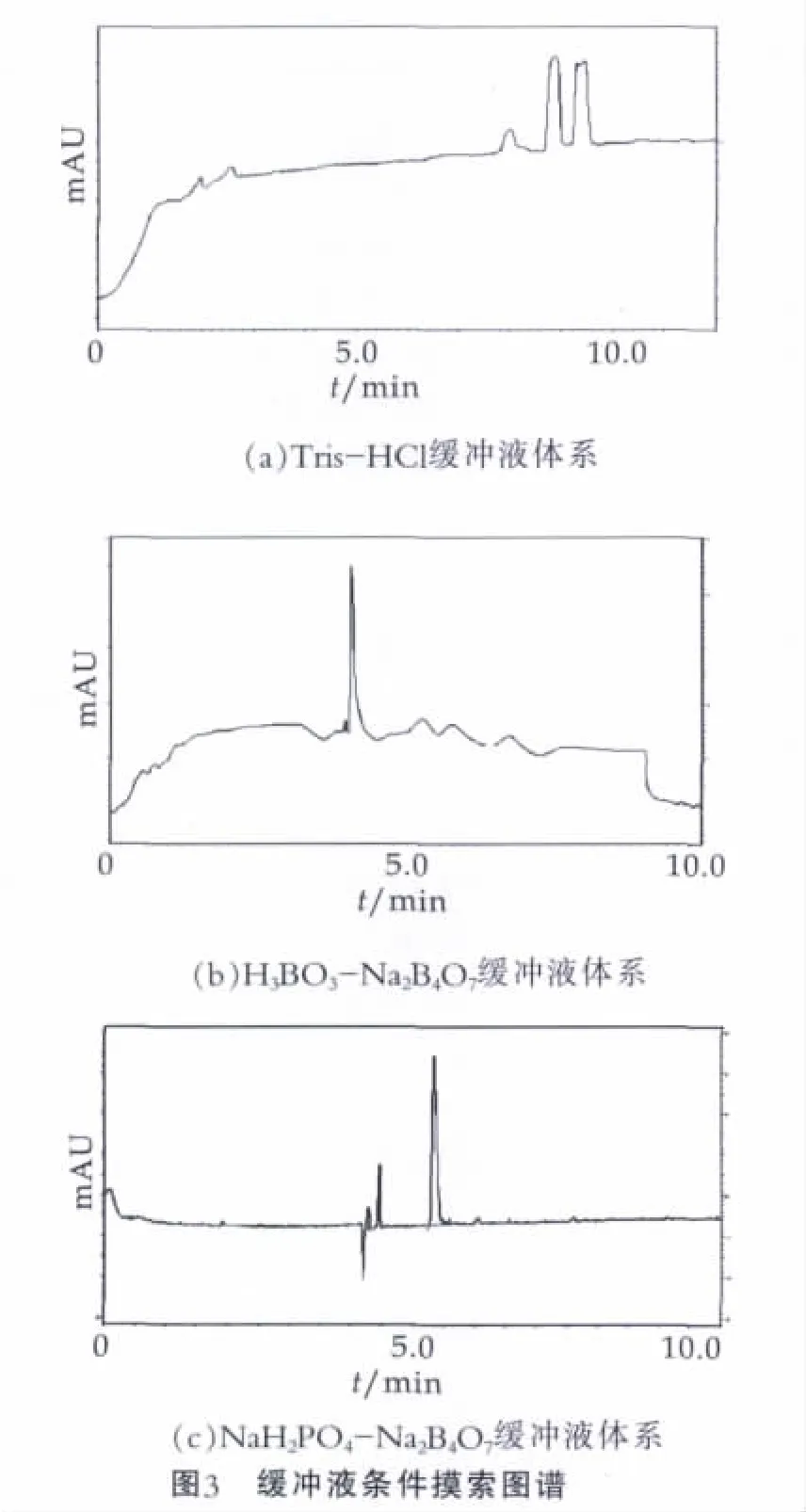
直接法紫外检测硫氰酸钠要求背景的紫外吸收要尽可能低,同时也要求缓冲液有一定的pH值调节范围,并在该pH值范围内有足够的缓冲容量。本研究分别尝试了Tris-HCl,H3BO3-Na2B4O7,NaH2PO4-Na2B4O73种缓冲液体系,其分离结果如图3所示。由图3可以看出,使用NaH2PO4-Na2B4O7缓冲液体系时硫氰酸根离子可以被较好的分离。
3.3 缓冲液浓度的选择
电渗淌度受缓冲液浓度的增加而减少,对目标化合物的出峰时间和峰型的对称性都有影响,本研究尝试了NaH2PO4∶Na2B4O7=20∶10(浓度比,下同),NaH2PO4∶Na2B4O7=40∶20,NaH2PO4∶Na2B4O7=100∶50,NaH2PO4∶Na2B4O7=200∶100,上述缓冲体系中都加入了浓度为50 mmol/L的TTAB作为电渗流反向剂。实验结果表明,当缓冲液浓度比在40∶20以下时,随着提高缓冲液浓度,硫氰酸钠出峰时间缩短,但当浓度比达到40∶20以上时出峰时间没有明显变化,而容易造成毛细管柱的堵塞现象。
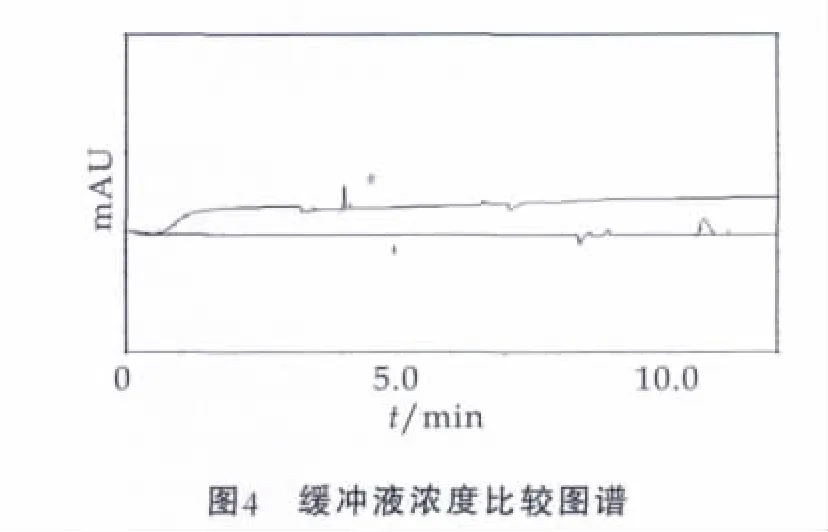
图4中,曲线1为NaH2PO4∶Na2B4O7=20 mmol/L∶10 mmol/L;曲线2为NaH2PO4∶Na2B4O7=40 mmol/L∶20 mmol/L
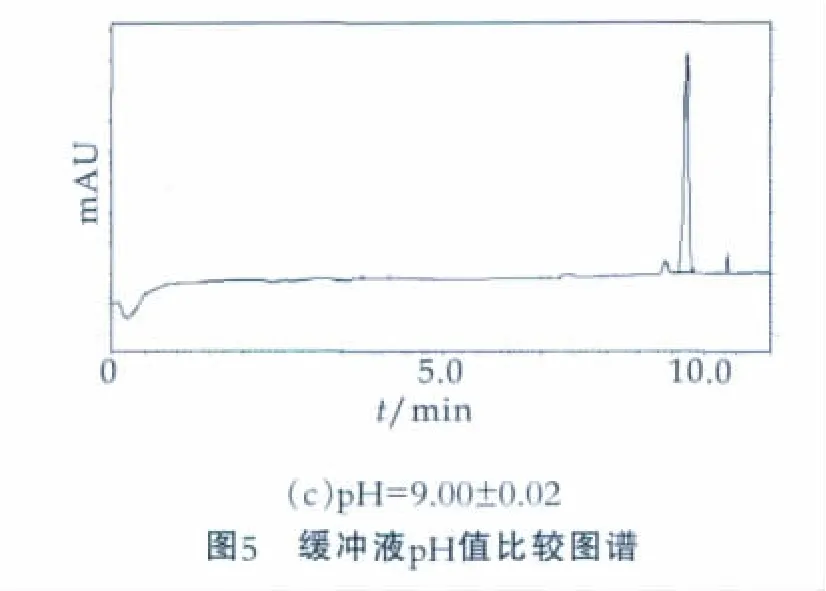
3.4 缓冲液pH值的选择
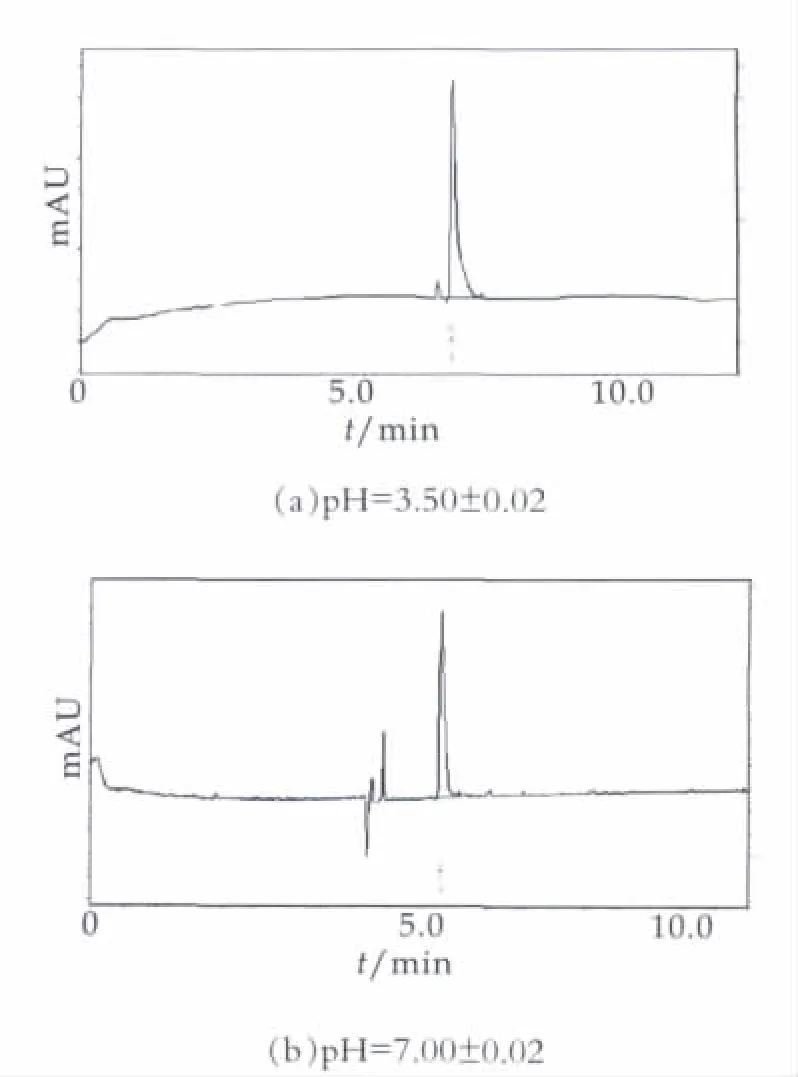
pH值变化可导致毛细管内表面的Si-OH电离发生变化,因此电渗流(EOF)受pH值影响较大,本研究在pH值为3~10范围内尝试了pH=3.50±0.02,pH= 7.00±0.02,pH=9.50±0.02 3种不同的pH值对硫氰酸钠出峰时间和峰型对称性的影响,结果如图5。由图5可以看出,当调节pH=7.00±0.02时硫氰酸钠的峰型对称性较好,且与杂质分离较好,分析时间也较短。
3.5 净化方法的选择
牛奶中干扰硫氰酸钠检测的主要杂质为蛋白质、脂肪、氨基酸和水溶性维生素,因此净化方法考虑主要能除去这些干扰物质。通过加乙睛可以使牛奶中的大部分蛋白质变性,发生絮凝,然后通过高速冷冻离心机4℃下8 000 r/min离心3 min,使絮凝的蛋白质发生沉淀,同时也可使部分的脂肪层与水相分离,离心后的提取液中还含有大量氨基酸和水溶性维生素以及部分蛋白质,若直接进样检测杂峰干扰较严重,因此选择了中性氧化铝的固相萃取柱进行净化,尝试对批号为20110505的巴氏成品乳净化后与未净化的样品进行进样测定,所得色谱图如图6所示。结果表明,中性氧化铝柱可以取得较好对牛奶提取液中的氨基酸和水溶性维生素的吸附效果较好,相比未净化的图谱中目标峰后没有杂质干扰,所测得添加回收结果大于90%,因此可以应用在净化方法中。

3.6 毛细管电泳法与高效液相色谱法测定比较净化方法的选择
之前曾对离子对高效液相色谱法测定牛奶中的硫氰酸钠进行过研究,在此使用该方法对5种不同样品分别使用两种方法进行了测定,其中高效液相色谱方法具体为:色谱柱:Agela-ASB C18(250 mm×4.6 mm,5 μm);流动相为磷酸盐缓冲液(磷酸2.00 mL置1 000 mL容量瓶中,加水定容至刻度,摇匀,倒入烧杯中,逐滴加入三乙胺调节pH值至7.00±0.02)︰乙睛=95︰5;柱温为30℃;流速为0.8 mL/min;检测波长为218 nm;进样量10 μL,前处理方法与本法相同。每种样品分别进行1 mg/kg的添加回收测定试验,将两种方法的测定结果进行了比较,结果如表2所示。由表2可以看出,毛细管电泳法所测得结果与高效液相色谱法所测得结果基本一致。
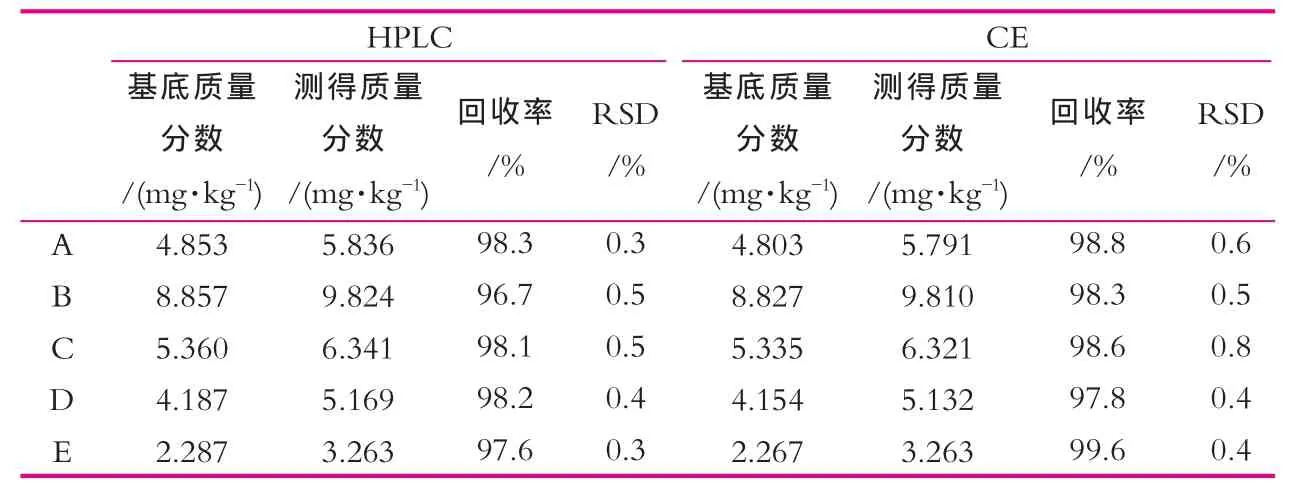
表2 毛细管电泳法与高效液相色谱法测定比较结果表(n=6)
4 结论
以上实验结果表明,该方法操作简便易行,方法的准确性、重复性均较好,可用于生鲜乳和巴氏成品乳中硫氰酸钠的质量分数检测。其检测限和定量限都能达到和高效液相色谱相同的质量分数水平,而且前处理方法简便,检测结果准确可靠。
[1]朱明华.仪器分析[M].北京:高等教育出版社,2000:70-71.
[2]牟世芬,刘克纳,丁晓静.离子色谱方法及应用.2版[M].北京:化学工业出版社,2005.
[3]王丹慧,高娃,李梅.原料乳中硫氰酸钠掺假定性检测方法[J].中国乳品工业,2008,36(7):57-58.
[4]吴剑平,顾欣.高效液相色谱法检测牛奶中硫氰酸钠质量浓度[J].中国乳品工业,2011,39(7):44-46.
Determination of sodium thiocyanate in milk by CE
WU Jian-ping,GU Xin,LI Dan-ni,YAN Feng,ZHANG Xing
(Shanghai Institute for Veterinary Drug&Feedstuffs control,Shanghai 201103,China)
A method to determinate sodium thiocyanate in milk by CE was established.The separation was performed on NaH2PO4-Na2B4O7with TTAB used as the electro-osmotic flow(EOF)modifier to change the direction of EOF.The detection wavelength was 218 nm.The separate votege was 20 kV and the separate temperature was 30℃.Good linearity was showed within the range of 5~500 mg/L respectively, r>0.9995.The average recoveries was larger than 90.0%respectively,RSD<10%.The method was simple,rapid and reliable for the simultaneous determination of sodium thiocyanate in milk with the LOD of 0.2 mg/kg and the determination range of 0.5~50 mg/kg.
sodium thiocyanate﹔CE﹔EOF modifier
TS252.7
A
1001-2230(2012)03-0053-04
2011-10-09
吴剑平(1983-),男,畜牧师,研究方向为残留测定。

