植物乳杆菌C88发酵特性研究
于志会,侯聚敏,李达,王昕,杨贞耐,
(1.吉林大学生物与农业工程学院,长春 130022;2.吉林农业科技学院,吉林吉林 132101;3.吉林省农业科学院农产品加工研究中心,长春 130033)
植物乳杆菌C88发酵特性研究
于志会1,2,侯聚敏1,李达3,王昕1,杨贞耐1,3
(1.吉林大学生物与农业工程学院,长春 130022;2.吉林农业科技学院,吉林吉林 132101;3.吉林省农业科学院农产品加工研究中心,长春 130033)
对一株本实验室筛选的益生菌植物乳杆菌C88的发酵特性进行了研究,以一株商业化益生菌L.rhamnosusGG为参照。结果表明,菌株C88的凝乳活性较弱,蛋白水解活性较高;4℃贮28 d,该菌株表现出良好的存活能力,活菌数高于L.rhamnosusGG。菌株C88对金黄色葡萄球菌的抑制作用较强;丙酸钙对其生长无显著影响;药敏实验表明该菌株对所选10种抗生素均表现出一定的耐药性;本研究对植物乳杆菌C88发酵特性的研究为其进一步应用于益生性发酵乳的研究开发提供实验依据。
益生菌;植物乳杆菌;发酵特性
0 引言
益生菌是指通过摄取适当的量,对食用者的身体健康能发挥有效作用的活菌[1]。益生菌在激活机体的免疫系统[2]、缓解肠道炎症[3]、降低胆固醇[4]等方面发挥重要作用。益生菌作为附属发酵剂添加到发酵乳制品中,不仅可以增加发酵乳制品的保健功效,而且还可以改善其品质,赋予其独特的风味[5]。但是大多数益生菌在发酵乳制品货架期内的存活能力较差.同时由于抗生素的广泛使用,细菌的耐药性问题已日益凸显。因此,为了合理开发应用益生菌产品,对用于发酵剂的菌株发酵特性包括菌株的药敏性和抑菌作用进行全面了解是至关重要的。
本研究试验菌株C88由本实验室从内蒙古奶豆腐中分离得到,经API鉴定,确定为植物乳杆菌。本实验研究的目的在于通过与世界上公认的商业用益生菌菌株L.rhamnosusGG的比较,对其在发酵乳中发酵特性进行评价。
1 实验
1.1 材料
(1)试验菌株。植物乳杆菌C88、鼠李糖乳杆菌LGG为本试验室保藏菌种;致病菌。
(2)培养基。MRS液体培养基和MRS固体培养基按文献方法配制[6]。
(3)主要仪器及试剂。Thermo CR3i高速冷冻离心机,PB-10数显pH计,紫外可见分光光度计(Cary300)。脱脂乳粉(进口),酪氨酸,山梨酸钾,所有化学试剂均为国产分析纯级。
1.2 方法
1.2.1 发酵过程酸度和蛋白水解活性变化
将活化好的菌种按7 mL-1(对数值)接种量接种于10%(w/v)的脱脂乳中,在37℃下培养24 h,采用未接菌的10%(w/v)的脱脂乳作为空白。在0-24 h发酵期间每隔3 h测定发酵乳样品滴定酸度和蛋白水解活性(采用OPA法[7]),对应标准曲线得出蛋白水解活性相当于酪氨酸的量。鼠李糖乳杆菌LGG作为对照。
1.2.2 发酵冷藏期间酸度变化和存活能力
将活化好的菌种按7 mL-1(对数值)的接种量接种到质量浓度为100 g/L脱脂乳中,于37℃发酵24 h后,转移至4℃冰箱中冷藏28 d。采用MRS琼脂培养基(pH=6.6)平板计数法,测定发酵乳4℃冷藏期间第1,7,14,21,28 d的活菌数。同时,测定发酵乳样品在冷藏期酸度变化。
1.2.3 植物乳杆菌C88凝乳活性
配制质量浓度为100 g/L脱脂乳(RSM)、质量分数为0.25%酵母粉的100 g/L脱脂乳(RSM-YE)、质量分数为0.25%水解酪蛋白的100 g/L脱脂乳(RSM-CH)、质量分数为0.25%蛋白胨的100 g/L脱脂乳(RSM-P)、质量分数为1%葡萄糖的100 g/L脱脂乳(RSM-G)。植物乳杆菌C88按体积分数为2%接种量接种于各脱脂乳中,于42℃培养16 h后,观察是否凝乳。
1.2.4 植物乳杆菌C88抑菌活性测定
采用改进的Hechard等[8]的琼脂平板扩散法。选取4株常见的致病菌:金黄色葡萄球菌CMCC26071、大肠杆菌CMCC44825、福氏志贺氏菌CMCC51061、鼠伤寒沙门氏菌CMCC50115分别接种到适宜的琼脂培养基上,无菌条件下放置2 h。待琼脂板凝固后用直径为8 mm的牛津杯在琼脂培养基上打孔。将活化好的菌株离心(10 000 g,4℃,10 min),收集上清液备用。为了排除有机酸的干扰,上清液应经微孔滤膜过滤后份两组,一组不调pH值,一组调pH值为6.5。分别取处理过的上清液50 μL加入到琼脂板上的孔中,37℃培养48 h。用直尺测量抑菌圈的直径。
1.2.5 抑菌剂对植物乳杆菌C88生长的影响
选用乳制品生产中常用的3种抑菌剂:氯化钠、山梨酸钾和丙酸钙。配制含不同浓度抑菌剂的液体MRS培养基,然后将植物乳杆菌C88按体积分数为3%接种量接种到各培养基中,37℃培养24 h后,于590 nm处测定吸光度,以不添加抑菌剂的液体MRS培养基为空白。植物乳杆菌C88的相对增长率以占空白培养基吸光度的百分比表示。
1.2.6 植物乳杆菌C88抗生素药敏实验
采用最小抑制质量浓度值法(MIC)[9]。依据各类抗生素作用机制不同,选择了抑制细菌细胞壁合成、细菌核酸合成和蛋白质合成以及抑制细胞质膜的10种常用抗生素。上述10种抗菌药物根据不同剂型和不同的溶剂进行倍比稀释,终质量浓度为512,256,128,64,32,16,8,4,2,1,0.5 mg/L。MRS液体培养基添加不同浓度的抗生素,37℃厌氧培养24 h。根据生长状况观察得出菌株对每种抗生素的MIC值。根据测定的MIC值和MIC临界点值EUC(EU Commission)的统计参考值,确定菌株对各种抗生素的敏感性结果。鼠李糖乳杆菌LGG作为对照。
2 结果与讨论
2.1 发酵过程酸度和蛋白水解活性变化情况
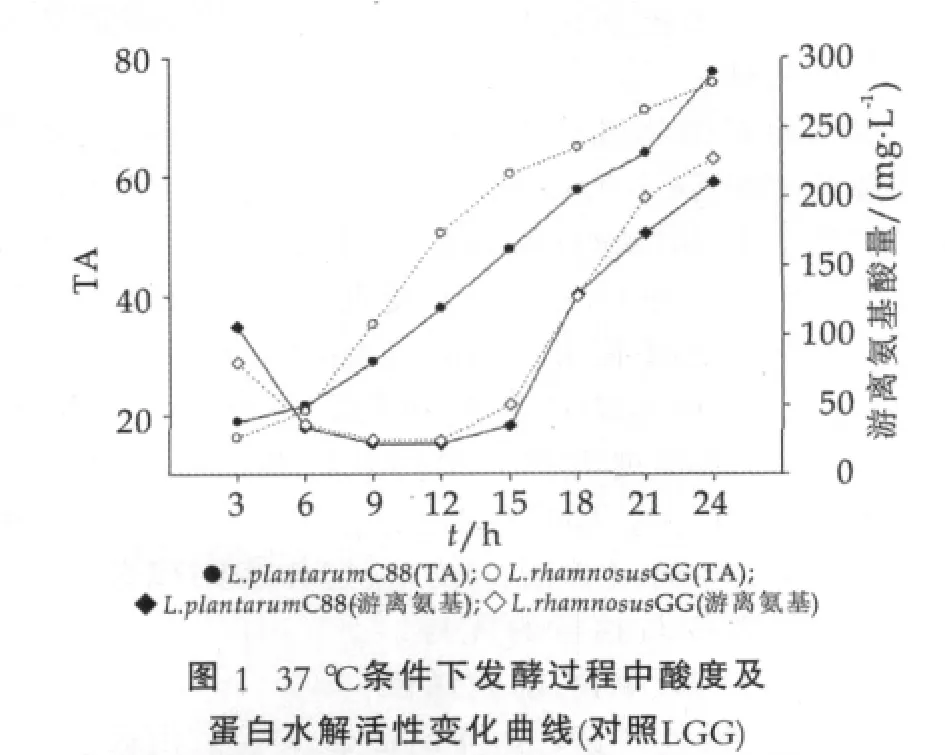
植物乳杆菌C88在37℃发酵过程酸度及蛋白水解活性变化如图1所示。由图1可以看出,在发酵过程中菌株发酵乳样品的滴定酸度逐渐升高。24 h发酵结束,植物乳杆菌C88发酵乳具有较高的滴定酸度(77.4°T)。
植物乳杆菌C88对乳蛋白水解活性与对照组LGG相似。随着发酵时间的延长,植物乳杆菌C88的水解能力在3~9 h有急速下降的过程,12~24 h之间逐渐增长,在第24 h达到最高,此时,对应游离氨基酸质量浓度为210.044 mg/L,与对照组LGG在24 h对应的游离氨基酸质量浓度(227.176 mg/L)相比差异不显著(P>0.05)。据Georgieva等[10]报道,分离自保加利亚奶酪中的8株植物乳杆菌水解乳蛋白后形成的游离氨基酸浓度为0.170~0.609 mmol/L的Gly L-1。吕加平等[11]测得保加利亚乳杆菌和嗜热链球菌水解乳蛋白后游离氨基酸质量浓度为61.0~144.6 mg/L和2.4~14.8 mg/L。本研究植物乳杆菌C88具有较高的蛋白水解活性。
2.2 发酵冷藏期间酸度变化和存活能力
图2为植物乳杆菌C88(对照LGG)发酵乳样品在4℃冷藏期间酸度及菌数变化曲线。如图2所示,冷藏28 d期间,植物乳杆菌C88发酵乳滴定酸度持续上升(28 d后滴定酸度为90.9°T)。说明植物乳杆菌C88冷藏期间仍继续生长,活菌数继续增加,而益生菌LGG生长缓慢。
植物乳杆菌C88初始菌数为7.61 mL-1(对数值),发酵24 h后,活菌数达到9.12 mL-1(对数值)。4℃冷藏期间,2株菌株的活菌数随着天数的增加而逐渐减少,在第28 d时,活菌数分别为8.42和8.21 mL-1(对数值),与24 h发酵结束后的活菌数相比差异不显著(P<0.05)。这表明2株菌株在冷藏期间的存活能力均较好,其中植物乳杆菌C88制备发酵乳样品中活菌数最于LGG。
随着益生菌概念的深入推广,针对如何提高发酵乳制品在货架期内益生菌的活菌数,已成为目前重要的研究课题。虽然目前对益生菌在货架期末活菌数量还没有标准,但是一般认为益生菌的活菌数至少在6 mL-1(对数值)以上,才能发挥其益生作用[12]。本研究的植物乳杆菌C88符合这一要求。

2.3 植物乳杆菌C88的凝乳活性
乳酸菌发酵时能利用牛乳中的乳糖,产生乳酸,导致牛乳的pH逐渐降低,达到酪蛋白的等电点时,酪蛋白聚集沉降,从而形成半固体状态的凝胶物质,即凝乳现象。一般把在16 h之内能凝乳的乳酸菌定义为快速凝乳菌株。
本试验对植物乳杆菌C88在脱脂乳以及补充氮源或碳源的脱脂乳中的凝乳特性进行了分析。结果表明,植物乳杆菌C88只有在添加了质量分数为0.25%酵母粉的脱脂乳中16 h产生了凝乳,可见植物乳杆菌C88不属于快速凝乳菌。Nieto-Arribas等[13]对10株从Manchego奶酪中分离得到的植物乳杆菌进行了凝乳活性实验,结果发现大部分植物乳杆菌的凝乳活性较差。此外,Medina等[14]的研究也验证了这一结论。虽然植物乳杆菌C88的凝乳活性较差,但作为附属菌,可在益生性方面发挥其独特的优势。
2.4 植物乳杆菌C88的抑菌活性
表1为植物乳杆菌C88抑菌活性实验。由表1可以看出,植物乳杆菌C88对4株致病菌表现出了不同程度的抑制作用,对金黄色葡萄菌的抑制作用强,对大肠杆菌和沙门氏菌的抑制作用良好,对福氏志贺氏菌的抑制作用较弱。但是调发酵液pH值为6.5时,植物乳杆菌C88对4株致病菌均无抑制作用。

表1 植物乳杆菌C88抑菌活性实验
乳酸菌的抑菌活性取决于很多因素,主要有发酵乳制品pH的降低,乳酸菌产生的有机酸、过氧化氢以及细菌素等[15]。本试验通过对植物乳杆菌C88的抑菌活性分析表明其抑菌作用主要是其在生长过程中产酸引起的。Essid等[16]研究证实分离自传统香肠的17株植物乳杆菌对金黄色葡萄菌和大肠杆菌的抑制作用较强。Schiliager等[17]研究表明分离自牛奶产品的乳杆菌对致病菌的抑制作用主要是因为产酸引起的。与本实验研究结果相类似。
2.5 抑菌剂对植物乳杆菌C88生长的影响
从表2可以看出,3种抑菌剂对植物乳杆菌C88的生长均有不同程度的影响。丙酸钙对植物乳杆菌C88的生长无显著影响。当氯化钠质量浓度在30 g/L和60 g/L,山梨酸钾质量浓度在1 g/L和2 g/L时,其对植物乳杆菌C88的生长无显著影响,并表现出很好的适应性,相对增长率在80%~100%之间。而当氯化钠质量浓度在80 g/L以上,山梨酸钾质量浓度在5 g/L以上时,植物乳杆菌C88的生长受到抑制,相对增长率在24%~75%之间。
抑菌剂能有效抑制食品中有害微生物的生长,同时也会影响食品中发酵菌株或其他益生菌的生长。高质量浓度氯化钠能影响干酪中发酵剂菌株和有害微生物的生长[18]。山梨酸钾和丙酸钙能有效地抑制食品中酵母菌、霉菌及细菌的生长,被广泛应用到干酪生产。通常在新鲜干酪生产中,山梨酸钾的添加量为0.05%~0.1%。本研究中,植物乳杆菌C88只对高浓度的氯化钠和山梨酸钾敏感。因此,应用于干酪生产中的抑菌剂浓度,不会影响菌株的生长。

表2 抑菌剂对植物乳杆菌C88生长的影响实验
2.6 植物乳杆菌C88对不同抗生素的敏感性
按照1.2.6中所述方法对供试菌株进行药物敏感性试验,根据E-Test结果判读手册读取实验结果,见表3。
植物乳杆菌C88对卡那霉素、万古霉素、多粘菌素B、赤霉素等4种抗生素均表现出强耐药性,最小抑制质量浓度均高于512 mg/L;对红霉素、利福平、氯霉素、青霉素等4种抗生素敏感,与对照菌LGG相类似。益生菌对人体健康影响的一个非常重要的方面是其耐药性,其中隶属于糖肽类的万古霉素尤其受到关注。许多乳杆菌,如罗伊氏乳杆菌和鼠李糖乳杆菌均具有对万古霉素的耐药性,且被认为是一种天然特性[19]。Swenson等[20]研究证实加氏乳杆菌对糖肽类抗生素具有耐药性,Kattla等[21]研究证实乳杆菌对四环素和氯霉素敏感。本实验也得出了类似的实验结果。

表3 植物乳杆菌C88对不同抗生素的最低抑菌质量浓度(MIC)mg/L
3 结论
(1)对益生性植物乳杆菌C88发酵特性的研究。结果表明,该菌株凝乳活性较低,与益生菌LGG相比较蛋白水解活性较高。将该菌株添加到发酵乳中,4℃冷藏28d,表现出了很好的存活能力,冷藏结束时活菌数仍保持在8 mL-1(对数值)以上,并能够经受住乳制品生产中常用抑菌剂的影响。此外,该菌株应用于发酵乳中不会产生后酸化现象。
(2)该菌株对致病菌有较好的抑制作用,抑菌原因主要是因其产酸引起的。在药物敏感性试验中对各抗生素也表现出一定耐药性。
(3)在以前的究表明该菌株具有良好的耐酸性及胆盐耐受性,对免疫系统具有显著的调节功能[22];经体外、体内试验表明,该菌株具有较好的抗氧化及降胆固醇功效(未发表)。但其在酸奶中应用及功效还未研究。本研究结果为植物乳杆菌C88应用于功能性乳制品的开发提供了理论依据。
[1]GUARMER F.Probiotics[J].Int J.Food microbial,1998,39:237-238.
[2]CUNNINGHAM-RUNDLES S,AHRNE S,BENGMARK S,et.al. Probiotic and Immune Response[J].The American Journal of Gastroenterology,2000,95(1):22-25.
[3]ISOLAURI E,KIRJAVAINEN P V,SALMINEN S.Probiotics:a Role in the Treatment of Intestinal Infection and Infammation[J].Gut. 50.suppl,2002,3:11154–9.
[4]DORA IA,PEREIRA,Glenn GlENN R,et.al.Cholesterol assimilation Assimilation by lactic acid bacteria andbifdobacteriaisolated from the human Human gutGut[J].Appl.Environ.Microbio,2002,9:4689–4693.
[5]郭壮,王记成,闫丽雅,等.益生菌Lactobacillus caseiZhang对酸奶风味、质地及感官特性的影响[J].中国乳品工业,2009,37(1):14-20.
[6]De DE Man MAN J C,Rogosa ROGOSA M,and Sharpe SHARPE M E.A medium Medium for the cultivation Cultivation oflactobacilli[J].J.Appl.Bacteriol.,1960,23:130–135.
[7]FRANK C C.Sepectrophotometric Assay using σ-Phthaldialdehyde for Determination of Proteolysis in Milk and Isolated Milk Proteins[J].J Dairy Science,1983,66:1219-1227.
[8]Hechard HECHARDY,DHERBOMEZ M,Cenatiempo CENATIEMPO Y,et al.Antagonism of lactic acid bacteria from goats’Goats’milk Milk Against pathogenic Pathogenic strains Strains assessed Assessed by the‘sandwich Sandwich method’Method’[J].Letters in Applied Microbiology,1990,11:185-188.
[9]CHARTERISW P,KLLY P M,MORELLIL,et al.Antibiotic Susceptibility of Potentially ProbioticBifidobacteriumIsolates from the Human Gastrointestinal Tract[J].Applied Microbiology,1998,26,333-337.
[10]GEORGIEVA R,HAERTLE T,CHOBERT J M,et al.Technological Properties of Candidate ProbioticLactobacillus plantarumStrains [J].International Dairy Journal,2009,19:696-702.
[11]吕加平,骆承痒,刘凤民,等.乳酸菌蛋白水解力的测定及研究[J].东北农业大学学报,1999,30(1):68-74.
[12]MARAGKOUDAKIS P A,MIARIS C,ROJEZ P,et al.Production of Traditional Greek Yoghurt usingLactobacillusStrains with Probiotic Potential as Starter Adjuncts[J].International Dairy Journal,2006,16: 52-60.
[13]NIETO-ARRIBAS P,POVEDA J M,SESENA S,et al.TechnologicalCharacterizationofLactobacillusisolatesfromTraditional Manchego Cheese for Potential use as Adjunct Atarter Cultures[J]. Food Control,2009,20:1092-1098.
[14]MEDINA R,KATZ M,GONZALEZ S,et al.Characterization of the Lactic Acid Bacteria in Ewe's Milk and Cheese from Northwest Argentina.International Association for Food Protection,2001,64: 559-563.
[15]GARRIGA M,HUGAS M,AYMERICH T,et al.Bacteriocinogenic Activity oflactobacillifrom Fermented Sausages[J].Journal of Applied Bacteriology,1993,75:14-148.
[16]ESSID I,MEDINI M,HASSOUNA M.Technological and Safety Properties ofLactobacillus plantarumStrains Isolated from a Tunisian Traditional Salted Meat[J].Meat Science,2009,81:203-208.
[17]SCHILLIAGER U,GEISEN R,HOLZAPFEL WH.Potential of Antagonistic Microganisms and Bacteriocins for the Biological Preservation of Food[J].Trends Food Sci.Tech.,1997,7:158–164.
[18]DOYLE M E,GLASS K A.Sodium Reduction and Its Effects on Food Safety,Food Quality,and Human Health[J].Comprehensive Reviews in Food Science and Food Safety,2010,9(1):44-56.
[19]HAENEL H,BENDIG J.Intestinal Flora in Health and Disease[J]. Progr.Food Nutr.Sci.,1975,21–64.
[20]SWENSON J M,FACKLAM R R,and THORNSBERRY C.Antimicrobial Susceptibility of Vancomycin ResistantLeuconostoc,PediococcusandLactobacillusSpecies[J].Antimicrobial Agents and Chemotherapy,1990,34:543–547.
[21]KATTLA A K,KRUSE H,JOHNSEN G,et al.Antimicrobial Susceptibility of Starter Culture Bacteria Used in Norwegian Dairy Products[J].Inter.J.Food Microbiology,2001,67:147–152.
[22]杨贞耐,李盛钰,张雪,等.一株具有降胆固醇功能的植物乳杆菌及其应用[J],中国,CN101864375A,2010.10.20.
Fermentation properties of Lactobacillus plantarum C88
YU Zhi-hui1,2,HOU Ju-min1,LI Da3,WANG Xin1,YANG Zhen-nai1,3
(1.College of Biological and Agricultural Engineering,Jilin University,Changchun 130022,China;
2.Jilin Agriculture Science and Technology College,Jilin 132101,China;
3.Center of Agro-Food Technology,Jilin Academy of Agricultural Sciences,Changchun 130033,China)
The fermentation properties ofL.plantarumC88 was assayed and compared with one selected commercial probiotic strain:L.rhamnosusGG.The results showed that:The strain C88 displayed weak milk-coagulating activity,but strong proteolytic activity;The strain maintained high viability in fermented milk during storage compared withL.rhamnosusGG.Strain C88 also showed a strong antimicrobial activity againstStaphylococcus aureus;Among all the microbe inhibitory agents tested,only calcium propionate did not significantly affect the growth of the strain;Antibiotic sensitivity showed found that the strain was resistant to multiple antibiotics;L.plantarumC88 showed good potential for application in functional foods and health-related products.
probiotic;Lactobacillus plantarum;fermentation properties
Q935
A
1001-2230(2012)03-0024-04
2011-11-23
农业部现代农业产业技术体系建设专项资金资助项目(CARS -37)。
于志会(1979-),女,讲师,主要从事生物资源保护与利用研究。
杨贞耐

