牛凝乳酶原基因在大肠杆菌中的高效表达及活性检测
张俊瑞,马夏吟,张红星,郝彦玲
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京农学院食品科学学院,北京 102206)
牛凝乳酶原基因在大肠杆菌中的高效表达及活性检测
张俊瑞1,马夏吟1,张红星2,郝彦玲1
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京农学院食品科学学院,北京 102206)
以实验室保存的携带凝乳酶原前体基因的重组载体pMD 19-T/bPPC为模板克隆凝乳酶原基因,经双酶切后与载体pET-30a连接得到重组载体pET-30a/bPC,转化大肠杆菌BL21(DE3),经IPTG诱导后,采用SDS-PAGE检测目的蛋白表达情况。重组蛋白经变性/复性、DEAE-Sepharose Fast Flow纯化和自催化后检测凝乳活性。结果表明,重组凝乳酶原基因在大肠杆菌中高效表达,表达量占菌体总蛋白的68%,采用Arima K方法检测,其凝乳活力达到80 SU/mL。因此,通过大肠杆菌表达系统大量制备具有生物活性的重组牛凝乳酶原的策略是可行的,研究结果为弥补国内天然牛凝乳酶的短缺提供一种途径。
牛凝乳酶原;高效表达;大肠杆菌BL21(DE3);凝乳活性
0 引言
小牛凝乳酶是从未断奶的小牛皱胃中提取的一种可以专一性裂解κ-酪蛋白中Phe105-Met106肽键的酸性天冬氨酸蛋白酶,是干酪生产过程中不可缺少的酶制剂[1-4]。然而随着全球性小牛资源的短缺,牛凝乳酶来源的不足成为干酪行业发展的瓶颈。
至今,FDA(美国食品和药物管理局)已批准了3种凝乳酶生物工程产品可用于干酪生产,即Gist Brocades公司(荷兰)的乳酸克鲁维酵母菌凝乳酶,Genencor公司(美国)的黑曲霉菌凝乳酶和Pfizer公司(美国)的大肠杆菌K-12凝乳酶。而我国对基因工程凝乳酶的研究却一直处于探索阶段,始终未能实现商业化生产,导致我国凝乳酶主要依赖于进口,严重制约我国干酪产业的发展[7-8]。本研究结果旨在为构建具有自主知识产权的工程菌株生产凝乳酶提供有效途径。
1 实验
1.1 材料
质粒和菌株:携带牛凝乳酶原前体基因的重组载体pMD 19-T/bPPC由本实验室保存;表达载体pET-30a;大肠杆菌DH5α和BL21(DE3)。
试剂及仪器:限制性内切酶,Ex Taq DNA聚合酶及T4 DNA连接酶购自TaKaRa,DEAE Sepharose Fast Flow,其他试剂均为分析纯。
1.2 方法
1.2.1 重组表达载体pET-30a/bPC的构建
以含有牛凝乳酶原前体基因的pMD 19-T/bPPC为模板,根据GenBank上已发表的牛凝乳酶原基因序列(Accession NM_180994)设计引物:

利用PCR技术扩增目的基因bPC,经NdeⅠ和NotⅠ双酶切后与载体pET-30a(+)连接,并转化大肠杆菌DH5α,提取质粒,经酶切鉴定及测序后,重组子命名为pET-30 a/bPC。
1.2.2 重组牛凝乳酶原的诱导表达
重组载体pET-30a/bPC转化表达菌BL21(DE3)后,以1%的比例接种于LB/Kan液体培养基中,于37℃振荡培养至菌液OD600达0.4-0.6,加入IPTG(终浓度为1 mmol/L)诱导培养4 h,收集菌体,超声破碎,利用SDS-PAGE检测目的蛋白的表达情况。
1.2.3 包涵体的变性/复性
重组牛凝乳酶原在大肠杆菌中以包涵体的形式积累,经收集后溶于含有8 M尿素的Buffer A(浓度为50 mmol/L的KH2PO4,1 mmol/L的EDTA,50 mmol/L的NaCl,pH值为11.0)进行变性,取上清25倍稀释于含有GSH/GSSG的Buffer A中,室温放置24 h后,用HCl将pH值调至8.0,并于室温下放置1 h,于缓冲液(浓度为20 mmol/L的Tris-Cl(pH=8.0),50 mmol/L的NaCl,1 mmol/L的EDTA)中进行4℃过夜透析,即得到复性后的凝乳酶原[9]。
1.2.4 重组牛凝乳酶原的纯化及活性检测
利用DEAE Sepharose Fast Flow纯化复性后的凝乳酶原,经平衡缓冲液(20 mmol/L的Tris-Cl(pH=8.0),1 mmol/L的EDTA,50 mmol/L的NaCl)平衡填料,透析后的凝乳酶原经0.45 μm滤膜过滤后,以2 mL/min的流速上样。用不同浓度NaCl的Tris-HCl缓冲液线性洗脱目的蛋白,NaCl浓度范围为0.1~0.5 mol/L,流速为2 mL/min。在线监测280 nm的吸收值,收集到的洗脱液经酸化/中和后,采用Arima K的方法检测凝乳活性[10]。
2 结果与分析
2.1 重组表达载体pET-30a/bPC的构建
对重组子进行NdeⅠ和NotⅠ的双酶切鉴定,由图1可以看出,获得的两个片段与预期大小5.4 kbp和1.1 kbp相一致,经上海生工生物技术有限公司测序,其结果与GenBank上发表的序列(Accession NM_180994)同源性达100%。表明重组表达载体pET-30a/bPC构建成功。
2.2 重组牛凝乳酶原的诱导表达
经SDS-PAGE检测,重组牛凝乳酶原主要存在于菌体裂解液的沉淀中,表明目的蛋白以包涵体的形式积累。由图2可知,其分子量约41 ku,与理论值相符。经凝胶定量软件Quality One分析,重组牛凝乳酶原占菌体总蛋白量的68%。
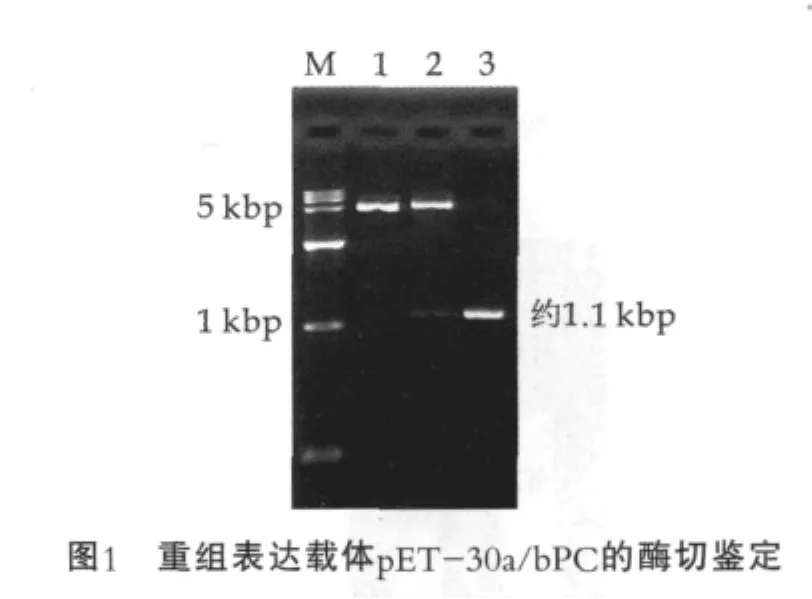
图1中,M为DL15000;1为质粒pET-30a(+)双酶切/NdeⅠ+ NotⅠ;2为重组质粒pET-30a/bPC双酶切/NdeⅠ+NotⅠ;3为目的基因bPC。

图2中,M为低分子量蛋白Marker;1为含有空载质粒pET-30a的菌体裂解液上清;2为含有重组质粒pET-30a/bPC的菌体裂解液上清;3为含有空载质粒pET-30a的菌体裂解液沉淀;4为含有重组质粒pET-30a/bPC的菌体裂解液沉淀。
2.3 包涵体的复性及纯化
包涵体在高浓度变性剂及强碱性条件下呈变性可溶状态,经25倍稀释去除变性剂后,在GSH/GSSG的辅助下逐渐折叠复性,再经透析即得到复性后可溶的凝乳酶原。采用DEAE-Sepharose Fast Flow纯化凝乳酶原,在0.3 M NaCl浓度时有最大吸收峰,收集浓缩后,采用SDS-PAGE检测结合Quality One软件分析,其纯度达到99%(见图3)。

图3中M为低分子量蛋白标准;1为诱导后菌体裂解沉淀;2为离子交换层析纯化后的凝乳酶原溶液。
2.4 重组牛凝乳酶原的活化及凝乳酶的活性检测
纯化后的凝乳酶原经酸化/中和后,采用Arima K方法进行检测。从图4可知:当脱脂乳中加入重组牛凝乳酶,脱脂乳迅速凝乳,而添加不含重组牛凝乳酶的缓冲液做对照时,脂乳未出现凝乳现象。实验结果表明:重组牛凝乳酶具有生物活性,其活性可达80 SU/mL。

图4中,1为以加入不含重组牛凝乳酶的缓冲液为阴性对照组;2为加入重组牛凝乳酶溶液后的效果。
3 结果与讨论
本研究中,重组牛凝乳酶原在大肠杆菌中以包涵体的形式积累,占菌体总蛋白的68%,而经变性/复性、纯化及自催化后,获得的具有凝乳活性的重组凝乳酶仅21%。在整个过程中,我们发现自催化时,当pH值回调至6.3后出现大量沉淀是造成活性重组凝乳酶得率低的主要原因。分析可能上由于在体外复性过程中仅部分凝乳酶原能完成正确折叠进而实现自催化。而未正确折叠的重组蛋白,则在酸化/中和的过程中以沉淀形式析出,实验结果与1983年J.S.Emtage等人的报道相一致。
为提高包涵体的复性率,2002年,Huge G.Menzella等人在控制蛋白质量浓度为0.8 g/L的条件下,采用空气氧化(Air Oxidation)的方法可以使48%的变性蛋白正确折叠[11]。而为了得到可溶性凝乳酶原,中国中科院微生物所的杨开宇等人经研究表明,PRPA(protein disulfide isomerase-related protein A)与凝乳酶原在大肠杆菌中的共表达,可以使部分凝乳酶原以可溶形式表达[12]。而M.M.Harmsen等人将BiP(Binding Protein,在酵母中是一种由KAR2基因编码的约78 ku的多肽分子,存在于内质网腔中,与蛋白的转运和折叠有关)与牛凝乳酶原在酿酒酵母中共表达,可以使凝乳酶原的胞外表达量提高20倍左右[13]。因而通过各种方法提高包涵体的复性率或者使目的蛋白以可溶形式表达将是今后继续努力的方向。
[1]FOLTMANN B,PEDERSEN V B,JACOBSEN H,et al.The Complete Amino Acid Sequence of Prochymosin[J].Proceedings of the National Academy of Sciences of the United States of America,1977,74 (6):2321-2324.
[2]PEDERSEN V B,CHRISTENSEN K A,FOLTMANN B.Investigations on the Activation of Bovine Prochymosin[J].European Journal of Biochemistry,1979,94:573-580.
[3]BEPPU T.The Cloning and Expression of Chymosin(Rennin)Genes in Microorganism[J].Trends in Biotechnology,1983,1(3):85-89.
[4]MOHANTY A K,MUKHOPADHYAY U K,GROVER S,et al. Bovine Chymosin:Production by rDNA Technology and Application in Cheese Manufacture[J].Biotechnology Advances,1999,17(2-3): 205-217.
[5]EMTAGE J S,ANGAL S,DOEL M T,et al.Synthesis of calf Prochymosin(Prorennin)in Escherichia Coli.[C].Proceedings of the National Academy of Sciences of the United States of America,1983, 80:3671-3675.
[6]MARSTON FAO,LOWE P A,DOEL M T,et al.Purification of Calf Prochymosin(prorennin)Synthesized in Escherichia coli.[J].Nature Biotechnology,1984,2:800-804.
[7]ZHANG Y Y,LI H S,WU H,et al.Functional Implications of Disulfide Bond,Cys45-Cys50,in Recombinant Prochymosin[J].Biochimica et Biophysica Acta.,1997,1343:278-286.
[8]WEI C J,TANG B,ZHANG Y Y,et al.Oxidative Refolding of Recombinant Prochymosin[J].Biochemical Journal.1999,340:345-351.
[9]杨开宇,刘年娟,张渝英.大肠杆菌中表达外源基因的质粒和牛凝乳酶原的生产方法.中国:95105337.X.2001-01-17.
[10]ARIMA K,YU J,IWASAKI S.Milk-Clotting Enzyme from Mucor Pusillus var.Lindt[J].Methods in Enzymology,1970,19:446-459.
[11]HUGO G M,HUGO C G,EDUARDO A C.High Recovery of Prochymosin from Inclusion Bodies Using Controlled Air Oxidation [J].Protein Expression&Purification.2002,25:248-255.
[12]ZHOU H P,ZHANG Y Y,JIA C J,et al.Chaperone Characteristics of PDI-Related Protein A from Aspergillus Niger[J].Biochemical and Biophysical Research Communications,2004,321:31-37.
[13]HARMSEN M M,BRUYNE M I,RAUÉ H A,et al.Overexpression of Binding Protein and Disruption of the PMR1 Gene Synergistically Stimulate Secretion of Bovine Prochymosin but Not Plant Thaumatin in Yeast[J].Applied Microbiology and Biotechnology, 1996,46:365-370.
High-efficiency expression and activity analysis of bovine prochymosin in Escherichia coli
ZHANG Jun-rui1,MA Xia-yin1,ZHANG Hong-xing2,HAO Yan-ling1
(1.College of Food Science&Nutritional Engineering,China Agricultural University,Beijing 100083,China;2.College of Food Science,Beijing University of Agriculture,Beijing 102206,China)
The bovine prochymosin gene was cloned from the recombinant vector of pMD 19-T/bPPC harboring the interest gene,and which was then ligated with the expression vector pET-30a.Ligated products were transformed intoE.coliBL21(DE3).Recombinant protein was analysed by SDS-PAGE after the IPTG induction.The recombinant bovine chymosin was then used to assay the milk-clotting activity after denaturation/renaturation,DEAE-Sepharose Fast Flow purification and activation.The recombinant prochymosin was high-efficiently expressed inE.coli,making up 68%of the total protein.The milk-clotting activity of recombinant chymosin was 80 SU/mL using the Arima K method.So it is possible to largely produce bioactive recombinant bovine prochymosin through theE.coliexpression system.These results would provide a method to solve the problem of lack of authentic bovine chymosin.
bovine prochymosin;high-efficiency expression;E.coliBL21(DE3);milk-clotting activity
Q93-33
A
1001-2230(2012)03-0004-03
2011-11-07
张俊瑞(1987-),男,硕士研究生,研究方向为食品微生物分子生物学。
郝彦玲

