牵张微应变对人退变髓核与纤维环细胞增殖的影响*
张晓林 孙晓雷 马信龙
牵张微应变对人退变髓核与纤维环细胞增殖的影响*
张晓林 孙晓雷 马信龙△
目的:探讨循环牵张微应变对体外培养的人退变髓核与纤维环细胞增殖的影响。方法:人退变椎间盘组织来源于1例29岁腰椎间盘突出症患者的手术取材,病理学诊断评估其退变程度,无菌条件下酶消化法分别原代培养髓核与纤维环细胞,并对细胞系进行鉴定。将第3代细胞接种于硅橡胶膜载体上,利用EF3200力学试验仪搭载的BioDynamic生物反应舱系统,对其施加频率为0.25 Hz,应变为0 με、5万με、10万με和15万με的加载3 h,应用流式细胞仪检测不同微应变环境下2种细胞的增殖活性。结果:退变髓核与纤维环细胞应力加载后生长状态良好。随着微应变的增加,髓核细胞S期细胞比例在10万με、15万με时均高于纤维环细胞,差异有统计学意义(P<0.01);纤维环细胞增殖指数(PI)在各微应变加载组均高于髓核细胞,差异有统计学意义(P<0.05)。结论:微应变刺激对人退变髓核与纤维环细胞的增殖总体效应是一致的,但相同的微应变刺激对纤维环细胞增殖的促进效应明显高于髓核细胞。
椎间盘移位 流式细胞术 椎间盘退变 髓核细胞 纤维环细胞 牵张微应变 增殖指数
椎间盘退变(intervertebral disc degeneration,IVDD)是临床上腰痛最常见的病理基础因素[1-2],但其退变机制涉及体内多重因素的协调与调节过程[3]。近年来生物力学因素在椎间盘退变过程中发挥的调节作用越来越受到关注[4-6]。髓核与纤维环所含基质成分的差异导致其力学特性及力学生物效应均有明显不同。IVDD的主要病理改变为椎间盘细胞功能的退变及椎间盘基质的成分、结构与功能的改变[7-8]。椎间盘2种不同细胞在退变中所表现出来的差异及原因,对于研究椎间盘退变的机制有着重要的提示意义,本研究在体外细胞水平观察力学刺激对退变髓核及纤维环细胞的影响,以期为IVDD的预防与治疗提供新的思路。
1 材料与方法
1.1 主要试剂及仪器 DMEM培养基、胎牛血清(GIBCO,美国),乙二胺乙酸二钠(EDTA)、Ⅰ型及Ⅱ型胶原、胰蛋白酶(Sigma,美国),甲苯胺蓝溶液(东胜泰博,北京),抗人Ⅱ型胶原多克隆抗体(武汉博士德),ElectroForce 3200力学实验仪器、BioDynamic生物反应舱系统(Bose,USA),CO2培养箱(Hera-cell,德国),恒温摇床(Heidolph,德国),倒置显微镜(OLYMPUS,日本),细胞培养板(corning,美国),流式细胞仪(BD,美国)。
1.2 方法
1.2.1 标本取材 人退变椎间盘组织为1例29岁男性腰椎间盘突出症患者手术标本,从标本髓核与纤维环原有界限、裂隙、纤维束变化及细胞数量与集群等方面对椎间盘退变情况进行分级[9],取材严格无菌操作。
1.2.2 髓核与纤维环细胞原代培养 无菌条件下,清洗剔除脂肪、软骨组织,分离髓核与纤维环组织,D-Hanks液冲洗3遍,双抗浸泡3 min,分别以眼科剪剪碎髓核与纤维环组织为约1 mm×1 mm×1 mm大小。髓核组织以0.25%的胰蛋白酶和0.2%的Ⅱ型胶原酶联合消化,37℃摇床200 r/min,90 min,过钢网收集消化液,1 000 r/min离心7 min,弃上清液,DMEM/F12培养液重悬细胞,细胞计数,按2×105/mL接种于培养瓶中,加入含10%FBS的高糖DMEM培养基,37℃、5%CO2培养箱中培养;纤维环组织以0.25%胰酶在37℃下摇床消化30 min,弃上清液。剩余组织加入含有0.25%胰酶、0.25%Ⅰ型胶原酶、0.2%Ⅱ型胶原酶的D-Hanks消化液中,4℃冷消化8 h,次日37℃摇床中消化2 h,钢网过滤收集消化液,1 000 r/min离心7 min,弃上清液,DMEM/F12培养液重悬细胞,细胞计数,以2×105/mL密度接种于培养瓶中,加入10%FBS高糖DMEM培养基,37℃、5%CO2培养箱内培养。
1.2.3 细胞鉴定 (1)形态学观察。倒置相差显微镜下观察P2代髓核与纤维环细胞形态。(2)甲苯胺蓝染色。P1代髓核与纤维环细胞分别爬片,至80%融合时,4%多聚甲醛固定15 min,1%甲苯胺蓝染色10 min,PBS冲洗,二甲苯透明,中性树脂封片,镜下观察细胞分泌糖胺聚糖能力。(3)Ⅱ型胶原免疫组化染色。P1代髓核与纤维环细胞分别爬片,至80%融合时,4%多聚甲醛固定15 min,0.1%triton X-100打孔20 min,PBS清洗3次;3%H2O2作用15 min,PBS冲洗3次;滴加10%山羊血清封闭液室温封闭10 min,甩掉后充分晾干;滴加1∶50稀释的Ⅱ型胶原多克隆抗体,4℃孵育过夜,PBS冲洗3次;滴加辣根过氧化物酶标记的二抗工作液,室温孵育2 h,DAB避光显色15 min;设阴性对照组,冲洗、脱水、封片,荧光显微镜下观察。
1.2.4 对细胞行单轴向循环牵张应力加载 (1)加载周期性牵张力。分别将P3代髓核与纤维环细胞以2×105/mL密度接种于4 cm×2 cm硅橡胶膜上,继续培养至细胞密度达到约80%,置于BioDynamic力学生物反应舱中进行应力加载。实验组每组3个样本,分别以0 με、5万με、10万με和15万με加载,频率为0.25 Hz加载3 h。实验所用BioDynamic生物反应舱力学加载装置以硅橡胶膜片作为细胞微应变加载载体,微应变加载系统由Bose PCI和Win Testing联合控制参数、持续时间、拉伸、松弛频率,使弹性膜片产生精准应变,使培养在其膜表面的细胞受到张应力作用。微应变大小以硅橡胶膜载体拉伸应变率(%)表示,应变率越大,表示细胞所受张应力越大。(2)流式细胞术测定细胞周期。细胞加载结束后继续培养24 h,酶消化法分别收集各组髓核与纤维环细胞,1 000 r/min离心7 min弃上清,用无菌D-Hanks液轻微漂洗2次,75%乙醇固定,0.1%triton X-100处理30 min,10 mg/L碘化丙啶染色,流式细胞仪检测细胞DNA含量和细胞周期,Flow Plus软件处理数据。根据细胞周期中G0/G1期和G2/M期细胞比例计算S期细胞比例(%)及细胞增殖指数(prolifera⁃tive index,PI)。S期(%)=1-[G0/G1期(%)+G2/M期(%)],PI(%)=S期(%)+G2/M期(%)。
1.3 统计学方法 采用SPSS 16.0软件包处理,符合正态分布的计量数据以均数±标准差()表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 椎间盘组织病理 镜下可见纤维环组织细胞成分较少,集群生长,出现血管组织;基质纤维束疏松、紊乱,见图1。结合病例临床及病理资料,患者椎间盘为严重退变。
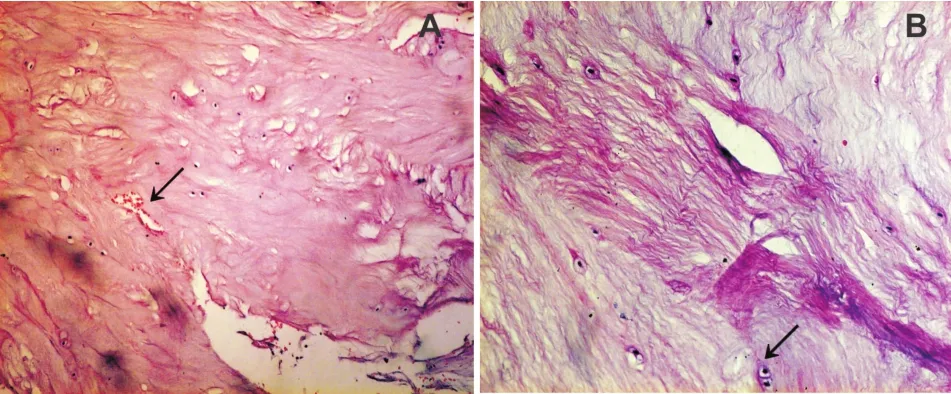
Figure 1 Pathological image of annular fibrosus and nucleus pulposus tissue biopsy(HE×100)图1 纤维环与髓核组织病理切片(HE×100)
2.2 人退变纤维环细胞的培养及鉴定
2.2.1 形态学观察 原代髓核细胞24 h后开始有少量细胞贴壁,5 d后可达80%融合,多为椭圆、多角形,呈类软骨样,胞核大而圆,胞浆丰富,内含分泌颗粒,见图2,随着传代髓核细胞贴壁时间变短,其增殖速度加快。纤维环细胞原代接种后24 h可见大部分细胞贴壁,主要为梭形,呈成纤维样鱼群生长,可见增殖旺盛的生发中心,4 d可达到95%以上融合,见图3。
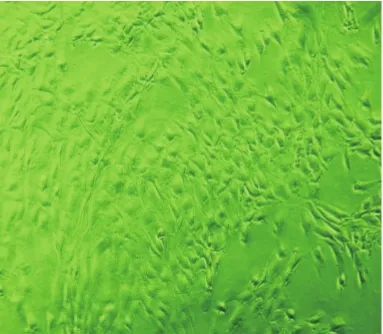
Figure 2 Nucleus pulposus cells cultured for 5 d(×100)图2 髓核细胞原代培养5 d(×100)

Figure 3 Annulus fibrosus cells in primary culture for 4 d(×100)图3 纤维环细胞原代培养4 d(×100)
2.2.2 甲苯胺蓝染色 髓核细胞甲苯胺蓝染色显示胞质均匀蓝染,胞核染色强于胞质,细胞分泌糖胺多糖的功能活跃,见图4;纤维环细胞核呈蓝色,基质着色没有髓核强,髓核细胞更接近于类软骨细胞特性,见图5。
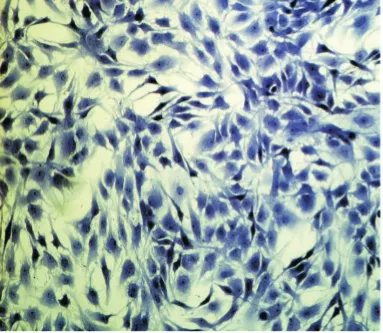
Figure 4 Nucleus pulposus cells stained with toluidine blue(×100)图4 髓核细胞原代甲苯胺蓝染色(×100)
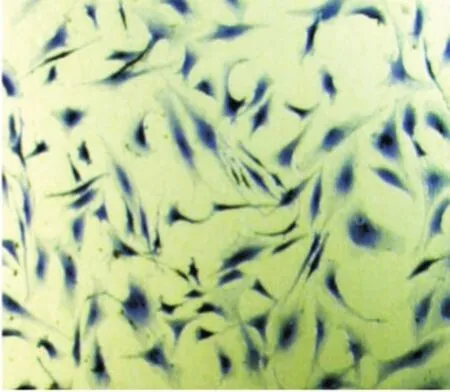
Figure 5 Annulus cells stained with toluidine blue(×100)图5 纤维环细胞原代甲苯胺蓝染色(×100)
2.2.3 Ⅱ型胶原免疫组化鉴定 细胞胞质呈褐色,髓核细胞Ⅱ型胶原阳性明显高于纤维环细胞,见图6、7。
2.2.4 不同牵张微应变环境对人退变髓核、纤维环细胞增殖的影响 随着微应变的增加,髓核细胞S期细胞比例在10万με、15万με时均高于纤维环细胞,差异有统计学意义(P<0.01),见表1。纤维环细胞PI值在各组微应变环境下均高于髓核细胞,差异有统计学意义(P<0.05或P<0.01),见表2。
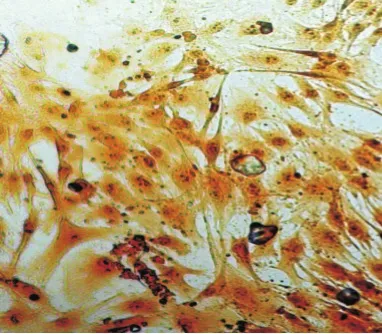
Figure 6 Nucleus pulposus cells type II collagen immunohistochemical staining(×100)图6 髓核细胞Ⅱ型胶原免疫组化(×100)
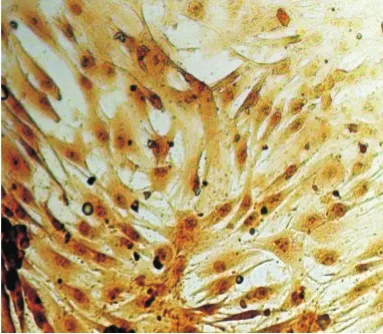
Figure 7 Annulus fibrosus cells of type II collagen immunohistochemical staining(×100)图7 纤维环细胞Ⅱ型胶原免疫组化(×100)
Table 1 Effect of cyclic stretch strain on the percentage of cells in S phase of human degenerative nucleus pulposus and annulus fibrosus cells表1 不同循环牵张微应变对人退变髓核与纤维环S期细胞的影响 (n=6,%)
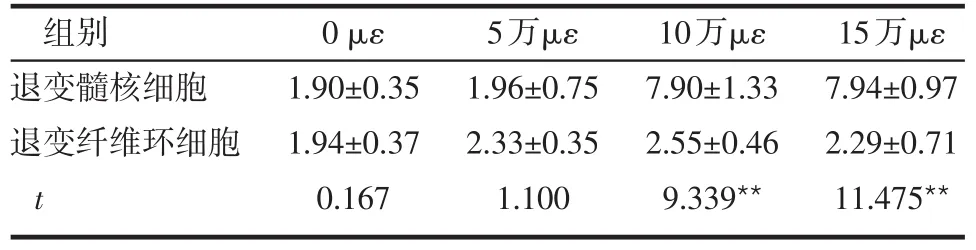
Table 1 Effect of cyclic stretch strain on the percentage of cells in S phase of human degenerative nucleus pulposus and annulus fibrosus cells表1 不同循环牵张微应变对人退变髓核与纤维环S期细胞的影响 (n=6,%)
**P<0.01
组别退变髓核细胞退变纤维环细胞t 0 με 1.90±0.35 1.94±0.37 0.167 5万με 1.96±0.75 2.33±0.35 1.100 10万με 7.90±1.33 2.55±0.46 9.339**15万με 7.94±0.97 2.29±0.71 11.475**
Table 2 Effect of cyclic stretch strain on PI value of human degenerative nucleus pulposus and annulus fibrosus cells表2 不同循环牵张微应变对人退变髓核与纤维环细胞PI值的影响 (n=6,%)

Table 2 Effect of cyclic stretch strain on PI value of human degenerative nucleus pulposus and annulus fibrosus cells表2 不同循环牵张微应变对人退变髓核与纤维环细胞PI值的影响 (n=6,%)
*P<0.05,**P<0.01
组别退变髓核细胞退变纤维环细胞t 0 με 2.90±1.10 16.94±3.44 9.511**5万με 6.90±1.49 21.13±3.16 9.966**10万με 14.10±3.03 24.55±3.70 5.341**15万με 15.04±4.20 22.19±4.46 2.854*
3 讨论
椎间盘由髓核、纤维环、软骨终板3部分组成。在组织学上,椎间盘由细胞及细胞外基质形成,细胞为髓核细胞与纤维环细胞;细胞外基质主要成分为水、胶原和蛋白聚糖。这使得椎间盘具有复杂的生物力学性能,使其能够最大程度地适应其特殊的力学环境,进而影响着其结构与形态[10-12]。椎间盘退变的主要病理改变为细胞数量减少及细胞外基质的结构、类型及质量的变化。目前认为椎间盘退变过程是一种由生物力学和细胞生物学相互作用引起的复杂病理过程[13]。包含基质的退变和细胞的退变,但其退变过程最初起于细胞功能退变还是基质功能退变,当前研究存在不同认识[14]。
本研究取材首先区分纤维环及髓核组织,并分别送病理以保证组织来源的可靠性。髓核组织分离出的细胞主要为软骨样细胞形态,糖胺多糖、蛋白多糖及Ⅱ型胶原染色均为阳性,符合髓核细胞的表达特点。纤维环组织分离获取的细胞多为纤维样,部分混杂有软骨样细胞但数量较少,甲苯胺蓝及Ⅱ型胶原免疫细胞化学染色均阳性表达。髓核细胞与纤维环细胞在细胞形态学及功能蛋白表达上并无明显差异,可能与其组织胚胎学来源相同有关。本研究提示髓核与纤维环细胞均可归为纤维软骨细胞,这与椎间盘本身的纤维软骨性质是一致的。随着微应变的增加,髓核细胞S期细胞百分比在10万με、15万με时明显高于纤维环S期细胞,而纤维环S期细胞则始终处于平稳状态。S期细胞比例的增加,反映出细胞处于旺盛的有丝分裂状态,可能原因是相同的微应变刺激下,髓核细胞对刺激更敏感,较小的应变刺激并未影响纤维环细胞的增殖,提示在椎间盘退变过程中髓核细胞可能对应力刺激首先做出反应,这与已有研究的髓核退变早于纤维环退变的结果是一致的[15]。对于细胞周期PI值的观察中,纤维环细胞PI值在各个微应变环境中均高于髓核细胞PI值,提示在椎间盘退变中,虽然髓核细胞对应力刺激较纤维环细胞敏感,但是对较低的微应变刺激产生的效应,纤维环细胞是始终大于髓核细胞。因此,髓核细胞的退变虽然早于纤维环细胞,但是整个退变过程中纤维环细胞退变速度及程度均大于髓核细胞。另外,应力刺激对于纤维环细胞的调节作用具有双向性,微应变对纤维环细胞增殖的促进作用有着最适宜应变值,而对于髓核细胞并未出现此最适宜微应变刺激,可能与研究本身设计的微应变加载区间有关。
生物力学因素在椎间盘退变过程中发挥着重要的调节作用,本研究观察到不同微应变环境对体外培养的髓核与纤维环细胞产生了不同的增殖效应,提示这2种细胞在退变过程中有着不同的退变机制并影响整个椎间盘退变的进展,但微应变环境与其他体内生理生化因素对椎间盘退变的调节机制仍需深入的研究。
[1]De Schepper EI,Damen J,Van Meurs JB,et al.The association be⁃tween lumbar disc degeneration and low back pain:the influence of age,gender,and individual radiographic features[J].Spine,2010,35(5):531-536.
[2]Fekete TF,Porchet F.Overview of disc arthroplasty-past,present and future[J].Acta Neurochir,2010,152(3):393-404.
[3]Freimark D,Czermak P.Cell-based regeneration of intervertebral disc defects:review and concepts[J].Int J Artif Organs,2009,32(4):197-203.
[4]Zhang YH,Zhao CQ,Jiang LS,et al.Substrate stiffness regulates apoptosis and the mRNA expression of extracellular matrix regula⁃tory genes in the rat annular cells[J].Matrix Biol,2011,30(2):135-144.
[5]Gilbert HT,Hoyland JA,Millward-Sadler SJ.The response of hu⁃man anulus fibrosus cells to cyclic tensile strain is frequency-de⁃pendent and altered with disc degeneration[J].Arthritis Rheum,2010,62(11):3385-3394.
[6]Adams MA,Dolan P,McNally DS.The internal mechanical func⁃tioning of intervertebral discs and articular cartilage and its rele⁃vance to matrix biology[J].Matrix Biol,2009,28(7):384-389.
[7]Gilchrist CL,Chen J,Richardson WJ,et al.Functional integrin sub⁃unit regulating cell matrix interactions in the intervertebral disc[J].J Orthop Res,2007,25(6):829-840.
[8]Walker MH,Anderson DG.Molecular basis of intervertebral disc de⁃generation[J].Spine,2004,4(6 Suppl):158-166.
[9] Lewin T.Osteoarthritis in lumbar synovial joints[J].Acta Orthop Scand,1964,73(Suppl):31.
[10]Sowa GA,Coelho JP,Bell KM,et al.Alterations in gene expression in response to compression of nucleus pulposus cells[J].Spine J,2011,11(1):36-43.
[11]Liu B,Qu MJ,Qin KR,et al.Role of cyclic strain frequency in regu⁃lating the alignment of vascular smooth muscle cells in vitro[J].Bio⁃phys J,2008,94(4):1497-1507.
[12]Hamilton DJ,Pilliar RM,Waldman S,et al.Effect of circumferential constraint on nucleus pulposus tissue in vitro[J].Spine J,2010,10(2):174-183.
[13]Zhang YH,Zhao CQ,Jiang LS,et al.Substrate stiffness regulates apoptosis and the mRNA expression of extracellular matrix regula⁃tory genes in the rat annular cells[J].Matrix Biol,2011,30(2):135-144.
[14]Gantenbein B,Grumhagen T,Lee CR,et al.An in vitro organ cultur⁃ing system for intervertebral disc explants with vertebral endplates:feasibility study with ovine caudal disc[J].Spine,2006,31(23):2665-2673.
[15]何卓凯,许乙凯,邱维加,等.骨质疏松症与腰椎间盘突出症的关系[J].广东医学,2007,28(12):1966-1967.
Effect of Stretch Micro-Strain on Proliferation of Human Degenerated Nucleus Pulposus and Annulus Fibrosus Cells
ZHANG Xiaolin,SUN Xiaolei,MA Xinlong
Department of Spine,Tianjin Hospital,Tianjin 300211,China
Objective:To explore the effect of cyclic stretch micro-strain on the proliferation of cultured human degen⁃erated nucleus pulposus and annulus fibrosus cells.Methods:The human degenerated intervertebral disc came from a case of 29-year-old patient with lumbar disc herniation,and the degree of degeneration was assessed through the pathological di⁃agnosis.Under the sterile condition,nucleus pulposus and annulus fibrosus cells were cultured respectively using enzymatic digestion.Cell lines were identified.The third generation cells were seeded on the silicone rubber membrane carrier,using the EF3200 mechanical tester equipped with BioDynamic bioreactor system,imposed a frequency of 0.25 Hz,strain 0 με,50 000 με,100 000 με and 150 000 με loaded 3 h,and then the proliferation activity was detected in different strain environ⁃ment using flow cytometry.Results:The degenerated nucleus pulposus and annulus fibrosus cells grew well after the stress load.With the micro-strain increased,the percentage of degenerative nucleus pulposus cells in S phase was significantly high⁃er than that of annulus fibrosus cells in 100 000 με and 150 000 με (P<0.01).The PI value of degenerative annulus fibrosus cells was significantly higher than that of nucleus pulposus cells in every micro-strain value(P<0.05).Conclusion:The overall effect of micro-strain loading on human degenerated nucleus pulposus and annulus fibrosus cells is consistent.The promotion effect on proliferation is significantly higher in annulus fibrosus cells than that of nucleus pulposus cells under the same micro-strain stimulation.
intervertebral disk displacement flow cytometry intervertebral discs degeneration nucleus pulposus cells annulus fibrosus cells stretch micro-strain proliferation index
10.3969/j.issn.0253-9896.2012.08.008
*天津市卫生局科技基金项目(项目编号:2011KZ57)
300211天津市天津医院脊柱外科(张晓林),骨科研究所(孙晓雷),骨科(马信龙)
△通讯作者E-mail:maxinlong8686@sina.com
(2012-03-06收稿 2012-07-06修回)
(本文编辑 李国琪)

