挥发性有机物混合物对人支气管上皮细胞系转化及染色体稳定性的影响研究
张桂芝,刘长庭,熊玮,刘东山
挥发性有机物混合物对人支气管上皮细胞系转化及染色体稳定性的影响研究
张桂芝,刘长庭,熊玮,刘东山
目的为探讨化学混合物联合致癌的机制,揭示恶性转化与染色体不稳定性之间的关系,本研究观察了挥发性有机物(VOC)混合物(以VOCs表示)对人支气管上皮细胞系BEAS-2B转化和染色体稳定性的影响。方法用VOCs作为诱导剂,以液体染毒后测定BEAS-2B细胞的半数致死量(LC50),以低剂量(8%LC50)对BEAS-2B细胞进行诱导,获得诱导细胞。观察细胞生长特性改变并筛选诱导克隆,然后用细胞遗传学方法(G带染色法)观察诱导细胞染色体畸变情况。结果BEAS-2B细胞在VOCs作用后细胞逐渐变大、变圆,细胞质丰富,并伴有多角形或不规则形;核嗜碱深染,体积增大,核仁增多;细胞复层生长,排列紊乱,细胞克隆为无序的条索状团块状排列。经VOCs诱导后细胞倍增时间〔(1.79±0.02)d〕较对照细胞〔(2.08±0.03)d〕缩短,而饱和密度〔(529.1±31.6)×104/ml〕、最大增殖倍数〔(104.8±6.2)倍〕均高于对照细胞〔(321.2±13.1)×104/ml和(54.6±5.4)倍〕,差异均有统计学意义(P<0.01)。VOCs诱导细胞第15代可在软琼脂培养基内形成典型的甚至肉眼可见的阳性细胞克隆,克隆形成率(35.02±7.80)%高于对照细胞(0.13±0.05)%,差异有统计学意义(P<0.01)。对照细胞与诱导细胞的染色体核型分布比较,差异有统计学意义(P<0.01);诱导细胞中二倍体(2n=46)比例降低,出现了一定数量的非整倍体(77条、80条染色体)、大量亚二倍体(<2n)、超二倍体(>2n&<4n)和多倍体(≥4n)细胞,其非稳定性畸变频率(67%)高于对照细胞(4%),差异有统计学意义(P<0.01)。结论VOCs可使BEAS-2B细胞发生转化,并影响细胞染色体的稳定性,使其发生畸变并向恶性化方向发展。
挥发性有机物;人支气管上皮细胞;染色体不稳定性
室内空气污染已成为世界各国广泛关注的问题,被公认为人类健康最危险的杀手之一。在对室内空气的检测中,共发现30多种挥发性有机物(volatile organic compound,VOC),某些有害气体浓度比室外高出10倍甚至几十倍,其中致癌物质、致病病毒有20多种。室内VOC大多来自建筑材料、结构材料、装饰材料等,其中甲醛、苯、甲苯和二甲苯是较常见的室内VOC[1-2]。室内VOC污染可持续6个月~1年,有的甚至长达几年[3]。现已证明长期低浓度接触VOC会使人体产生全身变态反应,甚至会造成居室人员患上癌症[4]。
先期研究发现VOC混合物(以VOCs表示)具有与单个成分不同的化学性质和毒性特征,高剂量时呈现细胞致死效应,较低剂量时呈现一种细胞转化效应[5]。为探讨VOCs慢性联合作用,本研究选取装修材料中常见的12种VOC组成混合物,观察其作用于人支气管上皮细胞后细胞生长特性及染色体稳定性的改变,以探讨VOCs对细胞转化的机制,揭示染色体不稳定性与化学联合致癌之间的关系。
1 材料与方法
1.1 材料
1.1.1 细胞永生化人支气管上皮细胞系(BEAS-2B),为军事医学科学院二所保存细胞株,染色体核型为近二倍体。细胞株含SV40 DNA,表达T抗原,但不含腺病毒DNA。细胞以LHC-8无血清培养液(LHC-8 SERUM-FREE MEDIUM with GLUTAMINE)培养,接种于25 cm2或75 cm2的培养瓶内,在95%相对湿度、5%二氧化碳(CO2)、37℃培养箱内孵育,每周传代1次,传代后3 d换液。
1.1.2 试剂诱导剂VOCs由苯、甲苯、二甲苯等12种有机物等体积组成,各试剂均为分析纯,由北京化学试剂公司生产。BEAS-2B细胞(美国ATCC细胞库);碘化丙啶(美国Sigma-Aldrich公司);LHC-8无血清培养液(美国Biofluids INC公司);LHC基础培养液(美国Biofluids Biobource INC公司);噻唑兰(MTT,美国Amersham LIFE SCIENCE公司);6-硫鸟嘌呤(6-TG,美国Sigma公司);F-12培养基(F-12,美国GIBCO公司);胰蛋白酶(Try,美国GIBCO公司);胎牛血清(北京元亨圣马生物技术研究所);琼脂糖(美国Promega公司);乙二胺四乙酸二纳(EDTA-Na2,美国Sigma公司);细胞松弛素B(美国Sigma公司);二甲基亚砜(DMSO,美国Sigma公司);其他试剂为进口或国产分析纯。
染毒液配置:1.0 ml VOCs与100%乙醇以1∶1混合,再以LHC-8无血清培养液稀释1 000倍至所需浓度。乙醇的最终浓度不超过0.1%,以免影响培养细胞的正常生理生化功能。
1.2 方法
1.2.1 细胞染毒剂量的筛选(MTT法)采用MTT法确定BEAS-2B细胞对测试毒物VOCs的敏感性,并以细胞存活率计算出VOCs的半数致死量(LC50)。按司徒镇强等[6]方法进行操作,结果以细胞存活率对剂量作图,求出LC50值。
1.2.2 细胞转化和克隆筛选VOCs对细胞进行低剂量(8%LC50)染毒24 h后,D-hanks液洗涤3次,加入4 ml LHC-8无血清培养液继续培养至存活细胞形成克隆,用胰酶消化收集细胞并转入新的培养瓶,此为染毒转化第1代细胞。然后每2 d换液1次,稳定后改为1次/3 d,每6 d传代1次,每次接种1×105个细胞连续传代培养。严密观察细胞生长变化,并验证相关的生物学特性后确定为诱导细胞,以未染毒的BEAS-2B细胞作为对照细胞。
1.2.3 细胞生长曲线测定常规消化第10代诱导细胞及其对照细胞,制成细胞悬液后以5×104/皿分别接种于21~35个含3 ml 37℃预温LHC-8无血清培养液的60 mm培养皿中,各组每24 h取3皿进行细胞计数并计算均值,按时给未计数的细胞换液。计数持续到对照细胞出现明显密度抑制为止。以时间为横轴,细胞数为纵轴(指数),绘制生长曲线。按下列公式计算细胞倍增时间(doubling time,DT):DT=t×〔log2/(logNt-logN0)〕,其中t代表培养时间,N0及Nt分别代表接种后及培养t小时后的细胞数;同时,计数稳定期细胞数,计算单位体积的细胞均数,即细胞生长饱和密度。
1.2.4 半固体克隆形成实验用LHC基础培养液配制1.4%的备用琼脂糖,高温高压灭菌后放入39℃水浴中保温,用预温的LHC-8无血清培养液稀释为0.7%琼脂糖。以3 ml/皿倒入60 mm带格培养皿中,铺制底层、凝固后备用。常规消化收集第15代诱导细胞及对照细胞,与0.7%琼脂糖1∶1混匀稀释为0.35%细胞琼脂混合液,加到培养皿中0.7%琼脂糖凝胶上(细胞浓度为1×104/皿),凝固后每皿加入2 ml LHC-8无血清培养液,每组5皿,静置培养。每3 d换液1次,4周后镜下计数直径>75 μm或细胞多于50个的克隆数,按下列公式计算克隆形成率:克隆形成率=克隆数/接种细胞数×100%;同时,挑取阳性细胞克隆继续培养后进行染色体分析。
1.2.5 细胞染色体标本的制备培养细胞50%~60%融合时,加入秋水仙素(终浓度0.03 g/L),继续培养3 h,Gibco trypsin-EDTA消化液消化部分细胞脱壁,加入1/20体积的Gibco胎牛血清终止消化,离心得到细胞沉淀;细胞沉淀经低渗、预固定、固定、二次固定后制备成细胞悬液,悬液滴于冷冻的洁净载玻璃片上,文火烘干制备染色体标本片,经37℃,5~7 d老化,以0.02%胰蛋白酶消化10~15 s,吉姆萨染色。
1.2.6 染色体镜检分析方法低倍镜下(10×10)选择染色体分散良好、长短适宜、着色均匀的中期分裂相。油镜下每株细胞观察50~100个中期分裂细胞,计数染色体数目。染色体结构分析:观察25个中期分裂细胞,选取至少10个具有畸变共性的细胞进行显微摄影。照片冲洗放大后,参照人标准核型进行核型分析。
1.3 统计学方法采用SPSS 13.0分析软件,计量资料以(±s)表示,组间比较采用t检验;VOCs LC50分别以作图法进行计算,同时采用概率单位法(PROBIT)进行验证;其他数据依据其性质分别采用计数资料的χ2检验或非参数检验的秩和检验进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 VOCs细胞染毒剂量的筛选结果由图1可知,VOCs的LC50为0.82 g/L,PROBIT计算所得LC50为1.10 g/L,经拟和优度的χ2检验(Pearson Goodness-of fit Chi Squre),χ2=912.661,P<0.01,不接受“对称S形曲线”的假设,认为可信区间(CI)计算中未使用非齐同因素,95%CI为(0.99,2.05)g/L。本研究以8%LC50(0.068 g/L)作为细胞的诱导剂量,即12.5 μl/ml培养液体系对BEAS-2B细胞进行诱导,待长期培养后筛选阳性克隆用于染色体分析。
2.2 诱导细胞的形态变化光镜下观察:正常的BEAS-2B细胞多为梭形,大小均匀,细胞质较少,细胞间连接较紧密;细胞核多呈椭圆形,单个核仁;单层生长,排列有序或放射状,有明显接触抑制和密度抑制(见图2)。而VOCs诱导细胞体积变大,呈圆形或类圆形,常伴有多角形不规则形,细胞质丰富;核嗜碱深染,核仁1个至数个不等;复层生长,排列不规则,呈现无序团块状,无明显接触抑制和密度抑制(见图3)。
2.3 细胞生长特性VOCs作用初期,对照细胞和诱导细胞的生长速度相差不大,诱导细胞自第5天开始生长速度加快,第12天时对照细胞已出现接触抑制和密度抑制,呈现明显饱和状态,细胞已不再增殖,达到细胞培养的最大密度时间,而此时诱导细胞仍可继续增殖(见图4);此时,诱导细胞倍增时间、饱和密度及最大增殖倍数与对照细胞比较,差异均有统计学意义(P<0.01,见表1)。
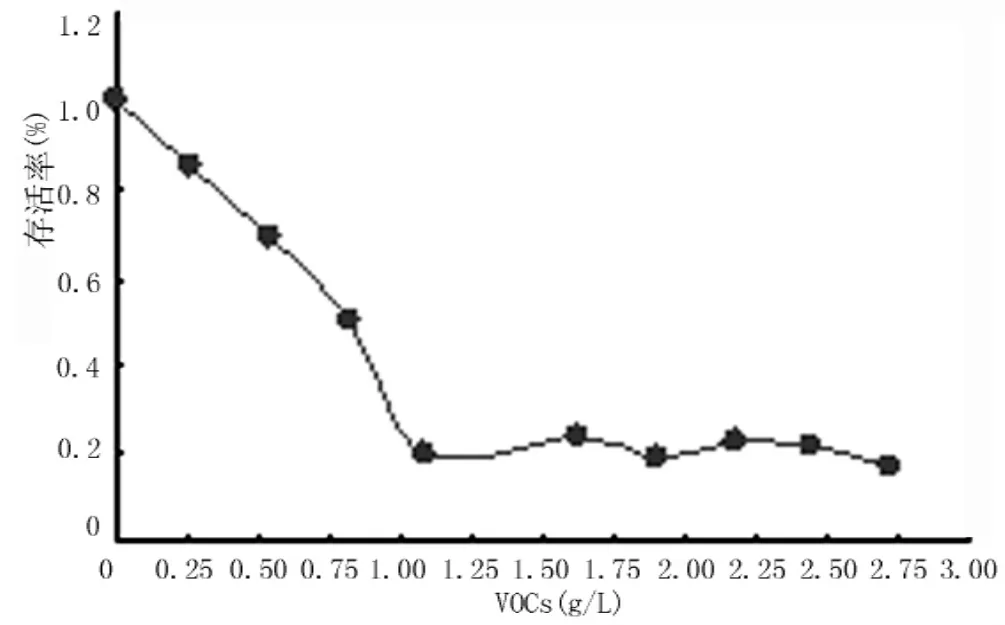
图1 混合液中VOCs-MTT细胞存活曲线Figure 1 The suevival curve of BEAS-2B cells induced by VOC mixture
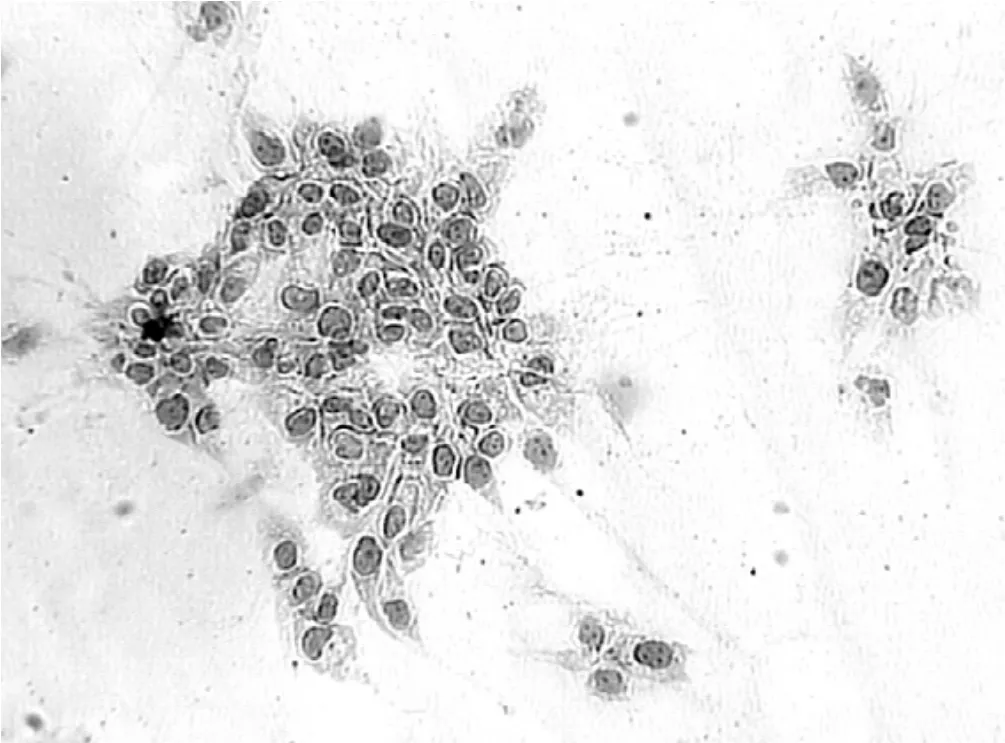
图3 VOCs诱导细胞(HE染色,10×10)Figure 3 The induced cells by VOCs(HE,10×10)
表1 对照细胞及诱导细胞生长曲线的特性(±s)Table 1 The characters of growth curve of BEAS-2B and induced cells
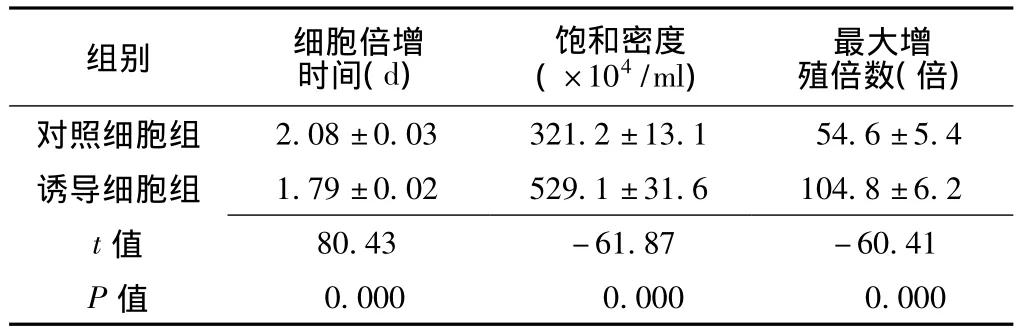
表1 对照细胞及诱导细胞生长曲线的特性(±s)Table 1 The characters of growth curve of BEAS-2B and induced cells
组别细胞倍增时间(d)饱和密度(×104/ml)最大增殖倍数(倍)2.08±0.03321.2±13.154.6±5.4诱导细胞组1.79±0.02529.1±31.6104.8±6.2 t对照细胞组80.43-61.87-60.41 P值值0.0000.0000.000
2.4 半固体克隆形成率通常情况下,对照细胞(即正常BEAS-2B细胞)不能在半固体琼脂中生长;而VOCs诱导细胞第15代失去接触抑制具有锚着独立性生长能力,能够在半固体琼脂中形成集落(见图5),其半固体克隆形成率(35.02±7.80)%与对照细胞(0.13±0.05)%比较,差异有统计学意义(t=-44.70,P<0.01)。
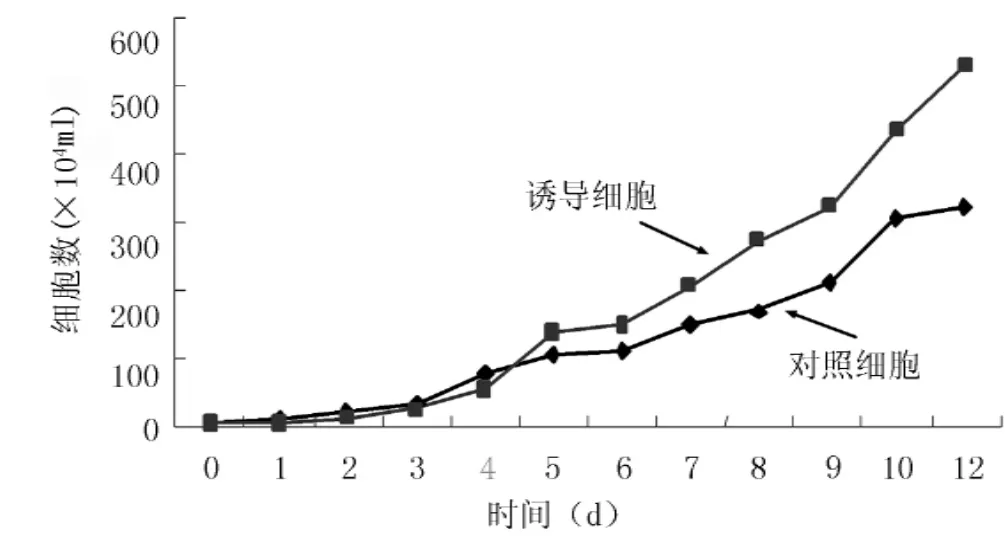
图4 对照细胞及诱导细胞的生长曲线Figure 4 The growth curves of control BEAS-2B and induced cells
2.5 VOCs诱导细胞染色体核型的变化
2.5.1 染色体数目的变化对照细胞与诱导细胞的染色体核型分布比较,差异有统计学意义(P<0.01);对照细胞(即正常BEAS-2B细胞)的染色体数目以二倍体核型(2n=46)为主,亚二倍体(<2n)、多倍体(≥4n)很少,且传代过程中保持稳定;而诱导细胞二倍体核型比例下降,以超二倍体(>2n&<4n)及多倍体为主,多倍体多见(见表2)。
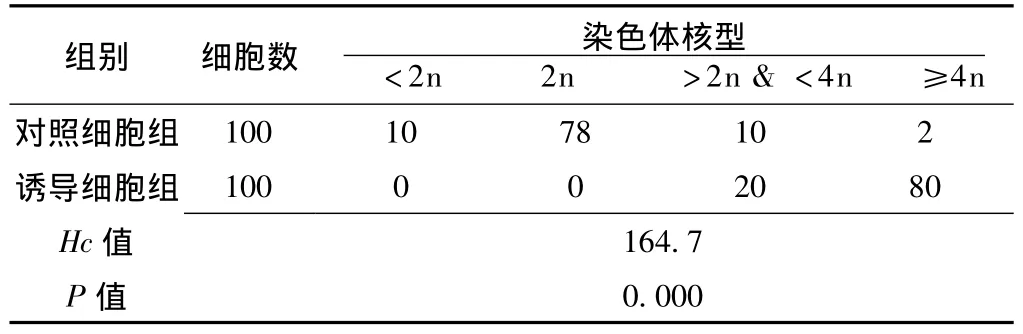
表2 对照细胞和诱导细胞染色体核型分布情况比较(%)Table 2 The chromosome karyotype ratio of induced cells and control BEAS-2B cells
2.5.2 染色体结构的改变对照细胞代表核型为二倍体(2n=46),但其5、15、16号染色体各丢失1条染色体,呈单体型状态,而相同位置各有1条未知染色体分别与各染色单体配对,且这3条染色体在传代过程中稳定表达,因此将其作为BEAS-2B细胞的标记染色体,分别表示为M1、M2、M3。可见,BEAS-2B细胞是单体型混合配对的假二倍体细胞,其典型核型见图6。
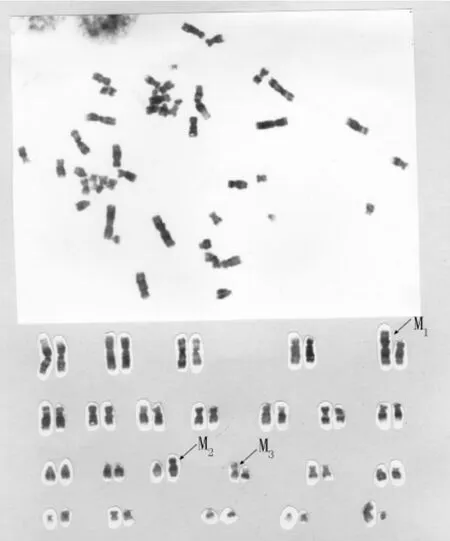
图6 对照细胞(正常BEAS-2B细胞)核型2n=46,XY,-5,-15,-16,+M1,+M2,+M3Figure 6 The karyotype of BEAS-2B cell(G-banding)2n=46,XY,-5,-15,-16,+M1,+M2,+M3

图7 VOCs诱导细胞的多倍体图像(箭头示dic/tri)Figure 7 The structural changes of chromosomes of polyploid induced cell(dic,ace)
诱导细胞核型为多倍体,与对照细胞相比有较大变化,出现一定数量的非整倍体(77条、80条染色体),说明染色体结构发生了明显的丢失和重排,同时可见数对双着丝粒(dic)或三着丝粒(tri)染色体(见图7)。2.5.3 多倍体核型非稳定性畸变对照细胞与诱导细胞非稳定性畸变结果见表3,显示在所计数的100个细胞中,对照细胞总的非稳定性畸变〔染色体易位(t)和染色体增长(+)〕发生频数为4%(4/100);诱导细胞总的非稳定性畸变〔dic、tri、ace、环状染色体(r)、t、+〕发生频数为67%(67/100),二者比较差异有统计学意义(P<0.01)。

表3 对照细胞和诱导细胞染色体非稳定性畸变发生频率(%)Table 3 The non-stabilizing chromosome aberration frequency of control BEAS-2B cells and induced cells
3 讨论
自从1914年德国科学家Boveri提出恶性细胞存在遗传不稳定性以来,人类对遗传不稳定性与肿瘤的关系已有了一定的认识。人类肿瘤细胞中存在两种类型的基因组不稳定,一种是错配修复基因突变导致的核苷酸水平的遗传不稳定性,称为微卫星不稳定性(microsatellite instability,MIN);另一种是在染色体水平产生的遗传不稳定性,称为染色体不稳定性(chromosome instability,CIN)[7]。CIN主要包括染色体结构异常和数目异常。结构异常包括杂合缺失、染色体易位、重排、基因扩增导致的染色体均染区、双微体等;数目异常主要是非整倍体。CIN是人类实体瘤中常见的现象之一,目前的研究表明其在肿瘤的发生、发展中有重要作用[8]。
本研究发现,永生化的BEAS-2B细胞在VOCs作用后细胞逐渐变大、变圆,细胞质丰富,并伴有多角形或不规则形;核嗜碱深染,体积增大,核仁增多;细胞复层生长,排列紊乱,细胞克隆为无序的条索状团块状排列。经VOCs诱导后细胞生长加快,倍增时间缩短,呈现无限增殖趋势,无明显的接触抑制和密度抑制。诱导细胞转化后期已具有很强的锚着独立性生长能力,可在软琼脂培养基内形成典型的甚至肉眼可见的阳性细胞克隆,克隆形成率为(35.02±7.80)%,显著高于对照细胞的(0.13±0.05)%,说明诱导细胞的遗传性状发生改变,具备了慢性转化特性,完成了癌前转化,极有可能转化为癌细胞。因为能在软琼脂介质中形成克隆标志着细胞发生恶性转化。
造成染色体不稳定的染色体数量变化通常是有丝分裂过程中染色体错误分离的结果。本研究染色体分析发现,诱导细胞中二倍体(2n=46)比例显著降低,出现了一定数量的非整倍体(77条、80条染色体)、大量亚二倍体(<2n)、超二倍体(>2n&<4n)和多倍体(≥4n)细胞;而诱导细胞则以多倍体最为突出。这种染色体众数(modal number)由二倍体向近二倍体、非整倍体、多倍体转化的趋势,代表着细胞增殖失控、核分裂加速,染色体复制过程错误率升高,核浆分裂失衡等增生细胞的特性;同时多倍体细胞群体的形成与诱导细胞全面恶性表型和致瘤性的获得,与细胞转化启动、增殖分化失控和多倍体克隆的急剧扩增有直接关系。非稳定性畸变作为非平衡的互换畸变,其直接后果是引起细胞死亡。诱导细胞有大量非稳定性畸变(dic、tri、ace、r、t、+),其非稳定性畸变频率为67%,显著高于对照细胞的4%。说明携带有非稳定性畸变的细胞在传代选择过程中不仅未失去分裂增殖能力,反而获得了明显的生长优势。这表明在长期低浓度VOCs存在时,支气管上皮细胞系染色体不稳定性逐渐增加,易发生各类畸变并向恶性化方向转化,可能导致肿瘤发生。有研究表明细胞染色体畸变率与肺癌临床分期密切相关[9],染色体畸变分析有望作为临床肺癌诊断及分期判断的一项有意义的实验室检查手段。
虽然多项研究表明发生于体外细胞的癌变过程中,细胞遗传学的改变与体内细胞癌变历程中染色体的异常非常接近,分析诱导细胞的染色体核型将有助于了解机体细胞癌变过程中所发生的细胞遗传学改变;但化学致癌过程毕竟是以细胞生长和分化逐步失控,历经启动(initation)、促进(promotion)和演进(progression)各阶段的多步骤过程。本研究所得的体外环境下VOCs对BEAS-2B细胞诱导研究,一方面可以作为下一步研究基因、蛋白水平致癌机制的启示;另一方面,还要充分考虑VOCs与人体正常支气管上皮细胞实际的作用机制及其相应的毒性机制。今后研究中在探讨细胞毒性作用机制的同时,必须结合动物毒理学研究和人群流行病学结果,这样才能真正揭示化学混合物(如VOCs)对机体细胞的化学致癌机制。
1 许真,金银龙.室内空气主要污染物及其健康效应[J].卫生研究,2003,32(3):279-283.
2 Pandit GG,Srivastava PK,Mohan Rao AM.Monitoring of indoor volatile organic compounds and polycyclic aromatic hydrocarbons arising from kerosene cooking fuel[J].Science of the Total Environment,2001,279(1/2/3):159-165.
3 Hodgson AT,Rudd AF,Beal D,et al.Volatile organic compound concentrations and emission rates in new manufactured and site-built houses[J].Indoor Air,2000,10(3):178-192.
4 程静,占建波,唐岱琨,等.室内空气中总挥发性有机物污染防治研究进展[J].公共卫生与预防医学,2011,22(2):66-68.
5 刘东山,张桂芝,金银龙.挥发性有机物(VOCs)对永生化支气管上皮细胞(BEAS-2B)急性毒性[J].首都医科大学学报,2005,26(6):662-666.
6 司徒镇强,吴军正.细胞培养[M].西安:世界图书出版社,1996:186-187.
7 Hartwell L.Defects in a cell cycle checkpoint may be responsible for the genomic instability of cancer cells[J].Cell,1992,71(4):543-546.
8 Boland CR,Komarova NL,Goel A.Chromosomal instability and cancer:not just one CINgle mechanism[J].Gut,2009,58(2):163-164.
9 熊玮,黄桂君,钱桂生,等.肺癌染色体畸变分析[J].重庆医学,2002,31(9):776-777.
Study of the Effect of Volatile Organic Compounds on the Transformation and Chromosomal Instability of Human Bron-chial Epithelial
ZHANG Gui-zhi,LIU Chang-ting,XIONG Wei,et al.Department of Respiratory Diseases,Chinese PLA General Hospital,Beijing 100853,China
ObjectiveTo investigate the co-carcinogenic mechanisms of chemical mixtures and reveal the relationship between malignant transformation and chromosome instability.This study observed the impact of a mixture of volatile organic compounds(VOCs)on the transformation and chromosome stability of human bronchial epithelial cell line BEAS-2B in vitro.MethodsVOCs worked as inducers and were used to determine the median lethal dose of BEAS-2B(LC50)after contamination;BEAS-2B cells were induced by low dose of LC50(8%LC50)and then got the induced cells.The characteristics change of cell growth was observed and the induced clone was filtered,the induction of chromosome aberrations was observed by using cytogeneticMethods(G band staining)then.ResultsAfter VOCs induction,BEAS-2B cells gradually became large and roungded,abundant cytoplasm,accompanied with polygon or irregular shape;the nuclear of the cells were basophilic hyperchromatic,the volume and the nucleoli of the nuclear were increased;the growth of the cells tend to be multi-layered with disordered arrangement,the cell clones arranged disorderly cord-like lumps.The doubling time of VOCs induced cells was significantly shortened compared with that of the control cells〔(1.79±0.02)d VS(2.08±0.03)d〕,the saturation density and the biggest proliferation multiples were significantly higher than those of the control cells〔(529.1±31.6)×104/ml VS(321.2±13.1)×104/ml;(104.8±6.2)times VS(54.6±5.4)times,P<0.01〕.The 15th generation of VOCs induced cells formed typical even visible positive cell clones on soft agar medium,clone formation rate was significantly higher than that of control cells〔(35.02±7.80)%VS(0.13±0.05)%,P<0.01〕.The karyotype distributions of control cells and induced cells had statistically significant difference(P<0.01).The proportion of the diploid(2n=46)in the induced cells was significantlylower.A certain number of aneuploid〔77,(>2n&<4n),chromosome 80〕,a large number of hypodiploid(<2n),hyperdiploid and polyploid cells(≥4n)appeared;the non-stability chromosome aberration frequency was 67%,accompanied by a large number of non-stability aberrations(dic,tri,ace,r,t,+)which all significantly higher than those of the control cells(P<0.01).ConclusionVOCs could induce the transformation of BEAS-2B cells;it could also affect the stability of the cell chromosome,cause aberration and make cell transformation to malignization direction.
Volatile organic compounds;Human bronchial epithelial cells;Chromosomal instability
R 394.224
A
1007-9572(2012)11-3861-05
10.3969/j.issn.1007-9572.2012.11.097
100853北京市,中国人民解放军总医院南楼呼吸科(张桂芝,刘长庭);第三军医大学西南医院呼吸科(熊玮);中国疾病预防控制中心公共卫生管理处(刘东山)
刘东山,100050北京市,中国疾病预防控制中心公共卫生管理处;E-mail:martinliuer1204@yahoo.com.cn
2012-08-13;
2012-10-24)
(本文编辑:刘莉)

