亚低温对大鼠全脑缺血再灌注损伤后神经元凋亡的干预研究
陈辉,毕长柏,薛春琴,景晓平,陈建萍
亚低温对大鼠全脑缺血再灌注损伤后神经元凋亡的干预研究
陈辉,毕长柏,薛春琴,景晓平,陈建萍
目的探讨亚低温对大鼠全脑缺血再灌注损伤后神经元凋亡的影响。方法选取成年雄性健康清洁级Wistar大鼠42只,随机分为假手术组、对照组及亚低温组。亚低温组和对照组采用大鼠4条血管阻断全脑缺血模型(Pulsinelli-4VO法)制备大鼠全脑缺血再灌注模型,假手术组仅切开颈部皮肤和肌层暴露双侧椎动脉和颈动脉,不行椎动脉凝闭和颈总动脉夹闭。假手术组和对照组置于室温下,亚低温组给予亚低温处理。采用流式细胞仪对海马神经元Bcl-2、Bax表达进行测定。结果假手术组、对照组及亚低温组神经元凋亡百分率及增殖指数比较,差异均有统计学意义(F=142.869,P<0.01;F=153.993,P<0.01)。假手术组Bcl-2、Bax表达(均道值)微弱,在此忽略;对照组Bcl-2、Bax表达(均道值)与亚低温组比较,差异均有统计学意义(t值分别为63.747、28.803,P<0.01);两组Bcl/Bax比值比较,差异亦有统计学意义(t=9.601,P<0.01)。结论全身亚低温可有效干预大鼠全脑缺血再灌注损伤后神经元凋亡,其机制与Bcl-2、Bax的表达有关,受到二者比值的调控。
再灌注损伤;亚低温;细胞凋亡;Bal-2;Bax
随着急救技术的提高,一些心肺复苏、颅脑创伤、卒中、休克、窒息等危重患者存活率逐渐提高,这些疾病所造成的脑缺血损伤以及缺血再灌注损伤已成为研究热点。从形态学、生化等多角度证实神经元凋亡存在于脑缺血再灌注损伤中[1]。探讨如何有效抑制凋亡是减轻脑缺血再灌注损伤的一个重要环节。亚低温作为保护缺血性脑组织损伤的方法之一成为研究热点。本研究通过观察亚低温作用对脑缺血后及脑缺血再灌注后细胞凋亡及Bcl-2、Bax表达的影响,旨在为临床应用提供可靠的实验依据。
1 材料与方法
1.1 实验动物与分组成年健康清洁级Wistar大鼠42只,雄性,体质量250~280 g,由河北医科大学实验动物中心提供(合格证编号604186)。采用随机区组设计方案分为3组,即假手术组(14只)、对照组(14只)和亚低温组(14只)。
1.2 方法
1.2.1 模型的制备亚低温组和对照组采用大鼠4条血管阻断全脑缺血模型(Pulsinelli-4VO法)制备大鼠全脑缺血再灌注模型。假手术组仅切开颈部皮肤和肌层暴露双侧椎动脉和颈动脉,不行椎动脉凝闭和颈总动脉夹闭。假手术组和对照组置于室温下,术中及术后用60 W白炽灯照明,调节灯泡至大鼠的距离,以保持大鼠肛温在(37.0±0.5)℃。亚低温组于缺血再灌注后即刻给予亚低温处理。在缺血时大鼠没有出现昏迷或者发生了振颤、翻转,以及在复灌时发生痉挛、癫痫等情况均被淘汰。
1.2.2 亚低温的方法控制室温在25~30℃,采用冰袋法诱导亚低温。用冰袋覆盖大鼠体表暴露部位,冰量按比例100 g/100 mg体质量计算,诱导时间在10 min以内。用欧姆龙(中国)有限公司生产的MC-108型电子体温表(精度±0.05℃),将探头插入直肠4~5 cm测量直肠温度,维持大鼠肛温在(31.0±1.0)℃,每10 min测量大鼠肛温1次,采用调整冰袋数量调节体温,并严密观察大鼠生命体征,维持6 h后,用白炽灯缓慢复温至(37.0±0.5)℃,观察1 h后放至笼中饲养。术后呼吸不平稳,体温不能维持(37.0±0.5)℃的大鼠被淘汰。
1.2.3 标本的制备于再灌注及假手术后48 h麻醉动物(10%水合氯醛腹腔注射,350 mg/kg),断头取脑,分离海马组织置于70%乙醇中4℃保存待检。
1.2.4 流式细胞分析仪检测应用流式细胞分析仪对海马神经元Bcl-2、Bax表达进行测定。鼠抗人Bax单克隆抗体及抗人Bcl-2单克隆抗体均购自北京中杉金桥生物技术有限公司。采用美国Beckman Coulter公司生产的Epics-XLⅡ型流式细胞仪,激发光源为15 mW氩离子激光器,激发波长为488 nm,应用Expo 32 ADC进行免疫荧光数据分析,用Muticycle AV分析软件对DNA细胞周期拟和分析。
1.2.5 细胞增殖计算方法应用DNA细胞周期分析软件,计算出DNA组方图各时相分布的百分比,以增殖指数(PI)表示细胞的增殖活性,公式:
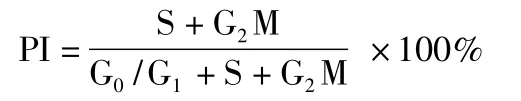
注:S、G0、G1、G2、M分别表示细胞周期的不同时期,G0期表示静止期;G1表示RNA和蛋白质的合成,但DNA含量仍保持2倍体;S期表示DNA从2倍体复制到4倍体;G2期表示DNA成为4倍体,继续合成RNA及蛋白质;M期表示将复制了的染色体分到两个子细胞中。
1.2.6 蛋白表达定量分析以荧光指数(FI)表示蛋白的相对含量,即:

1.3 统计学方法采用SPSS 14.0统计软件进行分析,计量资料以(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用q检验。以P<0.05为差异有统计学意义。
2 结果
2.13 组神经元凋亡百分率比较假手术组神经元凋亡百分率为(2.3±0.4)%;对照组为(15.1±2.0)%;亚低温组为(3.5±0.2)%。3组神经元凋亡百分率比较,差异有统计学意义(F=142.869,P<0.01);其中两两比较,差异均有统计学意义(P<0.01)。
2.23 组PI比较假手术组PI为(49.3±2.4)%;对照组为(8.8±1.2)%;亚低温组为(37.6±2.9)%。3组PI比较,差异有统计学意义(F=153.993,P<0.01);其中两两比较,差异均有统计学意义(P<0.01)。
2.33 组Bcl-2、Bax表达均道值比较对照组及亚低温组的FI均>1.0,为阳性表达。
2.3.1 Bcl-2表达均道值比较假手术组Bcl-2表达(均道值)微弱,在此忽略;对照组为(293.5±19.1);亚低温组为(364.2±15.1)。对照组Bcl-2表达(均道值)与亚低温组比较,差异有统计学意义(t=63.747,P<0.01)。
2.3.2 Bax表达均道值比较假手术组Bax表达(均道值)微弱,在此忽略;对照组为(402.0±8.2);亚低温组为(201.7±13.5)。对照组Bax表达(均道值)与亚低温组比较,差异有统计学意义(t=28.803,P<0.01)。
2.3.3 Bcl-2表达均道值/Bax表达均道值(Bcl/Bax)比较
对照组Bcl/Bax比值为(0.73±0.49);亚低温组为(1.81±0.15)。两组Bcl/Bax比值比较,差异有统计学意义(t=9.601,P<0.01)。
3 讨论
全脑缺血再灌注损伤后细胞死亡有两种方式,即坏死和凋亡。细胞凋亡与细胞坏死的本质区别在于前者是一种主动的死亡过程,并伴随基因的转录和蛋白质的合成,特征性的变化是DNA的寡核小体间裂解,在凝胶电泳时呈现特征性的“DNA”梯[2]。细胞凋亡形态学表现为核固缩、胞膜发泡和凋亡小体形成。细胞凋亡是由特定的基因调控,无明显细胞溶解的过程。脑缺血后神经元坏死多发生在缺血后即刻及数分钟至1 d内出现损伤灶的中心部位。脑缺血所致的神经元凋亡则主要出现在损伤灶四周的缺血缺氧区及半影区内迟发型神经元死亡和对缺血缺氧敏感的海马、齿状回和大脑皮质的神经元。
近年来的研究表明,缺血再灌注损伤机制主要与氧自由基生成增多、细胞内酸中毒、细胞内钙超载、炎性反应和基因调控等密切相关[3]。一定程度的低压、低温、低pH、低钠、低钙溶液灌流,可减轻组织器官的再灌注损伤,使其功能得以恢复,反之可诱发或加重再灌注损伤[4]。
Tang等[5]提出亚低温可降低神经元凋亡数量,降低促凋亡基因如Bax以及一些半胱氨酸蛋白酶的表达,同时增加抗凋亡基因Bcl-2等的表达。亚低温也可能上调细胞生存途径,如激活通路和增加营养因子的表达。Sahuquillo等[6]、Zhao等[7]及Hu等[8]亦有相同报道。Okazaki等[9]新近研究在大鼠线栓法致局灶性脑缺血再灌注后3 h输入大鼠自体骨髓细胞后发现在大鼠脑缺血3 d时大脑皮质区Bcl-2表达明显增加,同时测得该区脱氧核苷酸末端转移酶介导的dUTP-生物素切口末端标记(TUNEL)阳性凋亡细胞数明显减少,并且可见由脑缺血所致的行为异常有所改善。自体骨髓细胞输入对脑缺血大鼠诸多方面的治疗作用可能源自Bcl-2的抗脑缺血作用,并且Bcl-2的这种作用与抗缺血神经元的凋亡作用有很大关联。陶晓峰等[10]在大鼠局部脑缺血后30 min给予亚低温4 h,分别于再灌注的不同时间点检测Bcl-2的表达情况,得出结论,亚低温能增加Bcl-2的表达,明显减轻缺血所致的损伤,并能明显抑制细胞凋亡,对大鼠缺血后神经功能的恢复有确切疗效。管玉华等[11]提出亚低温对抗脑缺血后神经元凋亡有5个信号传导途径,分别为Bcl-2家族调控、半胱氨酸天冬氨酸特异性蛋白酶-3(caspase-3)途径、促丝裂原活化蛋白激酶(MAPKs)途径、核因子κB(NF-κB)途径、PI3K/Akt途径。但是Sakurazawa等[12]在抗凋亡因子FNK与HLV/Tat的蛋白转导结合域融合的复合蛋白(PTD-FNK)和亚低温联合治疗的研究中得出结论对神经元凋亡的抑制途径可能通过caspase-12,而并非Bcl-2途径。本研究通过对亚低温干预的全脑缺血再灌注损伤后海马神经元凋亡情况的研究,来探讨Bcl-2途径是否和亚低温的脑保护机制有关。
本研究对照组神经元凋亡百分率明显高于假手术组,PI明显低于假手术组,表明全脑缺血再灌注损伤时海马神经元凋亡明确存在。对照组与假手术组比较,Bcl-2和Bax明显表达,FI>1.0,表达阳性,Bcl/Bax<1.0,表明凋亡发生受到Bcl-2基因家族比例的调控,再灌注48 h以Bax表达占优势。亚低温组和对照组的比较显示亚低温干预可显著降低神经元凋亡百分率,提高PI和Bcl-2表达,降低Bax表达。进一步比较亚低温组和对照组的Bcl/Bax比值,亚低温组比值大于对照组。
综上所述,全身亚低温可有效干预大鼠全脑缺血再灌注损伤后神经元的凋亡,其机制与Bcl-2、Bax表达有关,受到二者比值的调控。亚低温可以提高Bcl-2表达,降低Bax表达,从而使二者比值提高,干预神经元的凋亡。所以Bcl-2家族与亚低温对全脑缺血再灌注损伤神经元的保护机制有关,但是否多个途径共同作用及之间的关系尚有待进一步研究。
1 宋修云,胡金凤,陈乃宏.神经元凋亡与脑缺血疾病[J].中国药理学通报,2012,28(3):307-310.
2 塔长峰,吴定奇,马腾飞,等.亚低温治疗特重型颅脑损伤疗效观察[J].海南医学院学报,2011,17(3):369-371.
3 Strazevska E,Stasek J,Sevcik P.Neuroprotective use of mild hypothermia in patients with Severe vasospasms after subaraehnoid haemorrhage[J].Bratisl Lek Listy,2008,109(11):499-501.
4 戴建明,谭美娟,黄波.亚低温治疗对中度脑外伤患者炎症细胞因子的影响[J].实用心脑肺血管病杂志,2009,17(4):250.
5 Tang XN,Yenari MA.Hypothermia as a cytoprotective strategy in ischemic tissue injury[J].Ageing Res Rev,2010,9(1):61-68.
6 Sahuquillo J,Vilalta A.Cooling the injured brain:how does moderate hypothermia influence the pathophysiology of traumatic brain injury[J].Curr Pharm Des,2007,13(22):2310-2322.
7 Zhao H,Wang JQ,Shimohata T,et al.Conditions of protection by hypothermia and effects on apoptotic pathways in a rat model of permanent middle cerebral artery occlusion[J].J Neurosurg,2007,107(3):636-641.
8 Hu WW,Du Y,Li C,et al.Neuroprotection of hypothermia against neuronal death in rat hippocampus through inhibiting the increased assembly of GluR6-PSD95-MLK3 signaling module induced by cerebral ischemia/reperfusion[J].Hippocampus,2008,18(4):386-397.
9 Okazaki T,Magaki T,Takeda M,et al.Intravenous administration of bone marrow stromal cells increases survivin and Bcl-2 protein expression and improves sensorimotor function following ischemia in rats[J].Neurosci Lett,2008,430(2):109-114.
10 陶晓峰,刘畅,华正宇.亚低温对大鼠局灶性脑缺血再灌注后HIF-1α及凋亡相关蛋白变化的影响[J].中风与神经疾病杂志,2010,27(10):902-905.
11 管玉华,赵东刚.亚低温抗脑缺血后神经元凋亡的信号传导途径[J].广东医学,2010,31(13):1759-1761.
12 Sakurazawa M,Katsura K,Saito M,et al.Mild hypothermia enhanced the protective effect of protein therapy with transductive antideath FNK protein using a rat focal transient cerebral ischemia model[J].Brain Res,2012,1430:86-92.
Intervention of Mild Hypothermia on Nervous Apoptosis after Global Cerebral Ischemic Reperfusion Injury in Rats
CHEN Hui,BI Chang-bai,XUE Chun-qin,et al.Department of Pediatric,Dahua Hospital of Xuhui District,Shanghai 200237,China
ObjectiveTo investigate the intervention effect of mild hypothermia on neuronal apoptosis after global cerebral ischemic reperfusion injury in rats.Methods42 Wistar male rats were divided into sham operation group,control group and mild hypothermia group.Global cerebral ischemic reperfusion model was established in mild hypothermia group and control group by Pulsinelli-4VO method.While the sham operation group was only given neck skin and muscular layer incision to expose bilateral vertebral artery and carotid artery,but occlusion of vertebral artery and carotid artery was not performed.The sham operation group and control group were in room temperature and the mild hypothermia group was in mild hypothermia environment.Flow cytometry was used to detect the expression of Bcl-2 and Bax in hippocampus.ResultsThe nerve cell apoptosis percentage and proliferation index between sham operation group,control group and mild hypothermia group showed statistically significant difference(F=142.869,P<0.01;F=153.993,P<0.01).The expression of Bcl-2 and Bax in sham operationgroup was ignored due to its weakness.The expression of Bcl-2 and Bax between control group and mild hypothermia group showed statistically significant difference(t=63.747 and 28.803,P<0.01).The Bcl/Bax between the two groups also showed statistically significant difference(t=9.601,P<0.01).ConclusionWhole body mild hypothermia can effectively decrease nerve cells apoptosis after global cerebral ischemic reperfusion injury and its mechanism is related to the expression of Bcl-2 and Bax and is regulated by the value of Bcl/Bax.
Reperfusion injury;Mild hypothermia;Apoptosis;Bcl-2;Bax
R 743
A
1007-9572(2012)11-3858-03
10.3969/j.issn.1007-9572.2012.11.096
200237上海市徐汇区大华医院儿科(陈辉,薛春琴,景晓平,陈建萍);河北省人民医院儿科(毕长柏)
陈建萍,200237上海市徐汇区大华医院儿科;E-mail:chenhuidoctor@sina.com
2012-05-22;
2012-10-19)
(本文编辑:张小龙)

