连花清瘟胶囊抗柯萨奇B4病毒作用的实验研究
刘 钊,石福忠,杨占秋
(1 中南民族大学 药学院,武汉 430074; 2 武汉大学医学院 医学病毒学研究所,武汉 430071)
柯萨奇病毒(CV)属小核糖核酸科肠道病毒属.柯萨奇病毒可引起脑膜炎和轻度麻痹、胸膜痛、肋间痛、呼吸性疾病、结膜炎以及手足口综合征[1]. B组柯萨奇病毒是病毒性心肌炎的主要致病因素[2,3],近年国内外研究发现,柯萨奇病毒尤其是柯萨奇B4病毒(CVB4)在1型糖尿病中起重要作用[4];进而发现,CVB4的非结构蛋白P2C与人胰岛素表面的谷氨酸脱羧酶(GAD)具有同源序列.且无论CVB4在体内或体外均可侵犯人胰岛B细胞,导致其合成胰岛素功能受损[5,6].因此,研究者正努力寻找一种有效地抗CVB4的药物.
连花清瘟胶囊是从连翘、金银花、炙麻黄、炒苦杏仁、石膏、板蓝根、绵马贯众、鱼腥草、广藿香、大黄、红景天、薄荷脑、甘草中提取有效成份制成的胶囊剂,内容物为棕黄色至黄褐色颗粒,味微苦,气微香.被称为是一种超越“达菲”的抗流感药物.该药临床可治疗急性上呼吸道感染,未发现毒副作用[7];流感发病早期使用可明显减轻症状,效果显著且优于维C银翘片[8].该药还为一种广谱抗病毒的中成药对许多病毒有一定的抑制作用,但其抗柯萨奇病毒的作用却尚未见报道,故本实验拟研究中药连花清瘟胶囊体外抗CVB4的作用机理,为利用其广谱抗病毒活性和开发新的抗CVB药物提供一定的实验基础和理论依据.
1 实验
1.1 原料、试剂及仪器
1.1.1 药物
连花清瘟胶囊由石家庄以岭药业股份有限公司生产,产品批号(0911363).精确称取连花清瘟胶囊内含物0.02 g,置于干净小青瓶中,加入5 mL双蒸水,配制成终浓度为4000 μg/mL.使用前将此贮存液于0.04~0.06 MPa下灭菌15 min,冷却后密封置于4℃冰箱中冷藏备用.
1.1.2 细胞
Hep-2(鼻咽癌)细胞为武汉大学医学院医学病毒研究所保存.细胞生长液为含10 %新生牛血清的DMEM,细胞维持液为含2 %新生牛血清的DMEM,常规加入青霉素100 U/mL、链霉素100 U/mL.
1.1.3 病毒
CVB4于-80 ℃武汉大学医学院医学病毒学研究所保存,实验前复苏.病毒于Hep- 2细胞中活化增殖后, 采用Reed-Muench微量法滴定其滴度为10-4.713TCID50/mL,实验用100 TCID50/mL.
1.1.4 试剂
DMEM为GIBCO公司生产和 MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)为Hyclone公司产品. MTT以不含血清的MEM培养基配制成5 g/L溶液,过滤除菌后置4 ℃冰箱保存备用.二甲基亚砜(DMSO)由上海菲达有限公司提供.新生小牛血清购自三利公司.
1.1.5 主要仪器
Forma Scientific超净工作台,美国制造;TGL-16C型高速台式离心机,上海安亨科学仪器厂生产;OLYMPUS IMT-413型倒置显微镜,日本制造;DG3022-A型酶联免疫检测仪,第四军医大学、国营华东电子管厂联合研制.
1.2 实验方法
1.2.1 药物对细胞的毒性的测定
用胰酶将生长良好的Hep-2细胞分散成单个细胞悬液,按1×106个/mL浓度分种于96孔板,每孔0.1 mL. 置37 ℃,5 % CO2培养箱中培养. 24 h后弃培养液上清,换含不同浓度的含药维持液,每孔200 μL. 药物的终浓度依次为125,250,500,1000,2000,4000,640,800,1600 μg/mL.每种浓度重复4孔,实验同时设正常细胞对照、病毒对照.继续培养72 h后,以MTT(四甲基偶氮唑盐法)法检测细胞存活率.并根据细胞存活率,找出药物对细胞的最大无毒浓度范围.
1.2.2 细胞活性测定(MTT染色法)
根据Mosmann建立的MTT法测定细胞活性.弃培养上清液,每孔加5 mg/mL MTT的不含血清的DMEM 50 μL,37 ℃, 5 % CO2孵育4~6 h, 黄色的MTT被活细胞的线粒体脱氢酶还原成蓝色的甲簪结晶,小心吸出MTT, PBS洗3次,每孔加50 μL DMSO终止反应,振荡混匀, 在15 min内甲簪结晶被溶解,在波长570 nm下测定吸光度OD值. OD值与活细胞的数量呈正相关.
1.2.3 药物对CVB4生物合成的抑制作用的测定
于已长成单层的Hep-2细胞96孔板上,每孔接种50 μL的100 TCID50的CVB4病毒液,于37 ℃吸附90 min,弃病毒上清液.根据细胞毒性实验的结果,在药物无毒浓度范围内,加入不同浓度的含药维持液每孔0.2 mL,药物浓度依次为100,200,400,800,1600 μg/mL;同时设正常细胞对照、病毒对照、阳性药物病毒唑对照.每日观察细胞病变效应(CPE),约在病毒对照CPE为 +++~++++ 时弃培养液上清液,用MTT法检测病毒抑制率,并计算药物对CVB4的病毒抑制率.
1.2.4 药物抗病毒吸附实验
分别将不同浓度的连花清瘟胶囊加入Hep-2单层细胞孔中, 37℃作用6 h,弃上清液,再加 100 TCID50/mL滴度的CVB4100 μL/孔, 37 ℃吸附90 min后,弃上清液,加细胞维持液,37 ℃、5 % CO2培养,逐日观察细胞病变. 实验同时设正常细胞对照、病毒对照.
1.2.5 药物直接灭活病毒实验
将100 TCID50/mL滴度的CVB4与不同浓度的连花清瘟胶囊4℃作用6 h.反应体系为200 μL ,含100 μL的100 TCID50/mL滴度的CVB4和100 μL的药物,并保证药物的终浓度与药效学实验相同.然后将混合液接种于单层Hep-2细胞中,孵育1.5 h后,换用2 % DMEM培养液维持细胞生长,37 ℃、5 % CO2培养,逐日观察CPE. 实验同时设正常细胞对照、病毒对照.
1.2.6 计算公式和分析方法
CPE记录方法:“-”表示无CPE; “+” 表示有CPE,且“+” 、“++”、 “+++” 、“++++” 依次表示25 %、50 %、75 %、100 %的细胞出现CPE.
细胞存活率 =
(药物组平均OD570/细胞对照组平均OD570)×100%,
病毒抑制率=

1)结合细胞毒性实验和药物抗病毒实验的结果,用统计软件SPSS11.5的Probit回归法计算药物半数毒性浓度TC50和半数有效浓度IC50,得到药物治疗指数(TI= TC50/ IC50).采用治疗指数作为评价指标衡量各药物对病毒抑制的效力.
2)采用直线相关分析,观察中药连花清瘟胶囊不同剂量与细胞存活率、病毒抑制率等之间是否存在直线关系,并求出直线回归方程和相关系数.
2 结果与讨论
2.1 药物毒性的效果
中药连花清瘟胶囊的不同浓度对细胞的毒性结果见表1.通过光镜观察, 连花清瘟胶囊对Hep-2细胞毒性作用表现为:细胞变小、粘连、破碎、脱落、胞浆内颗粒增加,折光性增强.
由表1可知,连花清瘟胶囊的TC50>1000 μg/mL,说明其安全系数大. 当药物的TC50<500 μg/mL时,细胞存活率> 50 %;当TC50<125 μg/mL时细胞存活率>80 %. 当细胞经较高浓度的药物作用后,死亡细胞数增加,细胞存活率降低. 经直线回归分析,药物浓度与细胞存活率之间存在直线关系,P=0.001. 连花清瘟胶囊的直线方程和相关系数分别为:y=82.015-0.024x,r=-0.95.经计算,连花清瘟胶囊对Hep-2细胞的TC50为1097.28 μg/mL.接种药物前后Hep-2细胞形态变化见图1.

表1 连花清瘟胶囊对Hep-2细胞的毒性作用
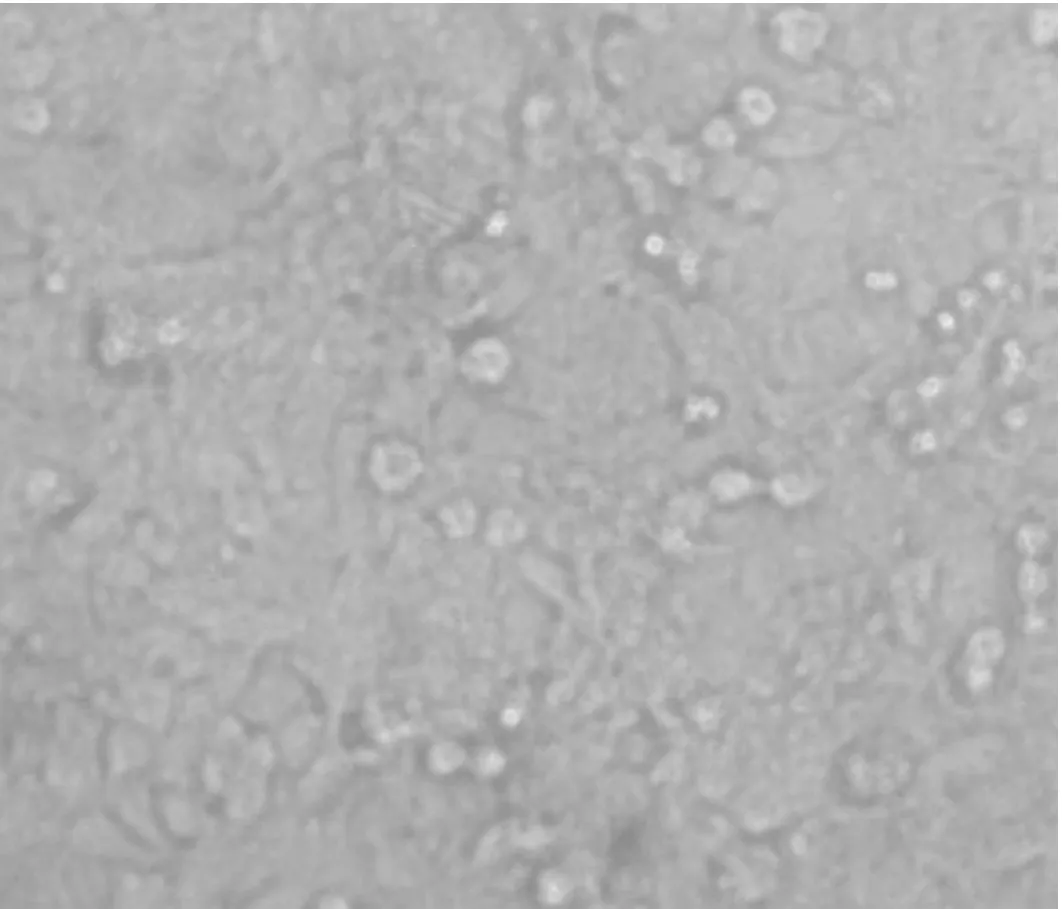
连花清瘟胶囊TC50=1000 μg/mL

b)正常细胞
2.2 药物抗病毒生物合成的效果
给药后24~48 h,镜下观察细胞病变,发现病毒对照孔出现明显的CPE,表现为细胞皱缩、变圆、脱落、碎裂,胞浆内颗粒增多,折光性增强(见图2).

a )感染细胞
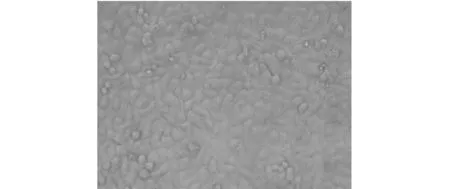
b)正常细胞
试验孔与病毒对照孔有明显的差别,试验孔存活细胞多于病毒对照孔,用MTT法按公式计算连花清瘟胶囊对CVB4的抑制率,结果见表2.
由表2可知,当药物浓度为100~1600 μg/mL时,随药物浓度增加,其抗病毒活性增强,病毒抑制率升高.经直线回归分析,药物浓度与病毒抑制率间有直线关系,P<0.01,其直线方程和相关系数分别为:y=14.155+0.023x,r= 0.883;当药物浓度>500 μg/mL时,对CVB4细胞病变抑制程度>50 %,表现较强的抗病毒活性,说明连花清瘟胶囊可明显抑制CVB4在Hep-2细胞内的生物合成.
2.4 药物抗病毒吸附的效果
给药后24~48 h内,镜下观察细胞病变,发现病毒对照孔出现明显的CPE,而各给药的不同浓度的试验孔均有明显多于病毒对照孔的存活细胞,用MTT法按公式计算连花清瘟胶囊对CVB4的抑制率,结果见表3.

表2 连花清瘟胶囊的抗CVB4生物合成作用
表3 连花清瘟胶囊的抗CVB4吸附细胞作用
由表3可知,当药物浓度100~1600 μg/mL时,随药物浓度增加,其抗病毒活性增强,病毒抑制率升高.经直线回归分析,药物浓度与病毒抑制率间有直线关系,P<0.05,其直线方程和相关系数分别为:y= 26.083+0.057x,r= 0.912;当药物浓度250 μg/mL时,对CVB4细胞病变抑制程度可达50 %,表现较强的抗病毒活性,说明连花清瘟胶囊可明显阻止病毒吸附细胞,从而预防CVB4对Hep-2细胞的感染.将药物抗病毒生物合成与抗病毒吸附的IC50相比,经方差分析,F=7114.615,P<0.01,有显著性差别;将两者的TI相比,F=43.74,P=0.003,P<0.01,说明连花清瘟胶囊预防CVB4感染细胞作用优于其抗CVB4在细胞内的生物合成作用.
2.4 药物直接灭活病毒的效果
按实验方法将药物与病毒混合6 h后再作用于细胞,逐日观察细胞病变.发现各给药的不同浓度的试验孔均有明显多于病毒对照孔的存活细胞,用MTT法按公式计算连花清瘟胶囊对CVB4的抑制率,结果见表4.

表4 连花清瘟胶囊的直接杀灭CVB4病毒作用
由表4可知,当药物浓度为6.25~100 μg/mL时,随药物浓度增加,其抗病毒活性增强,病毒抑制率升高.经直线回归分析,药物浓度与病毒抑制率间有直线关系,P<0.05,其直线方程和相关系数分别为:y= 27.182+0.055x,r= 0.921;当药物浓度为500 μg/mL时,对CVB4细胞病变抑制程度可达近65 %,表现较强的抗病毒活性,说明连花清瘟胶囊具有杀灭CVB4的作用.经方差分析,药物直接杀灭病毒作用.将其与抗病毒生物合成的IC50相比,F=4.234,P=0.109,P>0.05,无明显差别;两者TI 相比,F=0.015,P=0.908,P>0.05,无明显差别.将直接杀灭作用与抗病毒吸附作用的IC50相比,F=6771.744,P<0.01,有显著性差别; 两者TI 相比,F=42.135,P=0.003,P<0.01,有明显差别.说明药物的直接杀灭CVB4病毒作用与其抗病毒生物合成作用相似,而弱于其抗病毒吸附细胞作用.
3 结论
中药连花清瘟胶囊具有体外抗CVB4的作用及直接灭活CVB4作用,阻断CVB4吸附细胞作用和抑制CVB4在细胞内生物作用,其中抗CVB4吸附细胞即预防病毒感染作用最强.
[1]Fechner H, Pinkert S, Geisler A, et al. Pharmacological and biological antiviral therapeutics for cardiac coxsackievirus infections[J]. Molecules, 2011,16(10):8475-8503.
[2]Maghsoudi A H, Khodagholi F, Hadi-Alijanvand H, et al. Homology modeling, docking, molecular dynamics simulation, and structural analyses of coxsakievirus B3 2A protease: an enzyme involved in the pathogenesis of inflammatory myocarditis[J].Int J Biol Macromol, 2011,49(4): 487-492.
[3]Burke J D, Sonenberg N, Platanias L C, et al. Antiviral effects of interferon-βare enhanced in the absence of the translational suppressor 4E-BP1 in myocarditis induced by Coxsackievirus B3[J]. Antivir Ther, 2011,16(4):577-584.
[4]Sane F, Moumna I, Hober D. Group B coxsackieviruses and autoimmunity: focus on Type 1 diabetes[J]. Expert Rev Clin Immunol. 2011,7(3):357-366.
[5]Nair S, Leung K C, Rawlinson W D,et al. Enterovirus infection induces cytokine and chemokine expression in insulin-producing cells[J]. J Med Virol, 2010,82(11):1950-1957.
[6]Schulte B M, Kramer M, Ansems M, et al. Phagocytosis of enterovirus-infected pancreatic beta-cells triggers innate immune responses in human dendritic cells[J]. Diabetes, 2010,59(5):1182-1191.
[7]林如平, 刘 洪. 连花清瘟胶囊治疗急性上呼吸道感染疗效观察[J].四川医学,2010,31(9):1327-1328.
[8]刘更新,张艳霞,杨继清. 连花清瘟胶囊治疗甲型H1N1流感随机对照临床研究[J].疑难病杂志,2010,9(1):14-16.

