富含高丰度蛋白的人参果实双向电泳图谱的建立
马朋涛,孙立伟,麻 锐,雷秀娟,陈雪楠,祁 超*
(1.华中师范大学 生命科学学院,武汉 430079;2.北华大学 生命科学中心,吉林 吉林 132013;3.长春中医药大学 药学院,长春 130117;4.中国农业科学院 特产研究所,吉林 吉林 132109)
富含高丰度蛋白的人参果实双向电泳图谱的建立
马朋涛1,孙立伟2*,麻 锐3,雷秀娟4,陈雪楠2,祁 超1*
(1.华中师范大学 生命科学学院,武汉 430079;2.北华大学 生命科学中心,吉林 吉林 132013;3.长春中医药大学 药学院,长春 130117;4.中国农业科学院 特产研究所,吉林 吉林 132109)
通过常规的TCA-丙酮沉淀法和丙酮沉淀法对人参果实蛋白的提取效果,确立了丙酮沉淀法更适合人参果实蛋白的提取.为进一步改善其2-DE分离效果,对丙酮沉淀法提取的总蛋白用Tris-饱和酚提纯,在其2-DE图谱效果有所改善的基础上,又在Tris-饱和酚中加入等体积的氯仿/异戊醇(24∶1)对丙酮沉淀法提取的总蛋白进行再次提纯,最终得到质量较高的2-DE图谱,其高、低丰度蛋白都得到了较好的分离.
人参果实;蛋白提取;双向电泳;高丰度蛋白;低丰度蛋白
人参果实为名贵中药人参的成熟果实.研究发现,人参果实中总皂苷的含量是人参根部的4倍左右,尤其皂苷Re的含量远高于人参根部[1-2],所以人参果实除具有与人参根部相似的药理学效用外[3-4],其在降血糖方面的效果明显优于人参根部[5-7].然而人参果实作为一种极具药用潜质的中药材,长期以来人们对其研究却只停留在皂苷组分的分离提取和利用方面,而对其中非皂苷类物质及皂苷本身的合成规律、代谢途径和调控机制的研究却很少[8-12].蛋白质作为参与生命活动规律调节的酶的主要形式,是各种因素综合作用于基因的最终表达结果,它们直接参与人参果实中皂苷等次级代谢产物的合成和代谢的调控过程,所以从蛋白质角度可对人参果实药效成分的合成代谢规律及其功效作用机制进行直接有效的研究.
作为一种分离、鉴定和分析不同组织在特定条件下蛋白表达情况的技术——蛋白质组学技术可对人参果实蛋白进行高通量的分析和研究[13-14].然而,高质量、高重复率双向电泳(2-DE)图谱的获得是蛋白质组学研究的前提和关键.除了人参果实中含有的大量次级代谢产物会干扰高质量2-DE图谱的获得外[15-17],作者在对人参果实的研究中还发现,人参果实含有一些丰度极高的蛋白,极大地影响了高、低丰度蛋白的分离效果,尤其在目前对人参果实蛋白研究尚处于初始阶段的情况下,高丰度蛋白的性质尚不了解,这些都给人参果实2-DE图谱的获得带了很大困难,严重阻碍了人参果实蛋白质组学研究的发展[18-20].
基于以上问题,试图通过分析手段对高、低丰度蛋白进行同时分离,以寻求最好的高、低丰度蛋白的平衡分离效果.本文比较了几种蛋白提取流程的2-DE分离效果,层层递进,以确定每次方法改进所带来的提取效果的变化,最终确定了人参果实蛋白的最佳提取方案,得到了较为理想的2-DE图谱:在将高丰度蛋白进行有效分离的同时,还大大加强了低丰度蛋白的分离效果,为人参果实的蛋白质组学分析打下基础,同时也为同类含高丰度蛋白的果实类组织的2-DE分离提供方法学参考.
1 实验材料与方法
1.1 实验材料
新鲜成熟人参果实购与吉林省抚松县.购回后,立即加入液氮研磨,待成粉末后,放于-80℃冰箱冻存待用.
1.2 仪器与试剂
2-DE系统和固化IPG线性干胶条:购自GE公司.聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳仪:购自Bio-Rad公司.提取蛋白所需有机试剂均购自Amresco公司.乙醇、乙酸、丙酮等无机试剂均购自天津光夏精细化工研究所.
1.3 实验方法
1.3.1 蛋白提取方法
(1)TCA-丙酮沉淀法 取0.25g液氮研磨的人参果实粉末加于2mL洁净EP管,加入1.75mL预冷的含10%(m/v)TCA 和 0.07%(v/v)β-巯基乙醇的丙酮,漩涡震荡均匀后放入-20℃冰箱静置2h.15 000r/min、4℃条件下离心15min,弃上清,沉淀用100%丙酮洗涤3遍,每次在-20℃冰箱静置1h,15 000r/min、4℃条件下离心15min弃上清,沉淀在放置在4℃待丙酮挥发干净.加入0.5mL裂解液(7mol/L尿素,2mol/L硫脲,2%CHAPS,20mol/L DTT,1%(v/v)PMSF,1%(v/v)蛋白酶抑制剂),漩涡震荡混匀,冰浴条件下200W 超声35min,15 000r/min、4℃条件下离心15min,取上清.
(2)丙酮沉淀法 参照(1)方法,除去10%的TCA进行提取.
(3)Tris-饱和酚抽提 取上述(2)中提取蛋白溶液,加入等体积的Tris-饱和酚,并用30mol/L Tris溶液调节pH至8.0,震 荡 30mol/L,15 000r/min,4℃离心15min,取中下层,加入5倍体积的含10%(m/v)乙酸铵的甲醇溶液,-20℃静置过夜.15 000r/min,4℃离心15min,弃上清.最后分别用含10%(m/v)乙酸铵的甲醇溶液和丙酮洗涤沉淀两遍,将沉淀在4℃下晾干,用适量再水化液(5mol/L 尿素,2mol/L 硫脲,4%(m/v)CHAPS,2%(m/v)黄基三甲基胺乙内脂3-10)溶解沉淀.
(4)Tris-饱和酚-氯仿/异戊醇抽提 取上述(2)中提取蛋白溶液,加入等体积的Tris-饱和酚和-氯仿/异戊醇(24∶1)混合溶液(1∶1),并用30mmol/L Tris 溶液调节pH至8.0,震荡30min,15 000r/min,4℃离心15min,取中下层,加入5倍体积的含10%(m/v)乙酸铵的甲醇溶液,-20℃静置过夜.15 000r/min,4℃离心15min,弃上清.最后分别用含10%(m/v)乙酸铵的甲醇溶液和丙酮洗涤沉淀2遍,将沉淀在4℃下晾干,用适量再水化液(5mol/L尿素,2mol/L硫脲,4%CHAPS,2%(m/v)黄基三甲基胺乙内脂3-10)溶解沉淀.
1.3.2 蛋白含量测定 蛋白溶液含量测定采用Bradford法,以牛血清蛋白为标准蛋白绘制蛋白浓度和OD值之间的标准曲线,根据标准曲线计算待测蛋白溶液的蛋白浓度.
1.3.3 SDS-PAGE根据测得的蛋白浓度,取30μg蛋白加入等体积的上样缓冲液0.2%(w/v)溴酚 蓝、20%(v/v)甘油、4%(w/v)SDS、0.5mol/LpH8.0Tris-HCl、0.3%(w/v)DTT 进行12.5%的SDS-PAGE,电泳参数设置为:浓缩胶电流10mA,分离胶电流为20mA,电泳2h.
1.3.4 等点聚焦电泳(IEF)取1.5mg蛋白溶液,加入18μL D2Buffer(20mmol/L DTT,5mmol/L磷酸三氯乙酯,0.5%IPG buffer(pH3~10),0.3%IPG buffer(pH4~7))及适量再水化液至终体积450μL.采用24cm,pH3~10线性固化IPG干胶条进行IEF.参数设置如表1所示.

表1 IEF过程参数设置Tab.1 Preferences of IEF progress
1.3.5 二向电泳(2D-PAGE) IEF结束后,胶条分别用含1.0%(m/v)DDT和2.5%IAA 的平衡缓冲液(50mmol/L Tris-HCl,pH8.8、6mol/L U-rea、30%(v/v)甘油、2%SDS、0.002%(w/v)溴酚蓝储存液)平衡15min.然后胶条进行12.5%的SDS-PAGE,参数设置为:转移阶段功率为2.5W/胶条,电泳阶段功率为15W/胶条,电泳时间为6h.
1.3.6 凝胶染色与图像扫描 电泳结束后用凝胶染色仪进行凝胶的染色和脱色处理.待凝胶背景清晰后用Image scanner扫描仪进行图象扫描和分析.扫描参数设置为:256阶灰度、600dpi分辨率,图像保存为TIFF格式.扫描后的图像用Image Master 2DPlatinum Software Version 6.0(GE Healthcare)结合手动进行蛋白点的检测、匹配、数据分析和输出等.
2 结果与讨论
2.1 SDS-PAGE图谱的比较
各种蛋白提取方法所得的人参果实SDSPAGE电泳图谱如图1所示.

图1 人参果实4种蛋白提取方法的SDS-PAGE图谱Fig.1 SDS-PAGE(12.5%)pattern of ginseng fruit protein extrated by four methods
由图1可以看出,几种蛋白提取方法提取的蛋白一维条带在20 000,25 000附近均含有2条丰度极高的蛋白条带,经Image Master 2DPlatinum Software Version 6.0(GE Healthcare)分析可知,其条带总灰度可达全部条带灰度的90%以上.另外在15 000、35 000、5 000附近有4条丰度相对较高的蛋白条带,而在其他位置蛋白条带丰度极低,这种蛋白条带的分布将使得高丰度蛋白在某些区域过于集中而无法有效分离,同时低丰度蛋白浓度因此而所占比例更小,在更为广泛的2-DE图谱区域范围内会由于浓度过低而无法检测到.比较几种提取方法,可以发现,丙酮沉淀法、TCA-丙酮沉淀法所得的一维条带高丰度蛋白比例尤其较高,低丰度蛋白区域几乎没有条带,但丙酮沉淀法的分离效果要好于TCA-丙酮沉淀法.对丙酮沉淀提取法提取的蛋白溶液用Tris-饱和酚进一步提取,低丰度蛋白条带丰度和数目有明显改进.在此基础上,在Tris-饱和酚中加入等体积的氯仿/异戊醇(24∶1)对丙酮沉淀提取法提取的蛋白进行再次提纯,低丰度蛋白条带的数量和丰度进一步得到了提高.但几种蛋白提取流程对2-DE图谱分离效果的改进仅通过一维条带无法完全确定,尤其几种蛋白提取流程所得的高丰度蛋白条带并无明显变化.这还需对其进行2-DE分离,以确定各提取流程对人参果实全蛋白的2-DE分离效果.
2.2 2-DE图谱的比较
各种蛋白提取方法所得的人参果实2-DE图谱如图2所示.
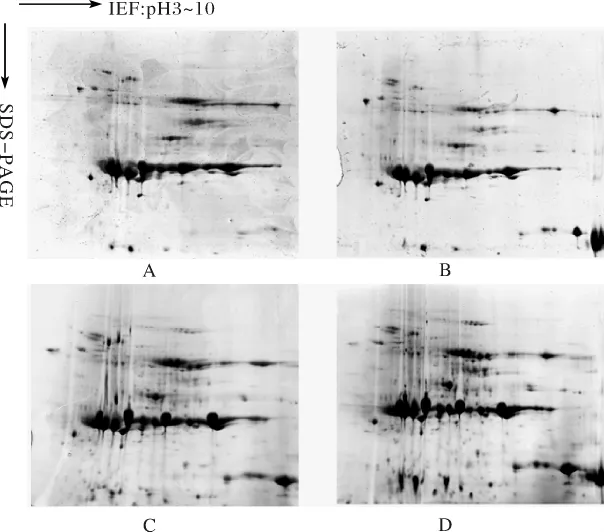
图2 人参果实4种不同蛋白提取方法的二维图谱(24cm,pH3~10)Fig.2 2-DE pattern of four protein extraction methods of ginseng fruit(24cm,pH3~10)
由图2可以看出,丙酮提取法、TCA-丙酮提取法得到的2-DE图谱只有几个高丰蛋白点和少量的低丰度蛋白点,且高丰度蛋白点几乎没有分开,呈连成一片趋势,这可能也会掩盖周围的低丰度蛋白点,也可能造成其他低丰度蛋白点所占比例过低,而无法在2-DE图谱上被检测到.但相比较而言,丙酮提取法的蛋白分离效果要稍好于TCA-丙酮沉淀法,这也印证了一维条带中二者效果的比较.
选定丙酮提取法提取的蛋白溶液用Tris-饱和酚进行提纯,通过Tris-饱和酚的强烈变性效果加强低丰度蛋白的变性溶解,其低丰度蛋白点明显增多,尤其在偏低分子量区域低丰度蛋白点得到明显改善.但中高分子量区域(20 000~50 000)低丰度蛋白点仍由于丰度过低仍然显得模糊不清分辨率不高,且高丰度蛋白仍然没有完全分离,其附近的低丰度蛋白也可能由此而被掩盖.在此基础上,在Tris-饱和酚中加入等体积的氯仿/异戊醇(24∶1),以加强一些脂溶性杂质的去除效果,同时还有Tris-饱和酚对蛋白的强烈变性作用,使得中高分子量区域的低丰度蛋白的分离也得到了进一步加强,且高丰度蛋白也得到了较好的分离,其附近也分离出一些新的低丰度蛋白点.

图3 人参果实不同提取方法分区域双向电泳图谱比较Fig.3 Comparion of different area of 2-DE pattern by different protein extraction methods
对4种蛋白提取方法的关键区域进行截图方法处理,得到了4个蛋白分离效果明显改进的区域(图3所示),在选定的A、B、C、D等4个区域中,可以看到,应用Tris-饱和酚-氯仿/异戊醇提取法得到的2-DE图谱与其他3种蛋白提取方法相比,很多蛋白点的分离效果得到了明显改善或获得了新的蛋白点,比如A4区域中10个高丰度蛋白点基本得到了很好的分离,且在这10个高丰度蛋白点附近的33个低丰度蛋白点(如A4中箭头所示)的分离效果得到了明显改善.而在B、C、D等3个区域中也分别有33个、37个、34个蛋白点(如B4、C4、D4中箭头所示)的分离效果也明显提高.这说明,采用Tris-饱和酚-氯仿/异戊醇提取法可对人参果实蛋白质的各种杂质进行比较完全的去除,从而改善了高丰度蛋白的分离效果,并且加强了低丰度蛋白点的分辨率,还得到了一批新的低丰度蛋白点.
高丰度蛋白和低丰度蛋白的分离一直是2-DE过程中的一大难题,尤其植物组织高度的特异性使得不同植物组织在特定的环境中呈现出不同的蛋白表达特点.很多植物组织都会由于特定环境的作用大量表达某些蛋白,然而这种特定环境下的蛋白表达模式严重阻碍了该组织蛋白质组学的研究.目前文献中报道了很多去除高丰度蛋白的方案来加强低丰度蛋白的相对浓度,以期实现低丰度蛋白较好的分离效果.但这些方案一般都是在对高丰度蛋白性质充分了解的基础上,针对高丰度蛋白特有的性质再利用亲和层析、沉淀和超滤离心以及等电点捕获法等物理学、化学技术,去除同一类别且与低丰度蛋白性质不同的一些高丰度蛋白[20-23].但对于人参果实来说,目前对其蛋白质的研究尚处于初始阶段,使得上述去除高丰度蛋白的方案无法应用于人参果实蛋白的处理.这是因为一方面目前还不了解其高丰度蛋白的相关特性,另一方面需要防止一些特性与高丰度蛋白相似的低丰度蛋白同时被去除.所以我们通过对蛋白提取流程进行逐步改进,以确定不同提取参数对高、低丰度蛋白统筹去除效果的变化,最终建立了最适合人参果实2-DE分析的蛋白提取流程.
3 结论
本文通过比较不同分析方法对人参果实2-DE图谱的改进效果,对高、低丰度蛋白进行了较好的平衡分离,获得了高质量的人参果实2-DE图谱.这为人参果实下一步的蛋白质组学研究打下了坚实基础,同时对类似的含有高丰度蛋白的组织具有很大的借鉴意义.
[1]Yahara S,Kaji K,Tanaka O.Further study on dammarane2type saponins of roots,leaves,flower-buds,and fruits of Panax ginseng C.A.Meyer[J].Chem Pharm Bull,1979,27(1):882-921.
[2]Yu L,Zhang X,Li S S,et al.Rhamnogalacturonan I domains from ginseng pectin[J].Carbohydr Polym,2010,79(4):811-817.
[3]Wang J Y,Li X G,Yang X W.Ginsenine,a new alkaloid from the berry of Panax ginseng C A Meyer[J].J Asian Nat Prod Res,2006,8(7):605-608.
[4]Choi Y E.Ginseng(Panax ginseng)[J].Methods Mol Biol,2006,344:361-371.
[5]Dey L,Xie J T,Wang A,et al.Anti-hyperglycemic effects of ginseng:Comparison between root and berry[J].Phytomedicine,2003,10(6-7):600-605.
[6]William C S,Chung W S,Lee S K W,et al.Ginsenoside Re of Panax ginseng possesses significant antioxidant and antihyperlipidemic efficacies in streptozotocin-induced diabetic rats[J].Eur J Pharmacol,2006,550(1-3):173-179.
[7]Jooa K M,Lee J H,Jeon H Y,et al.harmacokinetic study of ginsenoside Re with pure ginsenoside Re and ginseng berry extracts in mouse using ultra performance liquid chromatography/mass spectrometric method[J].Pharm Biomed A-nal,2010,51(1):278-283
[8]Shao Z H,Xie J T,Hoek T L V,et al.Antioxidant effects of American ginseng berry extract in cardiomyocytes exposed to acute oxidant stress[J].Biochim Biophys Acta-General Subjects,2004,1670(3):165-171.
[9]Morinaga O,Uto T,Yuan C S,et al.Evaluation of a new eastern blotting technique for the analysis of ginsenoside Re in American ginseng berry pulp extracts[J].Fitoterapia,2010,81(4):284-288.
[10]Xie J T,Wang C Z,Lia X L,et al.Anti-diabetic effect of American ginseng may not be linked to antioxidant activity:Comparison between American ginseng and Scutellaria baicalensis using an ob/ob mice model[J].Fitoterapia,2009,80(5):306-311.
[11]Wang J Y,Li X G,Zheng Y N,et al.Isoginsenoside-Rh3,a new triterpenoid saponin from the fruits of Panax ginseng C A Meyer[J].J Asian Nat Prod Res,2004,6(4):289-293.
[12]Dey L,Zhang L,Yuan C S.Anti-diabetic and anti-obese effects of ginseng berry extract:comparison between intraperitoneal and oral administrations[J].Am J Chin Med,2002,30(4):645-647.
[13]Rabilloud T,Chevallet M,Luche S,et al.Two-dimensional gel electrophoresis in proteomics:past,present and future[J].Proteomics,2010,73(11):2064-2077.
[14]Rabilloud T,Vaezzadeh A R,Potier N,et al.Power and limitations of electrophoretic separations in proteomics strategies[J].Mass Spectrom Res,2009,28(5):816-843.
[15]Zhao Y Q,Yuan C L,Lv H R.Chemical constituents of the fruit of Panax ginseng C A Meyer[J].Zhongguo Zhong Yao Za Zhi,1993,18(5):296-297,319.
[16]Tsugita A,Kamo M.2-D electrophoresis of plant proteins[J].Methods Mol Biol,1999,112:95-97.
[17]Saravanan R S,Rose J K.A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues [J]. Proteomics,2004,4:2522-2532.
[18]Bandow J E.Comparison of protein enrichment strategies for proteome analysis of plasma[J].Proteomics,2010,10(7):1416-1425.
[19]Stempfer R,Kubicek M,Lang I M,et al.Quantitative assessment of human serum high-abundance protein depletion[J].Electrophoresis,2008,29(21):4316-4623.
[20]Polaskova V,Kapur A,Khan A,et al.High-abundance protein depletion:comparison of methods for human plasma biomarker discovery[J].Electrophoresis,2010,31(3):471-482.
[21]Ahmed N,Rice G R.Strategies for revealing lower abundance proteins in two-dimensional protein maps[J].J Chromatogr B,2005,815:39-50.
[22]Natarajan S S,Krishnan H B,Lakshman S,et al.An efficient extraction method to enhance analysis of low abundant proteins from soybean seed[J].Anal Biochem,2009,394:259-268.
[23]Krishnan H B,Natarajan S S.A rapid method for depletion of Rubisco from soybean(Glycine max)leaf for proteomic analysis of lower abundance proteins[J].Phytochemistry,2009,70(17-18):1958-1964.
Establishment of 2-DE pattern of ginseng fruit,a tissue containing high levels of high abundant proteins
MA Pengtao1,SUN Liwei2,MA Rui3,LEI Xiujuan4,CHEN Xuenan2,QI Chao1
(1.College of Life Science,Huazhong Normal University,Wuhan 430070;2.Life Science Research Center,Beihua University,Jilin,Jilin 132013;3.College of Pharmacy,Changchun University of Traditional Chinese Medicine,Changchun 130023;4.Institute of Special Wild Economic Animal and Plant Science,Chinese Academy of Agricultural Sciences,Jilin,Jilin 132109)
In this paper,TCA-acetone precipitation method and acetone precipitation method were firstly compared and the latter was fixed to better suit the separation for the proteins of ginseng fruit.Then,the proteins extracted by the acetone precipitation method were optimized by the Tris-saturated phenol,which results in better improvement of the two-dimensional electrophoresis(2-DE)pattern.On this basis,equivoluminal chloroform/isoamyl alcohol(24∶1)was added to the Tris-saturated phenol to optimize the proteins extracted by the acetone precipitation method,and high-quality 2-DE was establish ultimately,which contains better separated spots of both higher and lower abundant proteins.It will lay the foundation for the proteomic analysis of ginseng fruit,and also provide a reference for 2-DE separation of proteins from similar tissues
ginseng fruit;protein extraction;2-DE;high abundant protein;low abundant protein
Q946
A
1000-1190(2012)02-0198-06
2011-09-20.
国家科技支撑计划项目(2007BAI38B02);国家自然科学基金项目(nsfc81041091).
*通讯联系人.E-mail:sunliwei1970@yahoo.com;E-mail:qichao@mail.ccnu.edu.cn.

