氧化还原因子-1的原核表达纯化及其活性鉴定*
丁正中, 张 璐, 李 涛
(1.浙江师范大学化学与生命科学学院,浙江金华 321004;2.艾青中学,浙江金华 321015)
氧化还原因子-1(Ref-1)是哺乳动物细胞中重要的双功能蛋白,在DNA损伤修复及抗氧化防御屏障中发挥着关键作用.Ref-1由318个氨基酸残基构成,分子量约为37 kD,包含2个主要功能域.Ref-1的C端功能区进化高度保守,约157个氨基酸,具有核酸内切酶活性.离子辐射、活性氧(radical oxygen substrates,ROS)和烷化剂等可引起DNA损伤,造成脱嘌呤/脱嘧啶位点(apurinic/apyrimidinic sites,AP 位点).Ref-1是 AP 位点碱基切除修复(base excision repair,BER)途径中主要的限速酶[1].如果Ref-1的这一功能缺陷,将造成AP位点累积,诱导细胞凋亡.放射治疗、烷化剂及核苷酸类似物药物(如:博莱霉素、替莫唑胺、吉西他滨等)均可显著增强Ref-1蛋白表达,是肿瘤细胞产生获得性耐药,最终导致药物失敏的重要机制[2-4].
Ref-1独特的亲水性N末端由约127个氨基酸组成,种属差异较大,该段序列赋予Ref-1氧化还原酶活性.氧化损伤造成半胱氨酸巯基发生二硫键交联、S-硝基化、谷胱甘肽化.通过还原半胱氨酸残基,Ref-1能回复氧化损伤蛋白的功能活性.Ref-1能显著促进许多转录因子的激活并提高它们的DNA结合能力,这代表了信号转导中一种新型的氧化还原调控模式,对真核基因表达意义重大[5].氧化应激条件下,Ref-1表达增高或磷酸化活化,引起参与氧化还原调节的激活蛋白-1(AP-1)等转录因子活性变化,进而引起下游靶基因的活化,使一些对细胞具有保护作用的蛋白得到表达.因此,抑制Ref-1氧化还原酶活性,亦能促进肿瘤细胞凋亡、抑制肿瘤增殖.
Ref-1的高表达、活性增高及亚细胞定位改变与多种肿瘤的发生有关,并关系到肿瘤的恶性程度以及放化疗的敏感性[6-8].如何抑制Ref-1的表达或活性,是目前肿瘤靶向治疗的重要课题.本实验通过原核表达纯化人源Ref-1蛋白,建立了其活性检测体系,为进一步研究Ref-1蛋白的功能、筛选Ref-1特异性抑制剂建立前期基础.
1 材料与方法
1.1 材料
菌株BL21(DE3)和质粒pGEX-4T-3为浙江师范大学动物生理实验室保存.pRc/RSV-Ref-1质粒由日本名古屋大学Fukushi Kambe教授惠赠.
1.2 原核表达载体的构建
HindⅢ和XbaⅠ双酶切将Ref-1编码片段从pRC/RSV真核表达载体中释放出来,插入pBluesciptⅡ SK(+)相应位点.pBluesciptⅡSK(+)/Ref-1质粒经SalⅠ和NotⅠ双酶切释放Ref-1编码片段,插入pGEX-4T-3相应位点,完成Ref-1原核表达载体的构建.挑取单克隆进行酶切鉴定,并由北京奥科公司测序,确定基因正确插入且无突变.
1.3 GST-Ref-1融合蛋白的表达
重组质粒转化感受态细菌BL21,挑克隆,在含氨苄西林(Amp)的LB培养基上摇菌过夜.将50 mL培养液扩大培养至1 000 mL LB培养液中220 r/min培养2~4 h,使 A600=0.6,降低温度至30℃,加异丙基-β-D-硫代吡喃半乳糖苷(IPTG)至终浓度为0.4 mmol/L,摇菌4~6 h.收集菌液,每1 000 mL细菌用40 mL磷酸盐缓冲液(PBS)重悬,冰上超声直至液体不再混浊,4℃,14 000 r/min离心20 min,收集上清液.分别取诱导前后的培养液及超声离心后的上清液和沉淀,加入2×十二烷基硫酸钠(SDS)上样缓冲液,煮沸后进行SDS-聚丙烯酰胺凝胶电泳(PAGE),分析融合蛋白的表达情况.
1.4 GST-Ref-1融合蛋白的纯化
加1 mL 50%谷胱甘肽琼脂糖凝胶4B(Glutathione Sepharose 4B)溶液至超声后的上清液中,室温下垂直混悬器混悬结合过夜,4℃,500 r/min离心5 min后,收集珠子,预冷的1 mL磷酸盐缓冲液洗5遍,离心后收集珠子,加1 mL 10 mmol/L还原型谷胱甘肽洗脱缓冲液,垂直混悬器轻轻混悬20 min,4 ℃,500 r/min离心5 min,吸出上清液置新管中.再重复洗涤3次,分别收集上清液.
将上清液收集入透析袋,4℃透析3次,每4 h更换透析液(PBS),聚乙二醇8000(PEG8000)浓缩至1 mL,加入终含量为10%的甘油,含0.5 mmol/L二硫苏糖醇(DTT),-80℃保存.纯化后的蛋白进行SDS-PAGE分析,考马斯亮蓝染色检测条带.谷胱甘肽巯基转移酶(GST)按上述方法表达纯化.
1.5 蛋白质印迹(Western blot)
分别取10 μL纯化的GST-Ref-1及GST进行SDS-PAGE分析,湿式电转化转膜.以兔源Ref-1抗体为一抗,辣根过氧化物酶(HRP)标记的抗兔抗体为二抗,用电化学发光(ECL)显色试剂盒显影曝光,鉴定表达产物.
1.6 GST-Ref-1氧化还原酶活性的检测
应用凝胶阻滞法检测GST-Ref-1氧化还原酶活性.按文献方法提取HeLa细胞核蛋白,建立体外反应体系[9-10].北京奥科公司合成转录因子AP-1特异识别的双链探针,正链序列为5'-CGCTTGATGACTCAGCCGGAA-3'.T4多聚核苷酸激酶对探针进行末端32P标记.在每组反应混合物中,核蛋白用量为40 μg,GST-Ref-1的用量是400 ng.核蛋白与GST-Ref-1体外混匀后,用终浓度为20 mmol/L的H2O24℃处理15 min后,用6%非变性聚丙烯酰胺凝胶电泳,放射自显影显示AP-1蛋白与探针DNA结合条带.
2 结果与分析
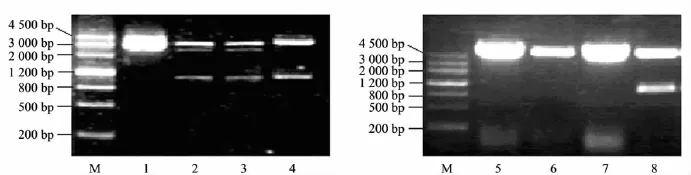
图1 质粒酶切鉴定图
2.1 Ref-1原核表达载体的构建及鉴定
Ref-1原核表达载体的构建流程如下:首先,用HindⅢ和XbaⅠ双酶切将Ref-1编码片段从测序正确的pRC/RSV真核表达载体中释放出来,之后将Ref-1编码片段插入pBluesciptⅡ SK(+)相应位点,经鉴定2-4泳道的克隆均为正确插入目的基因的重组质粒(见图 1(a));接着,用SalⅠ和NotⅠ双酶切释放约1 kb的Ref-1编码片段,插入pGEX-4T-3相应位点,从而完成GSTRef-1原核表达载体的构建,经鉴定8泳道的克隆为目的重组质粒(见图1(b)).图1中酶切出现1 kb左右的条带,说明获得了Ref-1编码片段.测序结果表明,pGEX-4T-3/Ref-1质粒构建正确,读码框无移码,无碱基错配.
2.2 GST-Ref-1融合蛋白的原核诱导表达
将pGEX-4T-3/Ref-1质粒转入BL21(DE3)菌株,IPTG诱导表达外源基因.为了能够检测融合蛋白的表达效率及其可溶性,分别取诱导前后的菌体及裂菌后的上清液、沉淀,同时进行SDSPAGE,对凝胶进行考马斯亮蓝染色,分析蛋白条带.如图2所示,GST-Ref-1蛋白得到了有效的表达,2号孔为诱导后蛋白电泳条带,在65 kD左右出现明显的诱导条带,符合理论预期.并且,GSTRef-1蛋白的表达性质基本为可溶性表达,3号孔为上清液样品,可发现其中含有大量的GST-Ref-1融合蛋白.这些证据表明GST-Ref-1原核表达成功,并且基本为可溶性表达,极有利于下一步的纯化操作及后续研究.
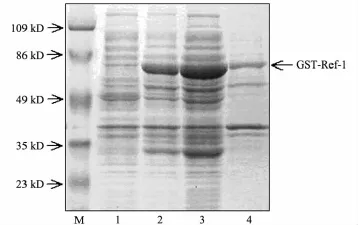
图2 GST-Ref-1融合蛋白诱导表达图
2.3 GST-Ref-1融合蛋白的亲和纯化
采用谷胱甘肽琼脂糖凝胶4B珠子亲和富集GST-Ref-1融合蛋白,再用10 mmol/L还原型谷胱甘肽洗脱GST-Ref-1融合蛋白,分别流洗4次,每个批次的洗脱液取10 μL做SDS-PAGE染色,如图3所示,GST-Ref-1融合蛋白得到了有效的亲和纯化,并以第2次流洗的效率最高.Science lab软件灰度扫描,得出纯化蛋白的纯度为92%.对纯化的GST-Ref-1融合蛋白进行透析去除谷胱甘肽,PEG8000浓缩后加甘油冻存于-80℃冰箱中.
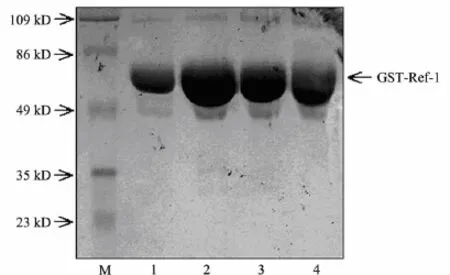
图3 GST-Ref-1融合蛋白亲和纯化后产物的电泳图
为了计算融合蛋白的诱导效率及亲和纯化的蛋白得率,实验中对每次保留的蛋白都进行了BCA法蛋白定量.首先通过Science lab软件灰度扫描分析,得出诱导后GST-Ref-1融合蛋白占菌体蛋白的比率为21.5%.再经BCA法蛋白定量,得出经亲和纯化浓缩后的GST-Ref-1融合蛋白占诱导后原始菌体的比率为6.8%,占超声裂解后上清液中蛋白的比率为11.7%.
2.4 蛋白质印迹(Western blot)检测
蛋白质印迹检测验证GST融合蛋白是否为表达序列正确的Ref-1蛋白.如图4所示,只有GST-Ref-1条带位置能检测到强化学发光信号,而对照GST条带无发光信号.表明GST-Ref-1原核表达质粒能够正确表达Ref-1融合蛋白,具有良好的抗原性.
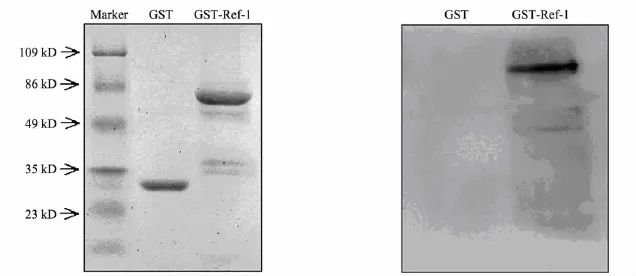
图4 GST-Ref-1融合蛋白纯化终产物PAGE考马斯亮蓝染色及蛋白质印迹检测
2.5 GST-Ref-1蛋白活性的检测
许多转录因子受到Ref-1氧化还原调控,如AP-1,NFκB,CREB,ATF,NF-Y 和 p53 等,Ref-1 能直接增强转录因子的DNA结合能力.为了验证GST-Ref-1融合蛋白是否具备活性,通过凝胶阻滞实验对其氧化还原酶活性进行了检测.结果如图5所示:GST-Ref-1直接增强了AP-1与靶DNA的结合量,而GST蛋白本身对AP-1的DNA结合能力无影响,表明GST-Ref-1融合蛋白能增强AP-1的DNA结合能力;同时,H2O2抑制了AP-1与探针的结合,但同时加入GST-Ref-1蛋白能部分恢复AP-1的DNA结合活性.表明GST-Ref-1融合蛋白具有氧化酶活性.
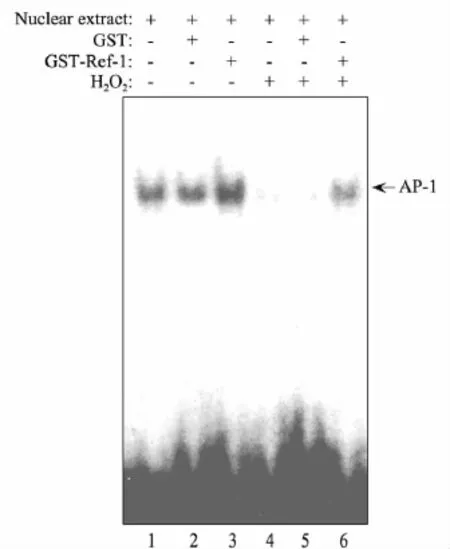
图5 凝胶阻滞法检测GST-Ref-1融合蛋白氧化还原酶活性
3 讨论
本实验采用pGEX-4T-3载体系统,通过IPTG诱导表达,获得了GST-Ref-1融合蛋白的可溶性表达,并进行了亲和纯化,蛋白在菌体中未出现明显的降解.该系统有利于GST-Ref-1融合蛋白的可溶性表达与亲和纯化,纯化条件温和、步骤简单,同时能极大限度地保持融合蛋白的空间结构和免疫原性,有利于下一步实验操作.本实验所获得的GST-Ref-1融合蛋白,可用于抗体制备,利用GST pull-down实验揭示 Ref-1互作蛋白,筛选Ref-1蛋白抑制剂.
Ref-1是重要的抗氧化基因,亦是重要的肿瘤耐药基因.Ref-1具有AP内切酶活性,可修复放射、烷化剂、氧化应激造成的DNA损伤;同时其所具有的氧化还原酶活性能调控大量转录因子的活性,上调 Bcl-2等抗凋亡基因的表达.Robertson等[11]首先发现,在宫颈癌、睾丸癌中Ref-1过表达可增强其对博来霉素和射线的抵抗.Fishel等[12]研究发现,Ref-1在卵巢肿瘤中高表达,如利用siRNA技术将其沉默掉,肿瘤体积明显缩小,细胞增殖减慢,阻滞于细胞周期S期.王东研究组[13]构建了Ref-1的RNAi质粒,转染骨肉瘤细胞系9901,发现抑制Ref-1表达能够下调血管来源的生长因子(VEGF)表达,抑制肿瘤微血管的形成,同时提高了骨肉瘤细胞放疗的敏感性.Ref-1还能诱导肿瘤细胞的多药耐药性.近期研究发现,Ref-1调控转录因子 YB-1,从而诱导多药耐药基因MDR1的表达[14].MDR1基因编码跨膜蛋白 P-糖蛋白,P-糖蛋白为药物泵,通过三磷酸腺苷(ATP)提供能量,可将药物泵出细胞外,使其细胞毒作用减弱直至丧失,出现耐药现象.因此,Ref-1是肿瘤治疗的重要靶向分子.
研究者开发了多种药物试图封闭Ref-1的表达或活性[15-17].第1类为AP内切酶活性抑制剂,主要有7-硝基吲哚-2-甲酸、CRT0044876、硫蒽酮和甲氧胺;第2类为氧化还原酶活性抑制剂,如E3330和白藜芦醇,此类抑制剂往往同时抑制活性氧通路及NFκB的活化,效应相对较广;第3类则是能够抑制Ref-1表达的化学物质,如大豆异黄酮.
本实验表达的GST-Ref-1融合蛋白,经体外凝胶阻滞实验发现具有氧化酶活性,能直接增强AP-1的DNA结合能力,并能抑制H2O2对AP-1蛋白的损伤.如何构建合适的药物筛选体系,检验药物对Ref-1 AP内切酶及氧化还原酶活性的影响,将是一个有意义的研究方向.
[1]Fishel M L,Kelley M R.The DNA base excision repair protein Ape1/Ref-1 as a therapeutic and chemopreventive target[J].Mol Aspects Med,2007,28(3/4):375-395.
[2]Bobola M S,Finn L S,Ellenbogen R G,et al.Apurinic/apyrimidinic endonuclease activity is associated with response to radiation and chemotherapy in medulloblastoma and primitive neuroectodermal tumors[J].Clin Cancer Res,2005,11(20):7405-7414.
[3]Zhang Ying,Wang Jian,Xiang Debing,et al.Alterations in the expression of the apurinic/apyrimidinic endonuclease-1/redox factor-1(APE1/Ref-1)in human ovarian cancer and indentification of the therapeutic potential of APE1/Ref-1 inhibitor[J].Int J Oncol,2009,35(5):1069-1079.
[4]熊光苏,吴叔明,徐晓晶,等.吉西他滨对人胰腺癌Patu-8988细胞株APE/Ref-1的诱导作用[J].世界华人消化杂志,2007,15(12):1425-1428.
[5]Bhakat K K,Mantha A K,Mitra S.Transcriptional regulatory functions of mammalian AP-endonuclease(APE1/Ref-1),an essential multifunctional protein[J].Antioxid Redox Signal,2009,11(3):621-638.
[6]Jiang Y,Zhou S,Sandusky G E,et al.Reduced expression of DNA repair and redox signaling protein APE1/Ref-1 impairs human pancreatic cancer cell survival,proliferation,and cell cycle progression[J].Cancer Invest,2010,28(9):885-895.
[7]Wang Dong,Luo Meihua,Kelley M R.Human apurinic endonuclease 1(APE1)expression and prognostic significance in osteosarcoma:enhanced sensitivity of osteosarcoma to DNA damaging agents using silencing RNA APE1 expression inhibition[J].Mol Cancer Ther,2004,3(6):679-686.
[8]陈连生,王东,张云嵩,等.DNA损伤修复基因APE1表达与非小细胞肺癌术后治疗及预后关系的研究[J].重庆医学,2007,36(19):1915-1917.
[9]Merluzzi S,Moretti M,Altamura S,et al.CD40 stimulation induces Pax5/B SAP and EBF activation through a APE/Ref-1-dependent redox mechanism[J].J Biol Chem,2004,279(3):1777-1786.
[10]耿燕,李涛,胡晓青,等.氧化还原因子1促进乳鼠心肌成纤维细胞增殖[J].北京大学学报:医学版,2009,41(3):335-342.
[11]Robertson K A,Bullock H A,Xu Y,et al.Altered expression of Ape1/ref-1 in germ cell tumors and overexpression in NT2 cells confers resistance to bleomycin and radiation[J].Cancer Res,2001,61(5):2220-2225.
[12]Fishel M L,He Y,Reed A M,et al.Knockdown of the DNA repair and redox signaling protein Ape1/Ref-1 blocks ovarian cancer cell and tumor growth[J].DNA Repair,2008,7(2):177-186.
[13]Wang Dong,Zhong Zhaoyang,Li Mengxia,et al.Vector-based Ape1 small interfering RNA enhances the sensitivity of human osteosarcoma cells to endostatin in vivo[J].Cancer Sci,2007,98(12):1993-2001.
[14]Chattopadhyay R,Das S,Maiti A K,et al.Regulatory role of human AP-endonuclease(APE1/Ref-1)in YB-1-mediated activation of the multidrug resistance gene MDR1[J].Mol Cell Biol,2008,28(23):7066-7080.
[15]Bapat A,Fishel M L,Kelley M R.Going ape as an approach to cancer therapeutics[J].Antioxid Redox Signal,2009,11(3):651-668.
[16]Reed A M,Fishel M L,Kelley M R.Small-molecule inhibitors of proteins involved in base excision repair potentiate the anti-tumorigenic effect of existing chemotherapeutics and irradiation[J].Future Oncol,2009,5(5):713-726.
[17]Luo M,Delaplane S,Jiang A,et al.Role of the multifunctional DNA repair and redox signaling protein Ape1/Ref-1 in cancer and endothelial cells:small-molecule inhibition of the redox function of Ape1[J].Antioxid Redox Signal,2008,10(11):1853-1867.

